正在加载图片...
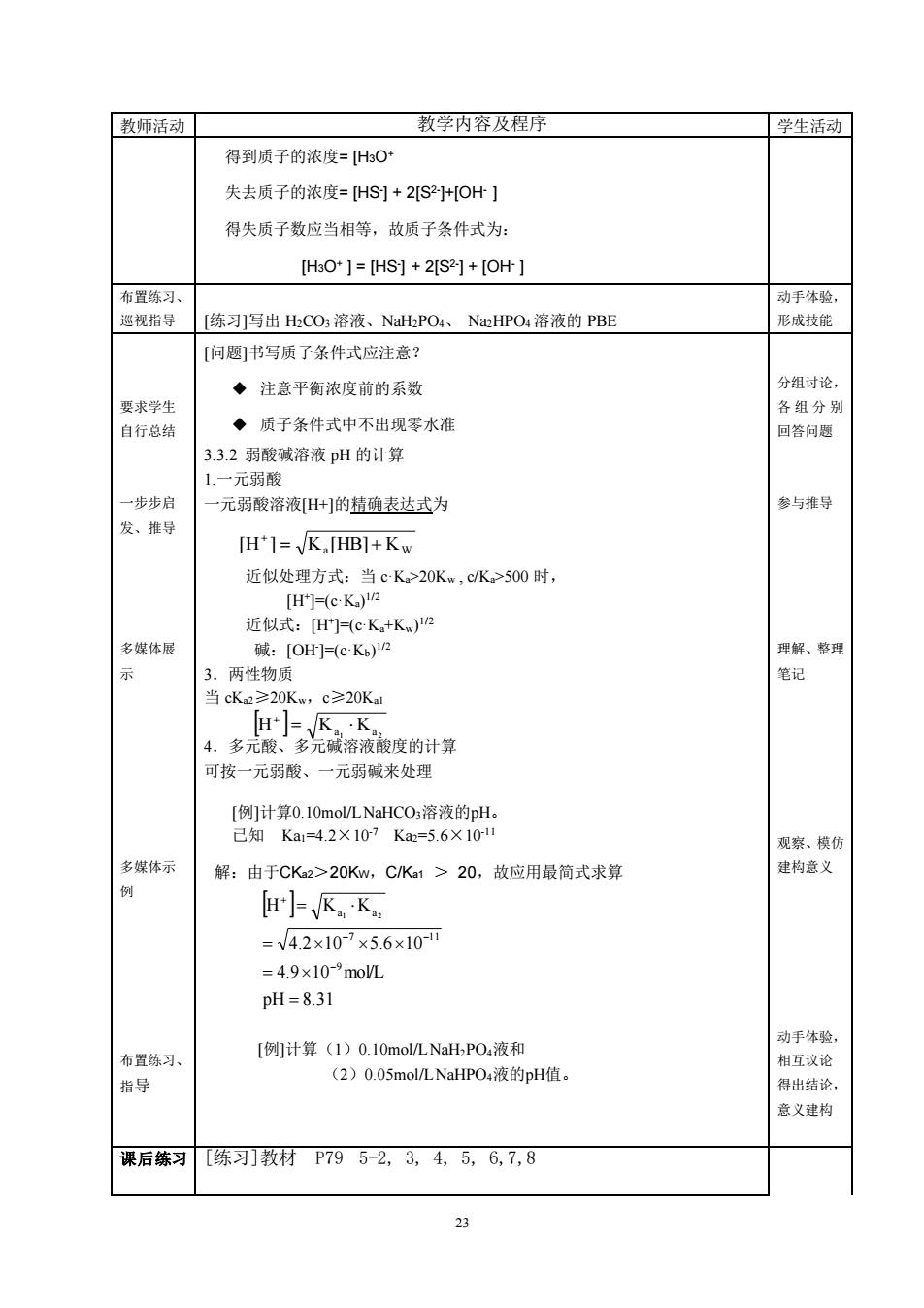
「教师活动 教学内容及程序 学生活动 得到质子的浓度=[HsO 失去质子的浓度=HS]+2S2]+OH】 得失质子数应当相等,故质子条件式为 [HsO*]=[HS]+2[S2]+[OH-] 布置练习 动手体验 巡视指导 [练习]写出HCO溶液、NaH:PO.、Na:HPO,溶液的PBE 形成技能 [问题]书写质子条件式应注意? ◆注意平衡浓度前的系数 分组讨论 要求学生 各组分别 自行总绍 ◆质子条件式中不出现零水准 回答问题 3.32弱酸碱溶液pH的计算 1.一元弱酸 一步步启 一元弱酸溶液[+]的精确表达式为 参与推导 发、推号 [H]=√K,HB]+Kw 近似处理方式:当cK>20Kw,cK>500时, [H]=(c-Ka) 近似式:Hr=(cK+K)n 多媒体展 碱:[Of-(eK)2 理解、整理 3。两性物质 笔记 当cK≥20Kw,c≥20K1 4.多度的计算 H*= 可按一元弱酸、一元弱碱来处理 【例]计算0.10 mol/LNaHCO3溶液的pH. 已知Ka1=4.2X107Ka=5.6×10 观察、模仿 多媒体示 解:由于CK2>20Kw,CKa1>20,故应用最简式求算 建构意义 旧]√K,K =V4.2×10-7×5.6x10 =4.9x10-°moL pH=8.31 [例计算(1)0.10 mol/LNal,PO,液和 动手体验 (2)0.05mol/LNaHPO:液的pH值。 相互议论 得出结论 意义建构 课后练习[练习教材P795-2,3,4,5,6,7,8 23 教师活动 教学内容及程序 学生活动 得到质子的浓度= [H3O+ 失去质子的浓度= [HS- ] + 2[S2- ]+[OH- ] 得失质子数应当相等,故质子条件式为: [H3O+ ] = [HS- ] + 2[S2- ] + [OH- ] 布置练习、 巡视指导 [练习]写出 H2CO3 溶液、NaH2PO4、 Na2HPO4 溶液的 PBE 动手体验, 形成技能 要求学生 自行总结 [问题]书写质子条件式应注意? ◆ 注意平衡浓度前的系数 ◆ 质子条件式中不出现零水准 分组讨论, 各组分别 回答问题 一步步启 发、推导 3.3.2 弱酸碱溶液 pH 的计算 1.一元弱酸 一元弱酸溶液[H+]的精确表达式为 参与推导 多媒体展 示 近似处理方式:当 c·Ka>20Kw , c/Ka>500 时, [H+ ]=(c·Ka) 1/2 近似式:[H+ ]=(c·Ka+Kw) 1/2 碱:[OH- ]=(c·Kb) 1/2 3.两性物质 当 cKa2≥20Kw,c≥20Ka1 4.多元酸、多元碱溶液酸度的计算 可按一元弱酸、一元弱碱来处理 理解、整理 笔记 多媒体示 例 观察、模仿 建构意义 布置练习、 指导 动手体验, 相互议论 得出结论, 意义建构 课后练习 [练习]教材 P79 5-2, 3, 4, 5, 6,7,8 [例]计算0.10mol/L NaHCO3溶液的pH。 已知 Ka1=4.2×10-7 Ka2=5.6×10-11 pH 8.31 4.9 10 mol/L 4.2 10 5.6 10 H K K 9 7 11 a a 1 2 = = = = − − − + 解:由于CKa2>20KW,C/Ka1 > 20,故应用最简式求算 [例]计算(1)0.10mol/L NaH2PO4液和 (2)0.05mol/L NaHPO4液的pH值。 [H ] = Ka [HB] + K W + 1 2 H Ka Ka = +