正在加载图片...
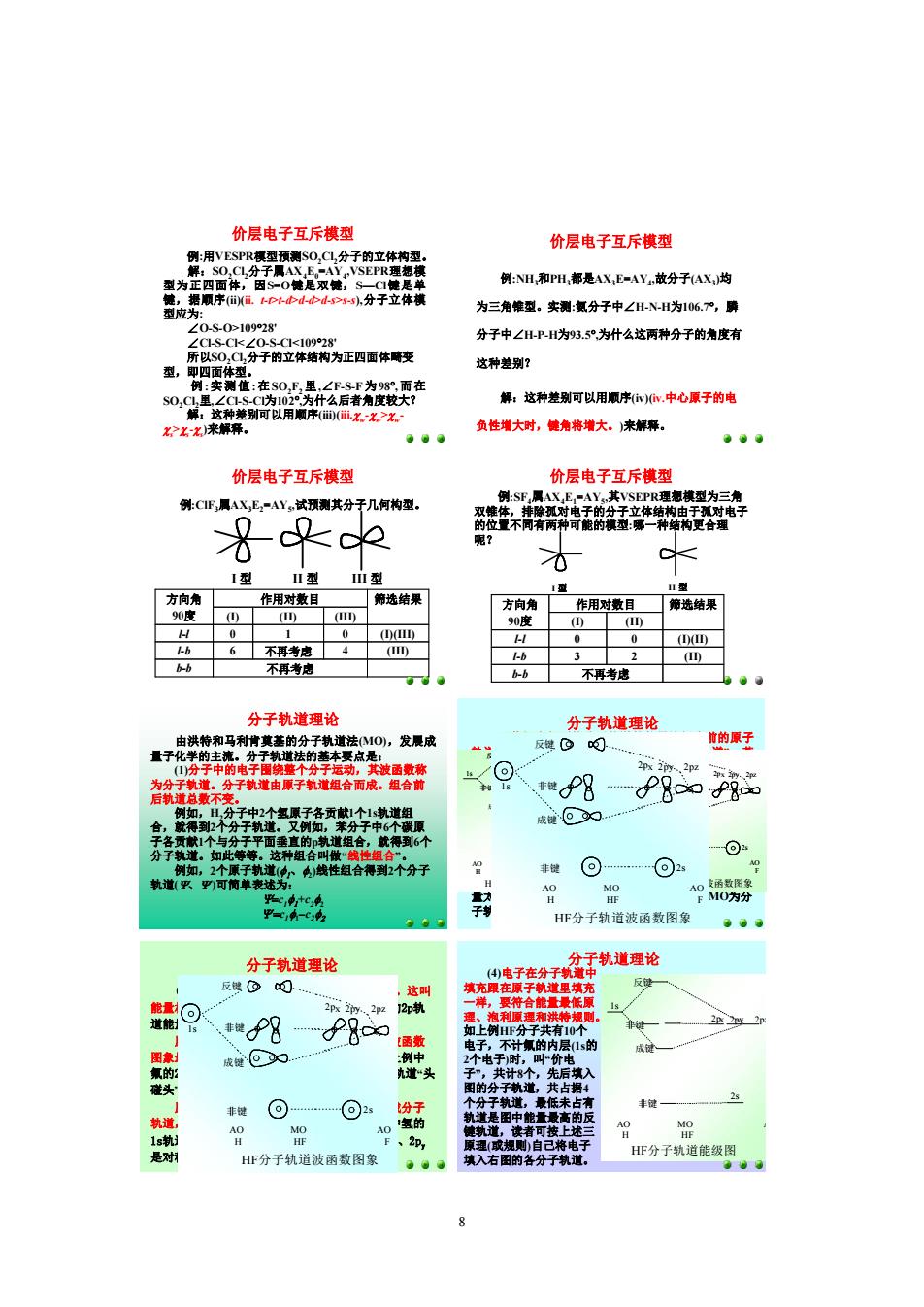
价层电子互斥模型 价层电子互斥模型 例:NH和H都是A飞,F=AY,被分子AX,均 分子立体铺 为三角型。实测:分子中∠HNH为106,明 分子中∠H-P-H为93.5°为什么这两种分子的角度有 即四体 这种楚别? 别可以用 解:这种楚别可以用顺序w,中心原子的电 负增大时,角将增大。来解释 价层电子互斥模型 价层电子互斥棋型 例:CF,属X,E-AY,试预测其分于几何构型 0 方向角 作用对数日 前迹结果 6 6-6 不再考惠 分子轨道理论 分子轨道理论 分的分教道法O,发成 反D 曹的原子 丰楼P明 P8 刀分 HF分子轨道波函数图象 分子轨道理论 分子轨道理论 电子在 2pz 非牌P8 ⊙ 2 ,读 2p, HF分子轨道波函数图象 HF分子轨道能级 008 例:用VESPR模型预测SO2Cl 2分子的立体构型。 解:SO2Cl 2分子属AX 4E0=AY 4 ,VSEPR理想模 型为正四面体,因S=O键是双键,S—Cl键是单 键,据顺序(ii)(ii. tt>td>dd>ds>ss),分子立体模 型应为: ∠OSO>109°28' ∠ClSCl<∠OSCl<109°28' 所以SO 2Cl 2分子的立体结构为正四面体畸变 型,即四面体型。 例 :实测值 :在SO2F2 里,∠FSF 为98°,而在 SO2Cl 2里,∠ClSCl为102°,为什么后者角度较大? 解:这种差别可以用顺序(iii)(iii.cw cw>cw cs>cscs)来解释。 价层电子互斥模型 例:NH 3和PH 3都是AX 3E=AY 4 ,故分子(AX 3)均 为三角锥型。实测:氨分子中∠HNH为106.7°,膦 分子中∠HPH为93.5°,为什么这两种分子的角度有 这种差别? 解:这种差别可以用顺序(iv)(iv.中心原子的电 负性增大时,键角将增大。)来解释。 价层电子互斥模型 价层电子互斥模型 例:ClF3属AX 3E2=AY 5 ,试预测其分子几何构型。 bb 不再考虑 lb 6 不再考虑 4 (III) ll 0 1 0 (I)(III) (I) (II) (III) 方向角 作用对数目 筛选结果 90度 I 型 II 型 III 型 价层电子互斥模型 例:SF4属AX 4E1=AY 5 ,其VSEPR理想模型为三角 双锥体,排除孤对电子的分子立体结构由于孤对电子 的位置不同有两种可能的模型:哪一种结构更合理 呢? I 型 II 型 bb 不再考虑 lb 3 2 (II) ll 0 0 (I)(II) (I) (II) 方向角 作用对数目 筛选结果 90度 分子轨道理论 由洪特和马利肯奠基的分子轨道法(MO),发展成 量子化学的主流。分子轨道法的基本要点是: (1)分子中的电子围绕整个分子运动,其波函数称 为分子轨道。分子轨道由原子轨道组合而成。组合前 后轨道总数不变。 例如,H 2分子中2个氢原子各贡献1个1s轨道组 合,就得到2个分子轨道。又例如,苯分子中6个碳原 子各贡献1个与分子平面垂直的p轨道组合,就得到6个 分子轨道。如此等等。这种组合叫做“线性组合”。 例如,2个原子轨道(f 1 、f2)线性组合得到2个分子 轨道(Y、Y‘)可简单表述为: Y=c 1f 1+c 2f2 Y' =c 1f1–c 2f 2 分子轨道理论 (2)若组合得到的分子轨道的能量比组合前的原子 轨道能量之和低,所得分子轨道叫做“成键轨道”;若 组合得到的分子轨道的能量比组合前的原子轨道能量 之和高,所得分子轨道叫做“反键轨道”;若组合得到 的分子轨道的能量跟组合前的原子轨道能量没有明显 差别,所得分子轨道就叫做“非键轨道”。 例如:氟化氢中能量最低的几个分子轨道可简单 地看作以如下方式组成:氢的1s轨道和氟的2p z轨道相 加和相减,相加得到成键轨道,相减得到反键轨道; 氟的其余原子轨道(包括内层1s)基本维持原来的能量, 为非键轨道;HF的分子轨道能级图(氟的内层1s轨道能 量太低,没有画出来),图中AO为原子轨道,MO为分 子轨道,虚线表示组合: HF分子轨道能级图 AO MO AO H HF F 非键 2s 非键 反键 成键 2px 2py 2pz 1s 成键 反键 非键 非键 AO MO AO H HF F 1s 2s 2px 2py 2pz HF分子轨道波函数图象 HF分子轨道能级图 成键 反键 非键 非键 AO MO AO H HF F 1s 2s 2px 2py 2pz AO MO AO H HF F 非键 2s 非键 反键 成键 2px 2py 2pz 1s HF分子轨道波函数图象 分子轨道理论 (3)能量相近的原子轨道才组合成分子轨道。这叫 能量相近原理。例如,上例中氢的1s轨道和氟的2p轨 道能量相近,才发生组合。 原子轨道组合成分子轨道力求原子轨道的波函数 图象最大限度地重叠,这叫最大重叠原理。如上例中 氟的2p z 轨道顺着分子中原子核的连线向氢的1s轨道“头 碰头”地靠拢而达到最大重叠。 原子轨道必须具有相同的对称性才能组合成分子 轨道,这叫做“对称匹配原理”。如上例HF分子中氢的 1s轨道跟氟的2p z 轨道是对称匹配的而跟氟的2p x 、2p y 是对称不匹配的。此问题到结构化学中再讨论。 AO MO AO H HF F 非键 2s 非键 反键 成键 2px 2py 2pz 1s HF分子轨道波函数图象 分子轨道理论 (4)电子在分子轨道中 填充跟在原子轨道里填充 一样,要符合能量最低原 理、泡利原理和洪特规则。 如上例HF分子共有10个 电子,不计氟的内层(1s的 2个电子)时,叫“价电 子”,共计8个,先后填入 图的分子轨道,共占据4 个分子轨道,最低未占有 轨道是图中能量最高的反 键轨道,读者可按上述三 原理(或规则)自己将电子 填入右图的各分子轨道。 HF分子轨道能级图 成键 反键 非键 非键 AO MO AO H HF F 1s 2s 2px 2py 2pz