正在加载图片...
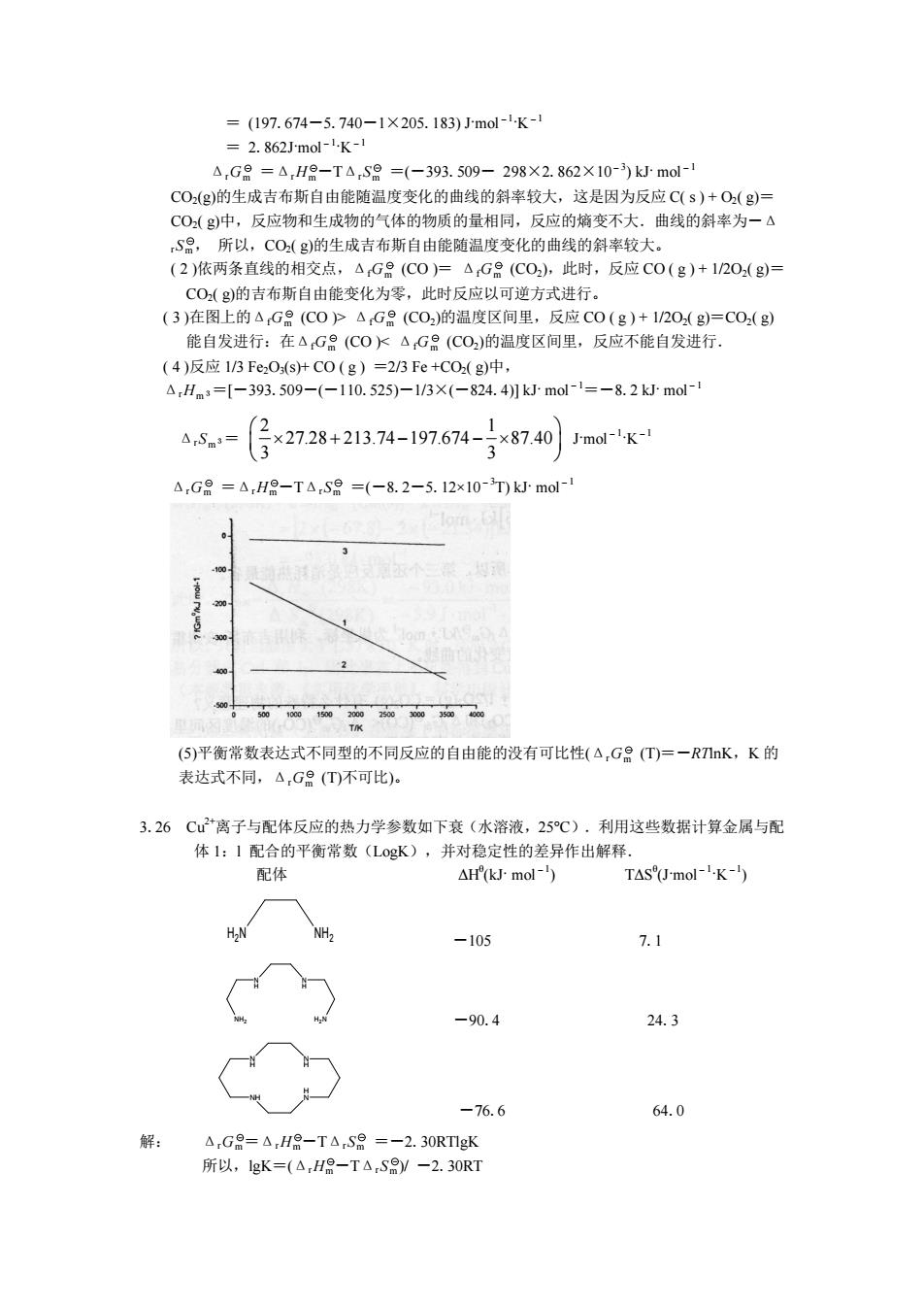
=(197.674-5.740-1×205.183)Jm0l-lK-1 =2.862Jmol-1-K-1 A.G=He-T△Se=(-393.5S09-298×2.862X10-3kJm0l- C0(g)的生成吉布斯自由能随温度变化的曲线的斜率较大,这是因为反应C(s)+0(g) CO(g)中,反应物和生成物的气体的物质的量相同,反应的熵变不大。曲线的斜率为一4 S品,所以,CO(g)的生成吉布斯自由能随温度变化的曲线的斜率较大。 (2)依两条直线的相交点,△,Ge(C0)=△G日(C0),此时,反应C0(g)+120(g)= CO。的吉布斯自由能变化为零。此时反应以可前方式讲行, (3)在图上的A。 △G(C0)的温度区间里,反应C0(g) +1门0.d =C0(g) 能自发进行:在△G会(C0△G会(C0)的温度区间里,反应不能自发进行 (4)反应1/3Fe0srC0(g))=2/3Fe+C0(g)中, △,Hms=[-393.509-(-110.525)-1/3×(-824.4月kJ-mol-1=-8.2kmol △rS= ×2728+21374-197614-写8740rK △,G8=△,H8-TA,8=(-8.2-5.12x10-T)kJ.mol (5)平衡常数表达式不同型的不同反应的自由能的没有可比性(△,G台(T)=一RIK,K的 表达式不同,△,G8(T)不可比). 3.26C2离子与配体反应的热力学参数如下衰(水溶液,25℃).利用这些数据计算金属与配 体1:1配合的平衡常数(L0gK),并对稳定性的差 异作出解释 配体 △H(kJ mol-) TASmol-1.K-1 H.N NH. -105 7.1 -90.4 24.3 -76.6 64.0 解: △,G8=△,H8-T△Sa=-2.30RgK 所以,lgK=(△,H8-T△S8y-2.30RT = (197.674-5.740-1×205.183) J·mol-1 ·K -1 = 2.862J·mol-1 ·K -1 ΔrGm =ΔrHm -TΔrSm =(-393.509- 298×2.862×10-3) kJ· mol-1 CO2(g)的生成吉布斯自由能随温度变化的曲线的斜率较大,这是因为反应 C( s ) + O2( g)= CO2( g)中,反应物和生成物的气体的物质的量相同,反应的熵变不大.曲线的斜率为-Δ rSm , 所以,CO2( g)的生成吉布斯自由能随温度变化的曲线的斜率较大。 ( 2 )依两条直线的相交点,ΔfGm (CO )= ΔfGm (CO2),此时,反应 CO ( g ) + 1/2O2( g)= CO2( g)的吉布斯自由能变化为零,此时反应以可逆方式进行。 ( 3 )在图上的ΔfGm (CO )> ΔfGm (CO2)的温度区间里,反应 CO ( g ) + 1/2O2( g)=CO2( g) 能自发进行:在ΔfGm (CO )< ΔfGm (CO2)的温度区间里,反应不能自发进行. ( 4 )反应 1/3 Fe2O3(s)+ CO ( g ) =2/3 Fe +CO2( g)中, ΔrHm 3=[-393.509-(-110.525)-1/3×(-824.4)] kJ· mol-1=-8.2 kJ· mol-1 ΔrSm 3= 2 1 27.28 213.74 197.674 87.40 3 3 Ê ˆ Á ¥ + - - ¥ ˜ Ë ¯ J·mol-1 ·K -1 ΔrGm =ΔrHm -TΔrSm =(-8.2-5.12×10-3T) kJ· mol-1 (5)平衡常数表达式不同型的不同反应的自由能的没有可比性(ΔrGm (T)=-RTlnK,K 的 表达式不同,ΔrGm (T)不可比)。 3.26 Cu 2+ 离子与配体反应的热力学参数如下衰(水溶液,25°C).利用这些数据计算金属与配 体 1:l 配合的平衡常数(LogK),并对稳定性的差异作出解释. 配体 ΔHθ (kJ· mol-1) TΔSθ (J·mol-1 ·K -1) H2 N NH2 -105 7.1 N H N H H NH 2 N 2 -90.4 24.3 N H N H NH H N -76.6 64.0 解: ΔrGm =ΔrHm -TΔrSm =-2.30RTlgK 所以,lgK=(ΔrHm -TΔrSm )/ -2.30RT