正在加载图片...
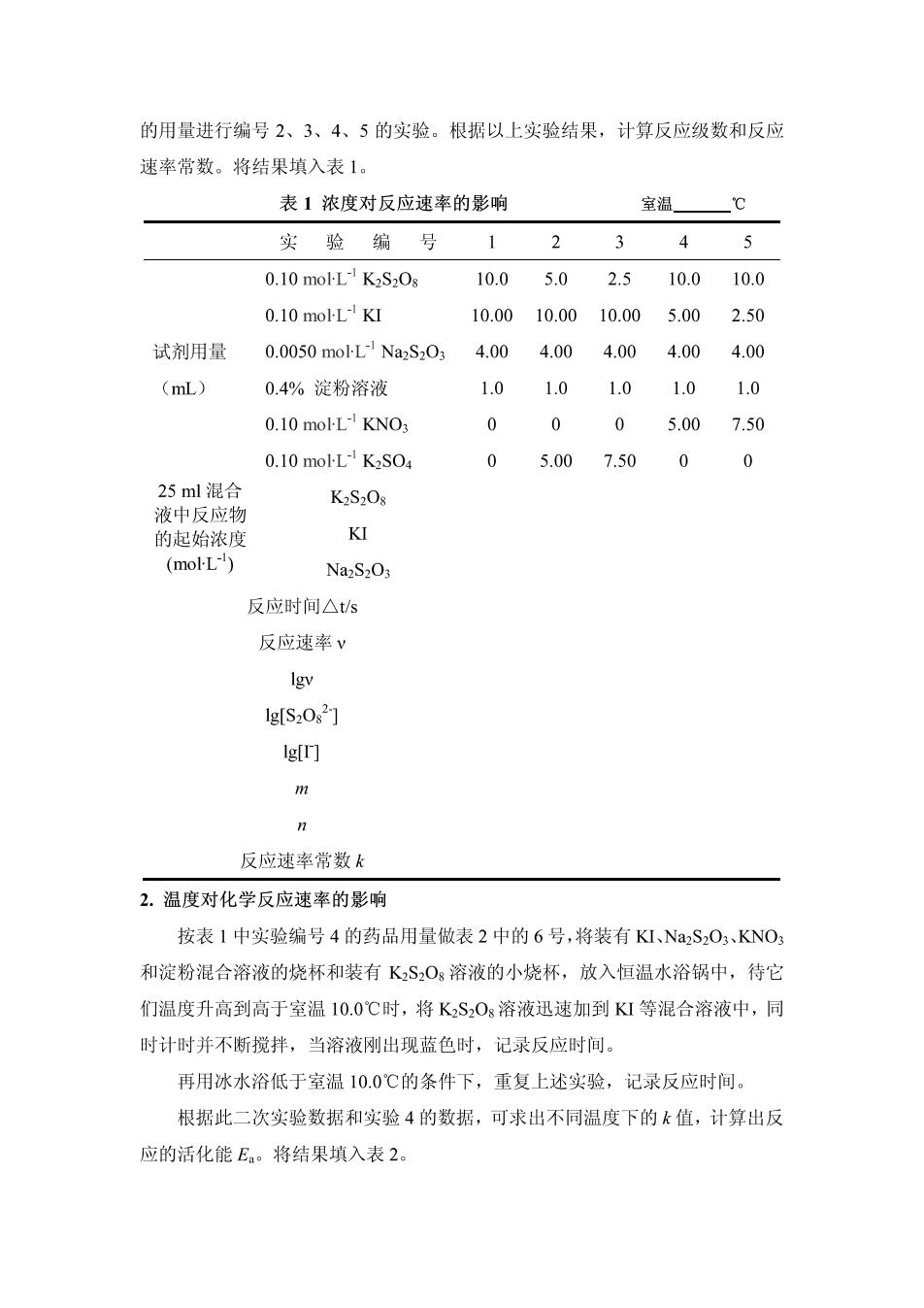
的用量进行编号2、3、4、5的实验。根据以上实验结果,计算反应级数和反应 速率常数。将结果填入表1。 表1浓度对反应速率的影响 室温℃ 实验编号12345 0.10 mol-L K2S2Os 10.05.02.510.010.0 0.10 mol-L-KI 10.0010.0010.005.002.50 试剂用量 0.0050moL1Na2S034.00 4.004.00 4.00 4.00 (mL) 0.4%淀粉溶液 1.01.01.01.0 1.0 0.10 mol-L-KNO3 0005.007.50 0.10 mol-L-K2SO4 0 5.007.50 0 25ml混合 K2S2Os 液中反应物 的起始浓度 KI (molL) Na2S203 反应时间△ts 反应速率v lgv 1g[S202] g叮 反应速率常数 2.温度对化学反应速率的影响 按表1中实验编号4的药品用量做表2中的6号,将装有KI、Na2S2O、KNO: 和淀粉混合溶液的烧杯和装有KS,O,溶液的小烧杯,放入恒温水浴锅中,待它 们温度升高到高于室温10.0℃时,将KSO3溶液迅速加到KI等混合溶液中,同 时计时并不断搅拌,当溶液刚出现蓝色时,记录反应时间。 再用冰水浴低于室温10.0℃的条件下,重复上述实验,记录反应时间。 根据此二次实验数据和实验4的数据,可求出不同温度下的k值,计算出反 应的活化能E。将结果填入表2