
实验9化学反应速率和活化能 一、实验目的 1.了解浓度、温度和催化剂对化学反应速率的影响。 2.测定过二硫酸钾与碘化钾反应的反应速率,并计算反应级数、反应速率常数 和反应的活化能,练习实验数据的处理方法。 二、实验原理 1.化学反应速率方程及反应级数 在水溶液中过二硫酸钾与碘化钾发生如下反应: KS208+3KI一2K2S04+KI S202+3→2S0,2+13 (10 其反应速率ⅴ根据速率方程可表示为: v=ke"(S.O )e"(I) 式中v是在此条件下反应的瞬时速率。若c(S02)、c()是起始浓度,则v 表示起始速率。k是速率常数,m与n之和是反应级数。 2.化学反应速率测定 实验能测定的速率是在一段时间(△)内反应的平均速率v。如果在△1时 间内S202浓度的改变为△c(S,02,则平均速率为: △ 近似地用平均速率代替起始速率。 v=c0,=es,0,产) △ 为了测出△1时间内S,02的浓度变化量,需要在混合KS,Os溶液和KI溶 液的同时,加入一定体积已知浓度的N2S2O3溶液和淀粉溶液,这样在反应(l) 进行的同时还进行下面的反应: 2S2032+I5S4062+3 (2) 这个反应进行得非常快,几乎瞬间完成,而反应()比反应(2)慢得多。因此, 由反应(1)生成的15立即与S202反应,生成无色的S4O。和「。所以在反应的开 始阶段看不到碘与淀粉反应而显示的特有蓝色。当体系中的NS,03一旦耗尽

反应(1)继续生成的就与淀粉反应而呈现出特有的蓝色。 由于从反应开始到蓝色出现标志着$O,全部耗尽,所以从反应开始到出现 蓝色这段时间△1里,S,0,2浓度的改变△c(S2O;2)实际上就是Na2S,O的起始浓 度。 从反应式(1)和(2)可以看出,S,082浓度减少量为S02浓度减少量的一半, 所以S202在△1时间内浓度减少量可以从下式求得。 △cS,0,2)=cS,0 2 对反应速率方程 v=kc"(S2O)c"(I-) 两边取对数,得lgv-lgk+mlgc(S0,2)+lg(D 同一温度下,固定c,改变c(S,02)求出一系列反应速率,以gv对 lg©(S202)作图,可得一直线,斜率即为m。同理,固定c(S,02,以gy对gc(门 作图得直线,斜率为n。将m、n和任意一次实验的一组反应物的初始浓度值代 入反应速率方程,就可求得反应速率常数k。 3.化学反应活化能 根同果是马指公式民,=20设(字 T-T 测不同温度下的k值,可求得活化能E 三、仪器与药品 仪器:量筒(10mL),吸量管(5mL,10mL),温度计(0~100℃),烧杯(100 mL,50mL),秒表,恒温水浴锅。 药品:KS0g(0.10moL),KI(0.10moL),NaS03(0.0050molL) (上述试剂的浓度均要准确,且需新配制的),KS04(0.10moL),0.4%淀粉 溶液,CuN0h(0.020moL-),KNO,(0.10moHL),冰。 四、实验步骤 1.浓度对化学反应速率的影响 在室温下进行表1中编号1的实验。用吸量管量取10.00mL0.10moLK1 溶液、4.00mL0.0050 mol-L-Na2S203溶液,用量筒量取1.0mL0.4%淀粉溶液置 于100mL烧杯中混匀。然后用量筒量取10.0mL0.10moLK2S20s溶液,迅速 倒入上述混合液中,同时启动秒表,并不断搅动,注意观察溶液的颜色变化。当 溶液刚出现蓝色时,立即按停秒表,记录反应时间和室温。用同样方法按照表1
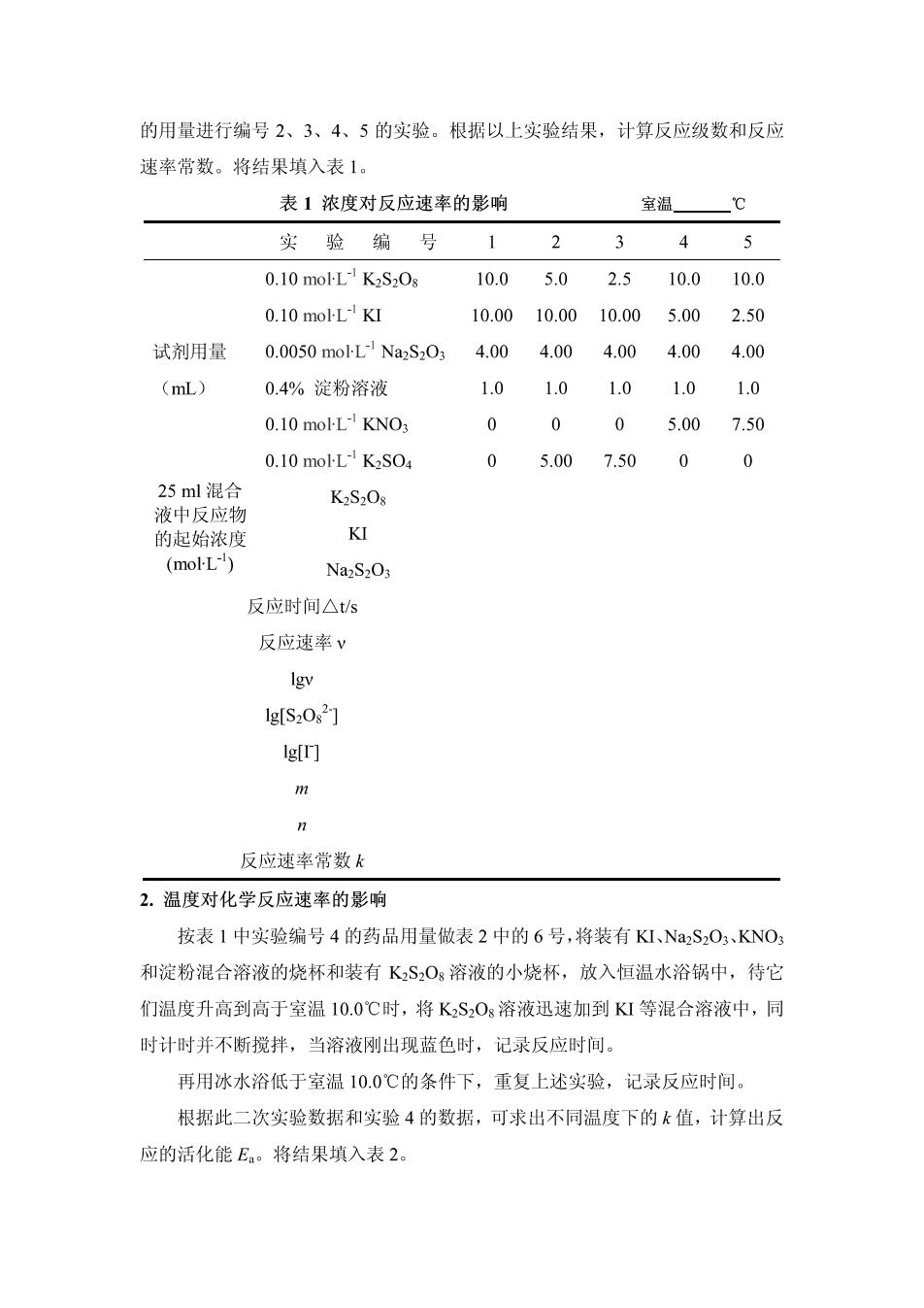
的用量进行编号2、3、4、5的实验。根据以上实验结果,计算反应级数和反应 速率常数。将结果填入表1。 表1浓度对反应速率的影响 室温℃ 实验编号12345 0.10 mol-L K2S2Os 10.05.02.510.010.0 0.10 mol-L-KI 10.0010.0010.005.002.50 试剂用量 0.0050moL1Na2S034.00 4.004.00 4.00 4.00 (mL) 0.4%淀粉溶液 1.01.01.01.0 1.0 0.10 mol-L-KNO3 0005.007.50 0.10 mol-L-K2SO4 0 5.007.50 0 25ml混合 K2S2Os 液中反应物 的起始浓度 KI (molL) Na2S203 反应时间△ts 反应速率v lgv 1g[S202] g叮 反应速率常数 2.温度对化学反应速率的影响 按表1中实验编号4的药品用量做表2中的6号,将装有KI、Na2S2O、KNO: 和淀粉混合溶液的烧杯和装有KS,O,溶液的小烧杯,放入恒温水浴锅中,待它 们温度升高到高于室温10.0℃时,将KSO3溶液迅速加到KI等混合溶液中,同 时计时并不断搅拌,当溶液刚出现蓝色时,记录反应时间。 再用冰水浴低于室温10.0℃的条件下,重复上述实验,记录反应时间。 根据此二次实验数据和实验4的数据,可求出不同温度下的k值,计算出反 应的活化能E。将结果填入表2

表2温度对化学反应速率的影响 实验编号 6 反应温度/℃ 反应时间△s 反应速率v 反应速率常数k Igk 1/T 活化能E。 注:本实验活化能测定值的误差不超过10%(文献值:51.8Jo)。 3.催化剂对化学反应速率的影响 按表1中实验编号4的用量,把KI、Na2S2O5、KNO3和淀粉溶液加到100m 烧杯中,再加入2滴0.020moL-CuNO2溶液,搅匀,然后迅速加入KS,O 溶液,搅动、计时。将此实验的反应速率与表1中实验4的反应速率进行比较, 可得出什么结论?将结果填入表3。 表3催化剂对化学反应速率的影响 实验编号 4 8 加入0.02 moILCu(NO)2的滴数 反应温度/℃ 反应时间△你 反应速率v 反应速率v 五、问题与讨论 1.下列操作情况对实验结果有何影响? (1)取用六种试剂的量筒没有分开专用。 (2)先加K2SO3溶液,最后加KI溶液。 (3)KSOs溶液缓慢加入KI等混合溶液中。 2.为什么根据反应溶液出现蓝色的时间长短来计算反应速率?反应溶液出现蓝 色时反应是否停止了?

3.本实验中NaS2O3的用量过多或过少,对实验结果有何影响? 注意事项: 1.量筒和吸量管贴好标签专用,试剂瓶盖不能张冠李戴。 2.加入K2S2O%溶液时要迅速,必须同时启动秒表。 3.加试剂时一定要看准试剂瓶和量器的标签要一致,各种试剂的量一定要准确, 尤其NaS2O3溶液的体积