
实验缓冲溶液的配制与性质 一、实验目的 1.学习配制缓冲溶液的一般方法 2.加深对缓冲溶液性质的理解。 3.了解缓冲容量与缓冲溶液总浓度和缓冲比的关系 二、实验原理 1.缓冲溶液的特点是:当加入少量的强酸、强碱或适当稀释时,其H 值不发生明显的改变。它一般由弱酸(A)和它的共轭碱(B)两大组 分混合而成。缓冲溶液的近似pH值可利用Henderson Hasselbalch方程计算: =+ (1 式中:为弱酸的解离常数,[A]、[B]分别为共轭酸碱浓度。 2若配制缓冲溶液所用的弱酸和它的共轭碱的原始浓度相同,则配制 时所取弱酸和它的共轭碱的体积(V)的比值等于它们平衡浓度的比值 ,所以上式可以写成: pH=pK+8号 由公式(2)可知,若改变两者的体积之比,可得到一系列咖值不同的 缓冲溶液。 需要指出的是,由上述两式算得的H值是近似的,精确的计算应 该用活度。实际应用的准确H值缓冲溶液的配制,是根据有关参考书 上的配方,其值是由精确的实验方法确定的(如美国国家标准局制 定的配方) 3缓冲容量是衡量缓冲溶液缓冲能力大小的尺度,它的大小与缓冲溶 液中缓神溶液的总浓度和缓中比有关。绥冲比不变时,总浓度战大, 缓冲容量越大;总浓度不变时,缓冲比越接近1:1,缓冲容量越大。 三、仪器与药品 仪器:酸度计吸量管(5L)量简(10mL)烧杯(50ml)大试管 容量瓶(50ml) 试剂:广泛pH试纸甲基红指示剂0.1mol·LHAc1mol·L HAc0.1mol·L NaAc1mol·L NaAc0.05mol·L NaHCO0 0.05mol·LNa.C00.1mo1·LHC1pH=4的HC1溶液0.1
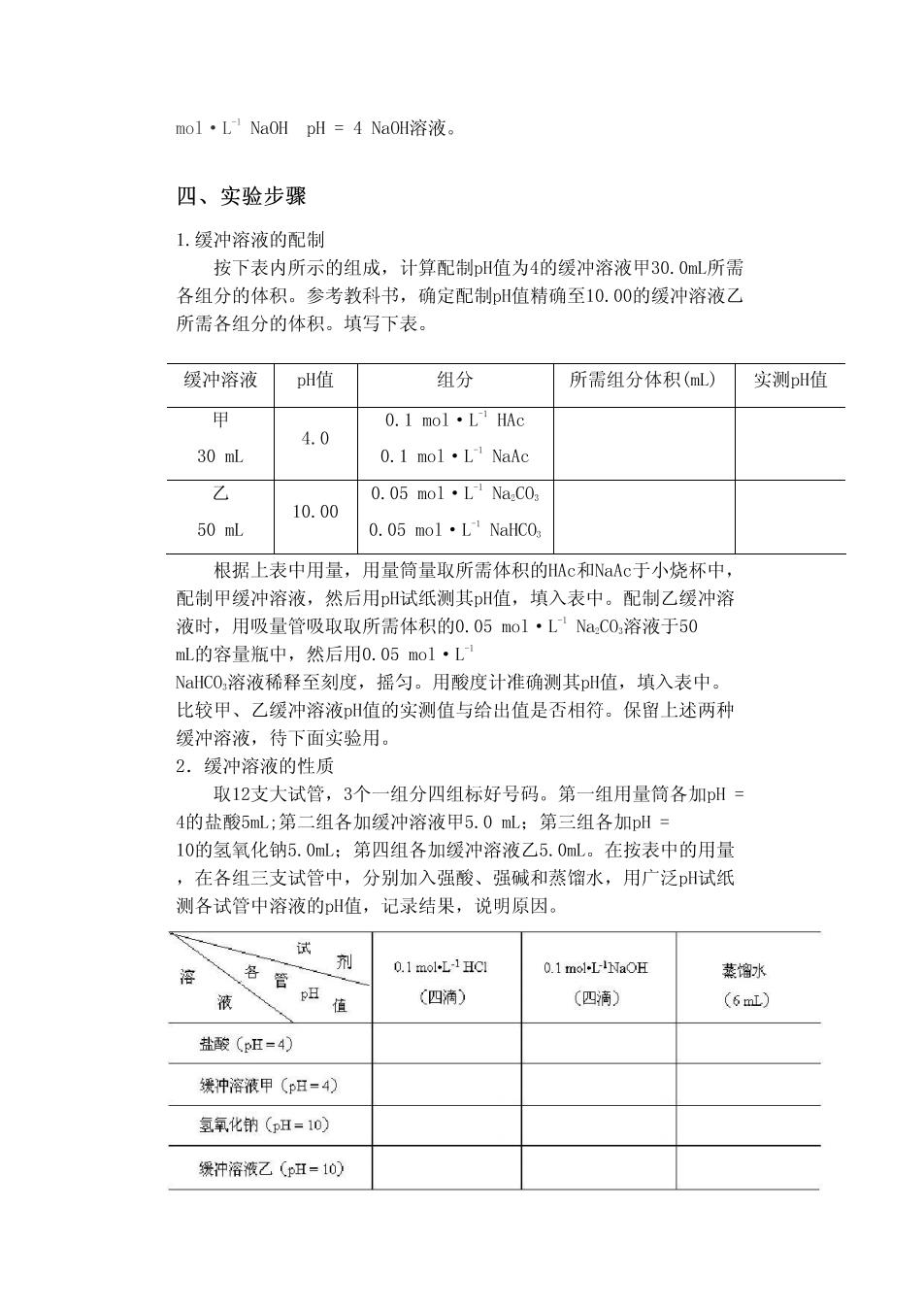
mol·L NaOH pH=4Na0H溶液 四、实验步骤 1.缓冲溶液的配制 按下表内所示的组成,计算配制H值为4的缓冲溶液甲30.0mL所需 各组分的体积。参考教科书,确定配制H值精确至10.00的缓冲溶液乙 所需各组分的体积。填写下表。 缓冲溶液pH值 组分分 所需组分体积(ml,)实测pH值 0.1mol·LHAc 4.0 30 mL 0.1mol·L'NaAc 乙 0.05mol·LNa.C0 10.00 50 mL 0.05mol·L'NaHC0 根据上表中用量,用量筒量取所需体积的Ac和NaAc于小烧杯中, 配制甲缓冲溶液,然后用pH试纸测其H值,填入表中。配制乙缓冲溶 液时,用吸量管吸取取所需体积的0.05mol·LNa,C0,溶液于50 mL的容量瓶中,然后用0.05mo1·L NaC0,溶液稀释至刻度,摇匀。用酸度计准确测其p值,填入表中。 比较甲、乙缓冲溶液H值的实测值与给出值是否相符。保留上述两种 缓冲溶液,待下面实验用。 2.缓冲溶液的性质 取12支大试管,3个一组分四组标好号码。第一组用量筒各加H 4的盐酸5mL:第二组各加缓冲溶液甲5.0mL:第三组各加pH= 10的氢氧化钠5.0mL:第四组各加缓冲溶液乙5.0ml。在按表中的用量 ,在各组三支试管中,分别加入强酸、强碱和蒸馏水,用广泛H试纸 测各试管中溶液的H值,记录结果,说明原因。 试 剂 0.1 mol-LHCI 0.1mi-l小aOF 馏水 液 (四滴) (四滴) (6ml) 盐酸(pH-4) 缓冲溶液甲(p日=4) 氢氧化的(p=10) 缓冲溶液乙(pH=10)
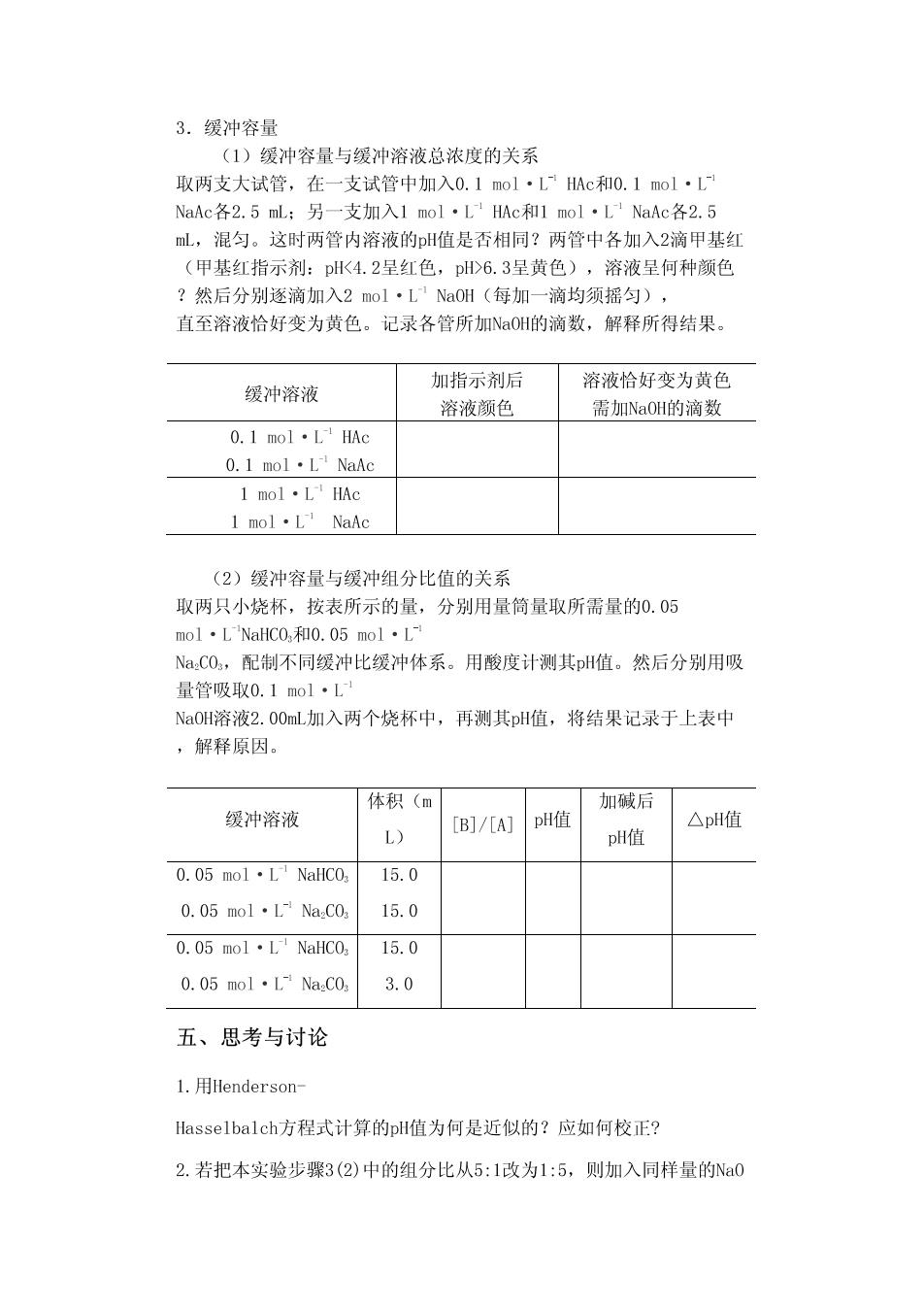
3.缓冲容量 (1)爱神容量与缓冲溶液总浓度的关系 取两支大试管,在一支试管中加入0.1mol·L HAc和0.1mol·L NaAc各2.5mL:另一支加入1mol·LHAc和1mol·L'NaAc各2.5 L,混匀。这时两管内溶液的值是否相同?两管中各加入2滴甲基红 (甲基红指示剂:pK4.2呈红色,p>6.3呈黄色),溶液呈何种颜色 ?然后分别逐滴加入2mol·L NaOH(每加一滴均须摇匀), 直至溶液恰好变为黄色。记录各管所加NaOH的滴数,解释所得结果。 加指示剂后 溶液恰好变为黄色 缓冲溶液 溶液颜色 需加NaOH的滴数 0.1mol·LHAc 0.1mol·L1NaAg 1mol·L'HAc 1mol·L NaAc (2)缓冲容量与缓冲组分比值的关系 取两只小烧杯,按表所示的量,分别用量筒量取所需量的0.05 mol·L'NaHC0和0.05mol·L Na,CO,配制不同缓冲比缓冲体系。用酸度计测其p值。然后分别用吸 量管吸取0.1mo1·L NaOH溶液2.00ml加入两个烧杯中,再测其pH值,将结果记录于上表中 ,解释原因。 体积(m 加概后 缓冲溶液 [B/A]H值 △pH值 L) pH值 0.05mol1·L NaHC0 15.0 0.05mol·LNaC0 15.0 0.05mo1·L'NaHCO0,15.0 0.05mol·LNa.C0. 3.0 五、思考与讨论 L.用Henderson- Hasselbalch方程式计算的pH值为何是近似的?应如何校正? 2.若把本实验步骤3(2)中的组分比从5:1改为1:5,则加入同样量的Na0

H后,△pH值是否相同?