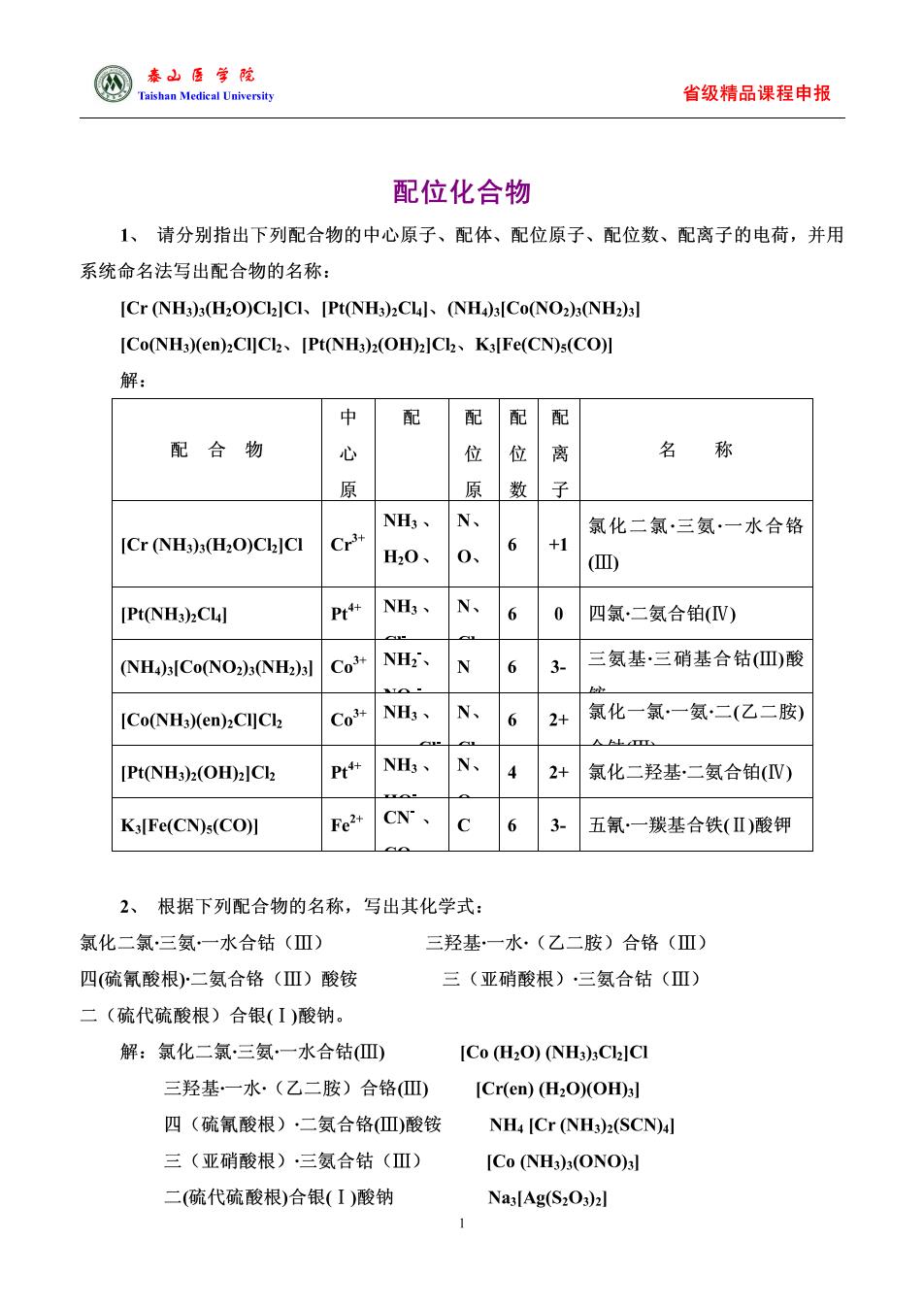
圆表山医学乾 省级精品课程申报 配位化合物 1、请分别指出下列配合物的中心原子、配体、配位原子、配位数、配离子的电荷,并用 系统命名法写出配合物的名称: ICr(NH3):(H2O)CllCI[Pt(NHa)2CLl.(NHA)lCo(NO2):(NH2)3l [Co(NH3)(en)2CI]Cl2 [Pt(NH3)2(OH)2]Cl K3[Fe(CN)s(CO)] 解 中 配 配配配 配合物 位 位离 名 称 原 原数子 NH,、N、 氯化二氯·三氨一水合铬 [Cr(NH3)3(H2O)Cl2]CI H0、0、 6 +1 [Pt(NH3)2CLl PNH、N、 6 0四氯二氨合铂(V) (NH)sICo(NO2)(NH2)l Co NH、N 6 三氨基·三硝基合钴山)酸 [Co(NH3)(en)2Cl]Clz Co+NH、N、 6 2+氯化一氯一氨二(乙二胺 △ [Pt(NH3)2(OH)2]Cl2 P NH、 N、 2+氯化二羟基二氨合铂(V) KFe(CN)s(CO川 Fe2+ CN、 6 3.五氰一羰基合铁(Ⅱ)酸钾 2、根据下列配合物的名称,写出其化学式: 氯化二氯三氨一水合钴(Ⅲ) 三羟基一水·(乙二胺)合铬(Ⅲ) 四(硫氰酸根)二氨合铬(Ⅲ)酸铵 三(亚硝酸根)三氨合钴(Ⅲ) 二(硫代硫酸根)合银(I)酸钠。 解:氯化二氯三氨一水合钴四 [Co (H2O)(NH3)3Cl2]CI 三羟基.一水.(乙二胺)合铬)ICr(em)(但,O)(OD] 四(硫氰酸根)·二氨合铬Ⅲ)酸铵 NH4 [Cr (NH3)2(SCN)4l 三(亚硝酸根)·三氨合钴(Ⅲ) [Co(NH3)(ONO)3] 二(硫代硫酸根)合银(I)酸钠 Nas[Ag(S2O3)2l

@本山年花 省级精品课程申报 3、配离子中,中心原子的配位数就是与它结合的配体个数,这一说法是否正确,为什么? 答:若配体为单齿配体,则中心原子的配位数等于配体数,而对于多齿配体,中心原子的 配位数不等于配体数。 4、用NH.SCN溶液检出含有Fe+的Co2*离子样品时,为什么加入NH,F? 答:由于SCN能与Fe+形成红色的配合物,从而干扰了Co2+的检测。若加入NHF,F 可与Fe+形成无色的FcF子,因而消除了Fe3的干扰。 5、试解释过渡金属元素的配离子为什么往往带有颜色? 答:这是由于过渡金属元素与配体形成配离子时,中心原子d轨道发生分裂,当d轨道未 充满电子时,即d电子数<10时,d电子吸收能量后,可从de跃迁至d,轨道发生d一d跃迁。 吸收光的能量等于分裂能,大多落在可见光范围内,因而配离子能显示出吸收光的互补色。 6、当衣服上沾有黄色铁锈斑点时,用1%草酸溶液即可将其清除,请解释之。 答:因为C02能与下e+形成稳定的、可溶于水的配合物,从而清除了衣服上沾有的黄色 铁锈班点。 7、试阐述金属离子在金属酶与底物特异结合过程中所发挥的作用。 答:金属离子通过形成配位键使底物与酶结合在一起,并改变底物的结构使其符合酶活性 中心的立体构型。 8、已知一些铂金属配合物具有抗癌活性,它们是顺-IPtCL(NH2、小顺-PtC,(NH)l(所 有反式异构体均无抗癌活性)。实验测得它们都是反磁性物质。试用价键理论解释它们是内轨 型还是外轨型配合物?各采用那种类型的杂化轨道? 答: 顺-PtCL4(NH:Pt的价层电子组态为5d,当它与配体形成配合物时,Pt用2个5d 轨道、1个6s轨道和3个6印轨道进行杂化,形成6个dsp3杂化轨道。由于Pt采用次外层d 轨道进行杂化,顺-PtCL4(NHs2为内轨型配合物。 顺-[PtCk(NH:Pr2+的价层电子组态为5d,当它与配体形成配合物时,P2+用1个5d 轨道、1个6s轨道和2个6p轨道进行杂化,形成4个dsp2杂化轨道。由于P+采用次外层d

@来山压学花 省级精品课程申报 轨道进行杂化,顺-PtC(NHs2为内轨型配合物 9、已知PdC4为平面四方形结构,ICd(CN为四面体结构,根据价键理论分析它们 中心原子杂化轨道类型,并指出配离子是顺磁性还是反磁性。 答:PdC2:Pd2+的价层电子组态为4d8,平面四方形对应的杂化类型为dsp杂化,8 个d电子全部排在4的4个轨道上,无未成对电子,为反磁性。 IC(CNa:Cd2+的价层电子组态为4d,四面体对应的杂化类型为sp杂化;无未成对 电子,为反磁性。 10、试用配合物的价键理论和晶体场理论分别解释为什么在空气中低自旋的IC0(CN)·易 被氧化为Co(CN6子。 答:由价键理论可知,低自旋的ICo(CN为八面体、内轨型配合物,其中心原子d轨道 有7个电子,要进行dsp3杂化,必须使1个3d轨道上的单电子跃迁到5s轨道上,而5s轨道 离核较远、能量较高,故这个5s电子极易失去,即[Co(CN)6十易被氧化为ICo(CN)6广。 由晶体场理论可知:CN为强场配体,△。>P,d电子尽量排在能量较低的d:轨道上,电 子组态为da,有一个电子处在能量较高的d,轨道,易失去,从而Co(CN)%十易被氧化为 ICo(CN6。 11、已知Mn(H2O)%+比C(HzO)2+吸收可见光的波长要短些,指出哪个的分裂能大些 答:Mn(H,O6和ICr(H,O)62*配离子的颜色是因为中心原子Mn2+和C2+中排在低能级 的d上电子,选择吸收了混合光中某一波长的光子,跃迁到高能级的d山,上引起的。选择吸收 的光子能量等于八面体场的分裂能△。·即4=加=身c 波长越短,△。越大。M(,O)%+比ICr(H,O)2+吸收可见光的波长短些,说明 IMn(H,O)6*的分裂能大于ICr(H,O)62+。 12、若体内发生铜中毒,为何常常采用NaCY]而不是采用EDTA除去过量的铜? 答:若利用EDTA去除体内的铜时,由于过量的EDTA缺乏选择性,在排毒的同时,也 会整合其它生命必需元素如钙,故钙也随之排出体外,导致体内血钙水平降低。为此采用 NazICaY,既可顺利排铜而又保持血钙不受影响。 13、试运用配合物理论解释人体煤气中毒的原因。 3

@春多花 省级精品课程申报 答:在体内起者输送氧气作用的血红素是F+卟啉配合物,煤气中毒是C0与血红素的 下©2*生成更稳定的配合物,占据了O2与血红素的F©2*结合的位置,从而使血红蛋白失去了输送 氧气的功能,造成人缺氧而死亡。 14、判断下列说法的对错,并简单说明原因 ①配合物的中心原子一般都是金属元素: ②配离子的电荷数等于中心原子的电荷数: ③配位体的场强越强,中心原子在该配体的八面体场作用下,分裂能越大: ④同一中心原子的低自旋配合物比高自旋配合物稳定。 答:①对,因为金属原子或离子具有空的价层轨道。 ②错,配离子的电荷等于中心原子的电荷与配体电荷的代数和。 ③对,因为配位体的场强越强,造成配体与中心原子轨道静电作用越大,分裂能越大。 ④对,因为低自旋配合物获得的稳定化能较大。 15,Which option about the chelate following is true? A the more members in its chelating ring,the more stable the chelate is B the more chelating rings in a chelate,the more stable the chelate is. C the chelating agent must be a bidentate ligand. D because CNS contains two ligating atoms,so it can be chelating agent 答:选B。含有两个以上配原子,且与中心原子形成五员环或六员环的配体,称为整合剂。 整合环的数目越多,稳定性越大,故选择答案B。 16.INi(CN)is a diamagnetic coordination ion,so the type of hybridization of its central atom Niz+is A sp B sp2 C sp D dsp2 答:选D。N的价层电子组态为3,若为反磁性,则无单电子,且配位数是4,故采用 dsp2杂化。 17 In the following coordination compounds,choose the one that absorbs light a shorter wavelength

@秦山压学花 省级精品课程申报 A [Fe(CN)6 B IFe(H2O)62 C [Fe(NH3)612 D IFeF6l 答:选A。因为配离子吸收光的能量与4匹配,吸收波长越短,说明该离子发生d-d跃迁 所需的能量大,即分裂能越大。在上述配体中C、场强最大,能产生较大的分裂能,故选择A。 18 The coordination number of [Co(en)(H2O)2(SCN)2]Cl is A3 答:选D。配位数为直接与中心原子键合的配原子数,即配位键数目。上述配体中,c 为双齿配体,H2O、SCN为单齿配体,所以配位数是6。 19.Which one is outer-orbital coordination compound in the following compounds A [Zn(CN)42 B [Ni(CN)2 C [Co(CN)6 D [Fe(CN)6 答:选A。上述中心原子中,只有Z2+的价层电子组态为3d,轨道为全充满,所以无论 何种配体,所形成的配合物均为外轨型配合物。 20、10mL0.1 moHLCuS(04溶液与10mL0.6moL1氨水混合达平衡后,计算溶液中的 Cu2、NH和ICu(NH42+的浓度各是多少?若向此溶液加入2.0x10mol的固体NaOH,问是 否有Cu(OD2沉淀生成?已知Cu(OD2的Kp=5.0x1020,NH3的K=1.8×105,[Cu(NHs 的K,=2.09×105。 解:Cu2++4NH一【CuNH)42+ 分析:()两溶液等体积混和,浓度减半;(2)溶液中Cu2+几乎全部生成了配离子。设溶 液中平衡时,游离Cu2为xmoL1,由配位平衡决定。 [Cu(NH3)42]=(0.05-x)mol-L=0.05 molL [NH3]-0.3 mol-L--4x(0.05-x)mol-L0.1 mol-L- a-g2-oo2wa 0.05 [oHr1=20x10=0.01mo1-L 0.02 1Cu2I0Hr2=2.39x10×(0.01)2=2.39×10l5>KpCu(0H2l ∴.有Cu(O2沉淀产生。 5

@本山季花 Ie Univers 省级精品课程申报 21、通过计算说明,当溶液中Ag(CN2=ICN=0.10moL时,加入固体KI(不考虑体 积增加)使r=0.10moL,能否产生AgI沉淀,已知Ag(CNl的K,=1.26×1021,Ag的 Kp=8.51x10r7。 解:Ag+2CN=IAg(CNnl g10m 0.1 [Ag*1r]=7.93x10-21×0.1=7.93x102Kp(AgC ·有AgC沉淀产生。 K_1.77×10-10 =1.77×10-(mol.L) 6

网来山玉学花 iversit 省级精品课程申报 0.0500 NH,]-i2x10177×10=502molL NH3浓度至少为:2×0.05moL+5.02moL=5.12molL 23、在298.15K时,NiNH62溶液中,INi(NH)62+)为0.10molL,cNH)为1.0moL-1, 加入乙二胺(en)后,使开始时c(en)为2.3moL',计算平衡时,溶液中NiNH)、NH、 INi(en)32+和en的浓度。已知Ni(en32+的K为2.0x1018,NiNH)62的K,为5.0x10。 解:NiNH)6"+3en一Ni(en)32++6NH 因为K,{Ni(m))之K,(NiNH),上述平衡正向移动,NiNH)+几乎完全 转化为Ni(en2,平衡时 [Ni(en)32]-0.10 mol-L [enJ2.3-3x0.1=2.0 mol-L NH≈1+6×0.10=1.60moL1 K=Ni()INH-【Nem'INH,N [Ni(NH ,)][en]' [Ni(NH ,)n [Ni"] K,INi(en)] 2.0×10 K,NNH,P50x10=4.0×10 [Ni(NH,)-INi)NH,0.10x(16) K·[em]' 4x10x20=524x10'ml.L 24、某反应Cu2++Sn2+一Cu+Sn,若Sn2=Sn=ICu2竹=0.1mosL,当加入 NH3的浓度为10.4moL1时,求反应方向。p(Sn艹/Sm2=0.15V、p(Cu2*1Cu)=0.34V [Cu(NH:42+的K,=2.1x103。 mm-mm02-s,2g器-a5m 可以认为游离的Cu2全部生成了ICu(NHs)4,则 ICu(NH2=0.1moL,H=10.4-4x0.1=10(moL (CwC)CC)010 0.1 2 K.[NH,] 2 =-0.20(y 7

@表华花 省级精品课程申报 因此S艹为氧化剂,Cu为还原剂,反应逆向进行 25、通过计算说明,为什么在水溶液中,Co离子能氧化水,C(H)%*却不能氧化水。 已知p9(Co+7C02=1.92V,p(02/H20=1.229V,ICo(NH%的K,1=1.58×105,【CoN)6 的K2=1.28×105。 解::p(C03+1C025>p(02H,0),故Co3+能氧化水。 Co+6NH3=[Co(NH3)61* As Co2++6NH:[Co(NH3)l2 K p°{(ICo(NH)P门1CoNw2)=p(CoCo2+00592IgCo 「Co241 192+005921g-i192+00o281.58x105014V 由于p9{ICo(NHs6)CoNH)62*)<p(O/H,O,故ICo(NH:)+不能氧化水。 26、根据实测磁矩,推断下列螯合物的空间构型,并指出是内轨还是外轨配合物。 (1)2Co(en2+的e3.824g: (2)l26Fe(C20的=5.754g: (3)I2mCo(en)2Cl2lC1的4=0.00s。 解:(1)对于第4周期过渡元素离子的3电子数可按下式计算 3d电子数=原子序数-18-离子电荷数 27C02的3d电子数=27-18-2=7, 将它们在5个等价的3d轨道上排布,可得出单电子数1=3: 根据磁矩和单电子数的关系公式4=√n+24a,当=3.82时,配离子的单电子数2=3 =?,说明电子未发生重排,它只能是以外层轨道杂化成键,形成外轨型配合物;因为配位 数为6,所以杂化类型为sp,空间构型为八面体。 (2)6Fe的3d电子数=26-18-3=5, 将它们在5个等价的3轨道上排布,可得出单电子数m1=5:

國奉山年学花 省级精品课程申报 =5.7g,m=5,m1=2,说明电子未发生重排,它只能是以外层轨道杂化成键,形 成外轨型配合物:因为配位数为6,所以杂化类型为sp,空间构型为八面体 (3)27Co的3d电子数=27-18-3=6, 将它们在5个等价的3轨道上排布,可得出单电子数m1=4, =0.00,历=0,m>2,说明电子发生重排,空出2个内层3d轨道杂化成键,形成 内轨型配合物;因为配位数为6,所以杂化类型为s即3,空间构型为八面体。 27、已知2zCo(CN6的电子成对能P=17800cm',4,=18000cm',请判断该配离子属 高自旋还是低自旋,并计算它的晶体场稳定化能/kJmo'。(1cm=11.96Jmo) 解:因为4,>P,电子优先排布在低能级的d上,形成低自旋配合物。 27C0+的3d电子数=27-18-3=6,在未分裂的3d轨道上排布时,成对电子数m1=1, 在晶体场中电子组态为dd,°,成对电子数2=3,根据CFSE计算公式有 CFSE=6×(-0.44。)+0×(0.64)+(3-1)P =-2.44。+2P=-2.4×18000×11.96+2×17800×11.96 =-90.90(kJ小mo