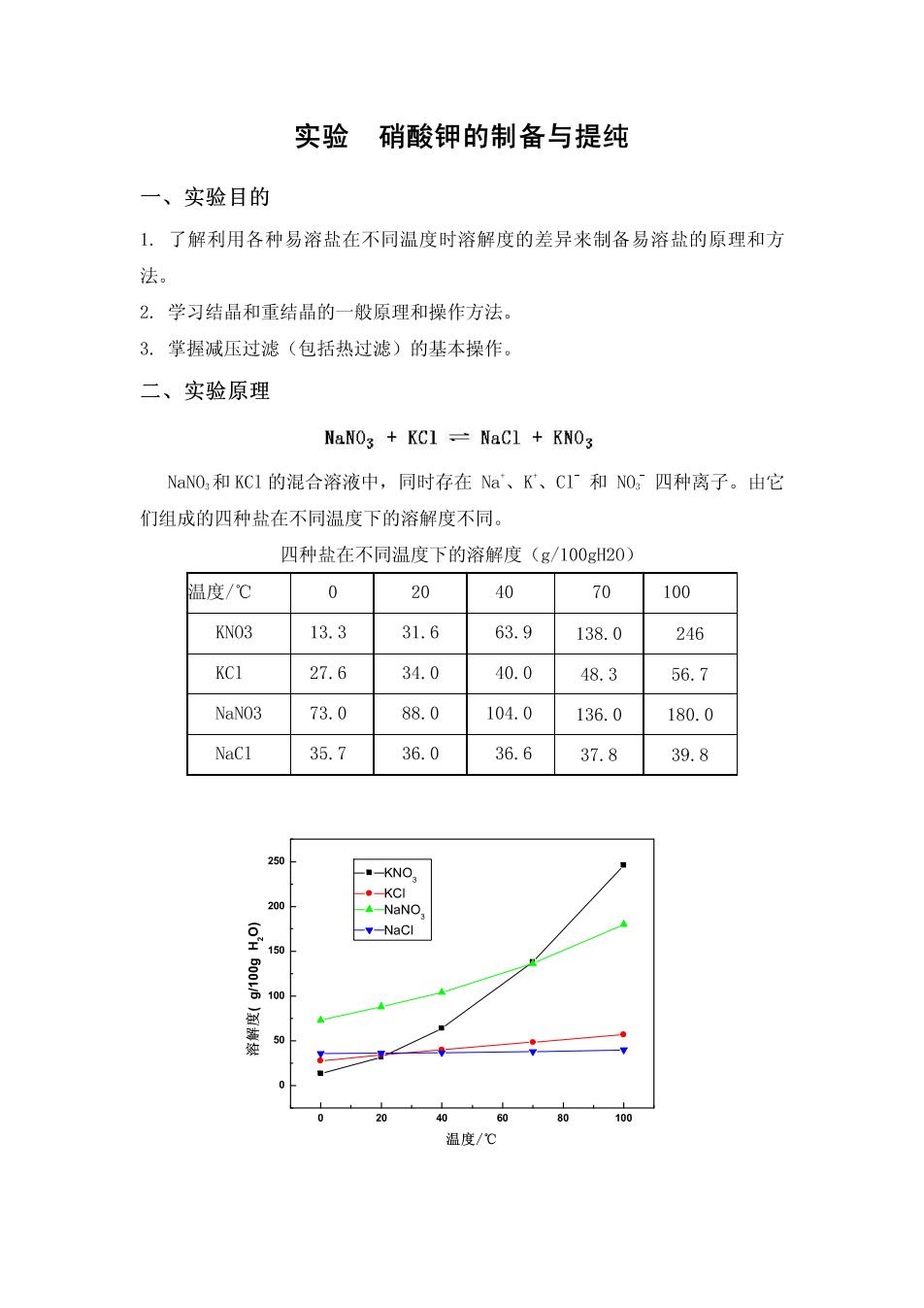
实验硝酸钾的制备与提纯 一、实验目的 1.了解利用各种易溶盐在不同温度时溶解度的差异来制备易溶盐的原理和方 法。 2.学习结晶和重结晶的一般原理和操作方法, 3.掌握减压过滤(包括热过滤)的基本操作。 二、实验原理 NaNOs KC1 NaCl KNO3 NaNO,和KC的混合溶液中,同时存在Na、K、CI和NO,四种离子。由它 们组成的四种盐在不同温度下的溶解度不同。 四种盐在不同温度下的溶解度(g/100g20) 温度/℃ 0 20 40 70 100 KN03 13.3 31.6 63.9138.0 246 27.6 34.0 40.0 48.3 56.7 NaNO3 73.0 88.0 104.0 136.0 180.0 NaCl 35.736.036.637.8 39.8 250 -KNO: --NaNO 100 0 60 温度/℃

图2-1四种盐的温度溶解度曲线 在20℃时,除硝酸钠以外,其它三种盐的溶解度都差不多,因此不能使硝 酸钾晶体析出。但是随者温度的升高,氯化钠的溶解度几乎没有多大改变,而 硝酸钾的溶解度却增大得很快。因此只要把硝酸钠和氯化钾的混合溶液加热 在高温时氯化钠的溶解度小,趁热把它滤去,然后冷却滤液,则因硝酸钾的溶 解度急剧下降而析出。 在初次结晶中一般混有一些可溶性杂质,为了进一步除去这些杂质,可采用 重结晶方法进行提纯。 三、实验仪器与试剂 仪器:水循环真空泵、热滤漏斗、烧杯(50,100mL各1个、量筒(150mL),抽 滤瓶、布氏漏斗,试管6支,酒精灯,试管架,漏斗架。 试剂:NaNO(s,AR),KC1(s,AR),饱和KNO溶液,0.1mol·L AgNO, 溶液 材料:火柴,称量纸,定性滤纸,石棉网,玻璃棒,玻璃铅笔。 四、实验步骤 1.硝酸钾的制备 在50ml烧杯中加入8.5gNaN0,和7.5gKC1,再加入15ml蒸馏水,在烧杯外 壁沿液面处作一记号。将烧杯放在石棉网上,用小火加热、搅拌,使其溶解,再 继续加热蒸发至原体积的23,这时烧杯内开始有较多晶体析出(什么晶体?)。 趁热减压过滤,滤液中很快出现晶体(这又是什么晶体?)。 另取8l热沸的蒸馏水加入吸滤瓶中,使结晶重新溶解,并将溶液转移至烧 杯中缓缓加热,蒸发至原有体积的3/4,静置、冷却(可用冷水浴冷却),待结 晶重新析出,再进行减压过滤。用饱和KO,溶液滴洗两遍,将晶体抽干、称量、 计算实际产率。 2.硝酸钾的提纯 按重量比为KO,:H.0=2:1的比例,将粗产品溶于所需蒸馏水中,加热并搅 拌,使溶液刚刚沸腾即停止加热(此时,若晶体尚未溶解完,可加适量蒸馏水使 其刚好溶解完)。冷却到室温后,抽滤并用饱和KN0,溶液46mL,用滴管逐滴加

于晶体的各部位洗涤、 抽干、称量,计算产率。 3.产品纯度的检验 取少许粗产品和重结晶后所得KNO,晶体分别置于两支试管,用蒸馏水配成 溶液,然后各滴2滴0.1mol·L'AgN0,溶液,观察现象,并作出结论。 五、实验思考 1.产品的主要杂质是什么? 2.能否将除去氯化钠后的滤液直接冷却制取硝酸钾? 3.考虑在母液中留有硝酸钾,粗略计算本实验实际得到的最高产量。 六、注意事项: 附L,减压过滤(称抽滤或“吸滤”) 由布氏漏斗,通过橡皮塞装在吸滤瓶的口上,吸滤瓶的支管与水泵的橡皮 管相接,被滤物转入铺有滤纸的布氏漏斗中。由于水泵中急速水流不断将空气 带走,使吸滤瓶内造成负压,促使液体较快通过滤纸进入瓶底,沉淀留在布氏 漏斗中。 训练减压过滤法,需掌握五个要点: ()抽滤用的滤纸应比布氏漏斗的内径略小一些,但又能把瓷孔全部盖没: (②)布氏漏斗端的斜口应该面对(不是背对)吸滤瓶的支管: (③)将滤纸放入漏斗并用蒸馏水润湿后,慢慢打开水泵,先抽气使滤纸贴紧,然 后才能往漏斗内转移溶液: (④在停止过滤时,应先拔去连接吸滤瓶的橡皮管,后关掉连接水泵的自来水开 关: (⑤)为使沉淀抽得更干,可用塞子或小烧杯底部紧压漏斗内的沉淀物 附2.热过滤 如果溶液中的溶质在温度下降时容易析出大量结晶,而我们又不希望它在过 滤过程中留在滤纸上,这时就要趁热进行过滤。热过滤有普通热过滤和减压热过 滤两种。普通热过滤是将普通漏斗放在铜质的热漏斗内,铜质热漏斗内装有热水

以维持必要的温度。减压热过滤是先将滤纸放在布氏漏斗内并润湿之,再将它放 在水浴上以热水或蒸气加热,然后快速完成过滤操作