
补充习题一答案 (1)1有机化合物就是碳化合物。典型有机化合物的一般特性是:容易燃烧:熔点低,多 数圈体有机物的熔点在室温 400©℃之间:有机化合物通常难溶于水,易溶于有机溶剂: 有机化合物的反应速率比较慢,并月常有副反应发生,因而收率低。 2.电子云分布对键轴呈圆杜形对称的轨道称σ轨道,山它生成的间称。键。电子云分布有 个索度为零的通过键轴的平面(称为节面)作为对称面试的轨道,称为π轨道,山它生成的 键称为π能。 F 3.(1)HF (2)F> 4.分解1摩尔乙辞所需要的热能为: △H=(5×413.8c-+346.9ce+359.5c.0+464.0oH=3239.4KJ·mor 生成所放出的热能为 △H-(4×413.8c-H-610.3cc+(2×464.0o-H=3193.5KJmo 总的反应热变化是AH-3230.43193.5=459K,m0 所以是吸热反应 5.(1)H-F>H-O>H_N>H-C (2)C-F>C-O-C-CI-C-N
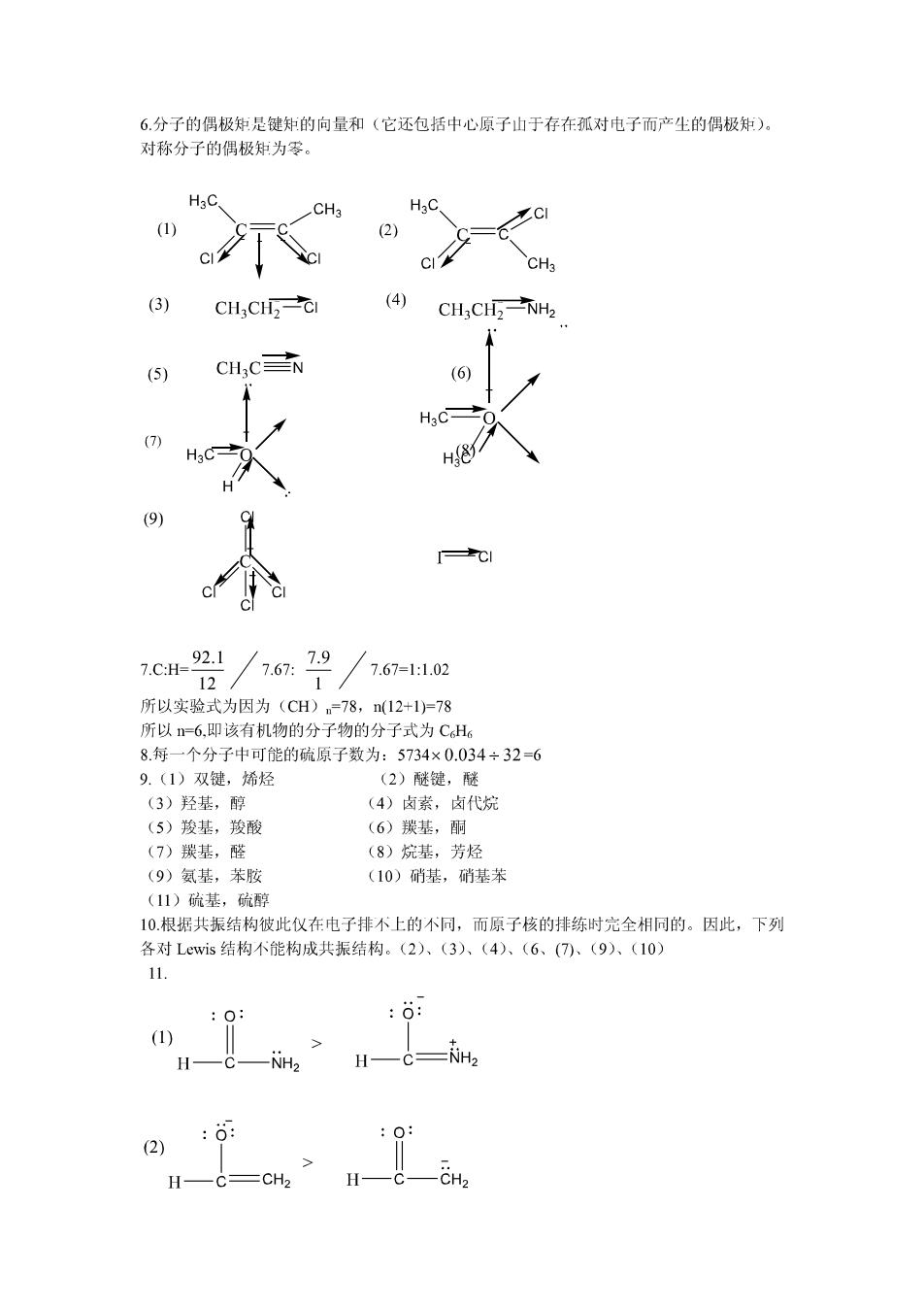
6.分子的偶极矩是键郑的向量和(它还包括中心原子山于存在孤对电子而产生的偶极知), 对称分子的偶极知为零。 H3 CH. (3) CHCH-0 ④CH,CNH, CH,C入 (7) 7c2/7679/76= 所以实验式为因为(CH)78,12+1)78 所以=6,即该有机物的分子物的分子式为CH6 8.每一个分子中可能的硫原子数为:5734×0.034÷32=6 9.(1)双键,烯烃 (2)醚键,醚 (3)轻其.醇 (4)卤素,卤代烷 (5)羧基,羧酸 (6)羰基,酮 (7)羰基,醛 (8)烷基,芳烃 (9)氨基,苯胺 (10)硝基,硝基苯 (11)硫基,硫醇 10.根据共振结构彼此仪在电子排不上的不同,而原子核的排练时完全相同的。因此,下列 各对Lewis结构不能构成共振结构。(2)、(3)、 (6、(7).(9)、(10) :0 :6: (1)

:δ: :0: > (3) > H,C=CH- -C- -H HC. -CH HC -CH (4) OH :OH H —C—OH H-C-OH 12.(B).(C)中氯原子的吸电子诱导效应和供电子共轭效应方向相反,极性小于(A).(D) 为对称分子,他们的偶极知有大到小的顺序为:(A)>(B)>(C)>(D) 13().因为氯原子比氟大,所以C一C键比C一F史长,因此,在CH,一C1中分开电荷 的距离比CH,一F史大,因为CH,CL较大的值大于补偿较小的e值,因此它的偶极知 (c×d)史大。 (2)甲醛的共振结构式表示!下: H H 我们注意到:在第二个结构中电负性的氧上带有负电荷。山于(X)式的贡献使得C-O 键高度的极化,这说明了甲醛有非常大的偶极知。 对于CHF虽然氟的电负性比氧大,但是他没有这样的共振结构,因此它的偶极知较小。 14.用共振符号表示的组有:(1)、(3)、(5)和(6) 用平衡符号表示的组有:(2)和(4)