正在加载图片...
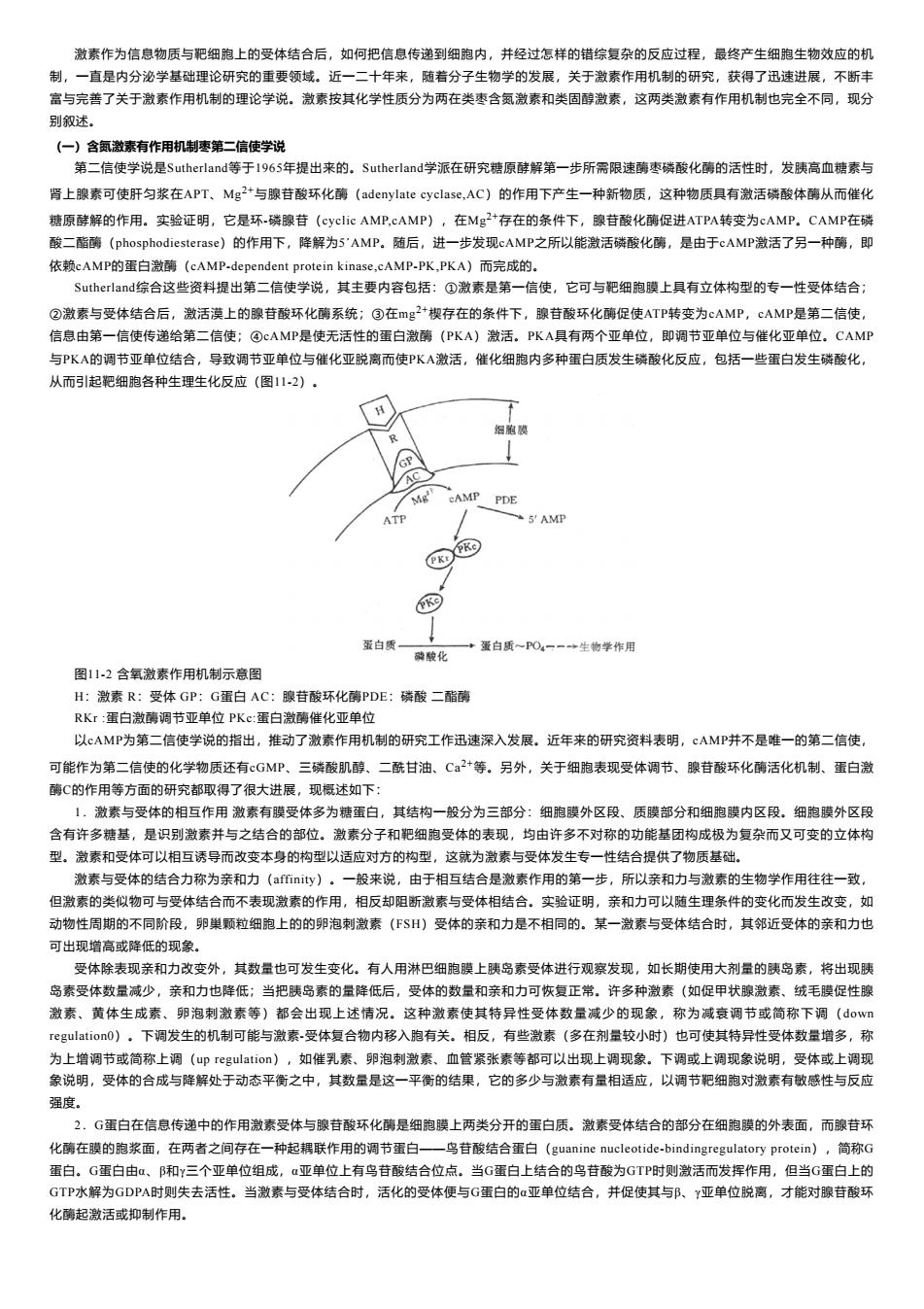
激素作为信息物质与无细孢上的受体结合后,如何把信息传递到细跑内,并经过怎样的错综复杂的反应过程,最终产生细胞生物效应的机 制 一直是内分泌学基础理论研究的重要领域。近一 十年来,随着分子生物学的发展,关于激素作用机制的研究,获得了迅速进展,不断丰 富与完善了关于激素作用机制的理论学说。激素按其化学性质分为两在类枣含氮激素和类固醇激素,这两类激素有作用机制也完全不同,现分 别叙述 (一)含氨数素有作用机制枣第二信使学说 第二信使学说是Sutherland等于1965年提出来的.Sutherland学派在研究糖原酵解第一步所需限速酶枣磷酸化酶的话性时,发胰高血糖素与 肾上腺素可使肝匀浆在APT,Mg2与豫苷酸环化酶(adcy1 ate cyclase,AC)的作用下产生一种新物质,这种物质具有激活磷酸体酶从而化 糖原酵解的作用。实验证明,它是环-磷腺苷((eyelic AMP,cAMP) ,在Mg2+存在的条件下,腺苷酸化裤促进ATPA转变 cAMP. CAMP在磷 酸二酯离(phosphodiesterase)的作用下。降解为5'AMP,随后,进一步发现cAMP之所以能激活磷酸化,是由于cAMP激活了另一种, 依赖cAMP的蛋白激病(cAMP-dependent protein kinase,cAMP.PK.PKA)而完成的. Sutherland综合这些资料提出第二信使学说,其主要内容包括:①激素是第一信使,它可与肥细胞膜上具有立体构型的专一性受体结合 ②激素与受体结合后,激活漠上的腺首酸环化酶系统:③在mg+楔存在的条件下,腺首酸环化酶促使ATP转变为cAMP,AMP是第二信使】 信息由第一信使传递给第二信使:④CAMP是使无活性的蛋白激醉(PKA)激活,PKA只有两个亚单位,即调节亚单位与催化亚单位.CAMP 与PKA的调节亚单位结合,导致调节亚单位与催化亚锐离而使PKA邀话,催化细跑内多种蛋白质发生磷酸化反应,包括一些蛋白发生磷酸化 从而引起粑细胞各种生理生化反应(图112), PPDE 蛋白质 酸化 +蛋白质一O4一一+生物学作用 图112含氧激素作用机制示意 腺苷酸 酶PDE:磷酸二酯 来子粉棉山动了发房作机制的研院工作品入发民证年珠定资到 ,cAMP并不是唯一的第二信使, 可能作为第二信使的化学物质还有cGMP、三磷酸肌醇、二酰甘油、C+等。另外,关于细胞表现受体调节、腺苷酸环化酶活化机制、蛋白激 酶C的作用等方面的研究都取得了很大进展,现概述如下: 【,救素与受体的相互作用激素有膜受体多为糖蛋白,其结构一般分为三部分:细胞膜外区段。质膜部分和细胞膜内区段。细胞膜外区段 含有许多糖基,是识别激素并与之结合的部位。激素分子和配细孢受体的表现,均由许多不对称的功能基团构成极为复杂而又可变的立体构 型。激素和受体可以相互诱导而改变本身的构型以适应对方的构型,这就为激索与受体发生专一性结合提供了物质基础。 激索与受体的结合力称为亲和力(a面iy),一般来说,由于相互结合是激索作用的第一步,所以亲和力与激素的生物学作用往往一致, 但激素的类似物可与受体结合而不表现激素的作用,相反却阻断激素与受体相结合。实验证明,亲和力可以随生理条件的变化而发生改变,如 动物性周期的不同阶段,卵巢颗粒细胞上的的卵泡刺微素(FSH)受体的亲和力是不相同的。某一激素与受体结合时,其邻近受体的亲和力也 可出现墙离或隆低的现金 受体除表现亲和力改变外,其数量也可发生变化。有人用淋巴细孢膜上胰岛素受体进行观察发现,如长期使用大剂量的胰岛素,将出现胰 岛素受体数量减少,亲和力也降低:当把胰岛素的量降低后,受体的数量和亲和力可恢复正常。许多种激素(如促甲状腺激素、绒毛膜促性腺 激素、黄体生成素、卵泡刺激索等)都会出现上述情况。这种激素使其特异性受体数量减少的现象,称为减袁调节或简称下调(0w 1心gua00)。下调发生的机制可能与激素受体复合物内移入胞有关。相反,有些激素(多在剂量较小时)也可使其特异性受体数量增多,称 为上增调节或简称上调(upga0n)),如住乳素、卵泡刺微素、血管紧张素等都可以出现上调现象。下调或上调现象说明,受体或上调现 象说明,受体的合成与降解处于动态平衡之中,其数量是这一平衡的结果,它的多少与激素有量相适应,以调节靶细胞对激素有敏感性与反应 湿南 】。G蛋白在信息传递中的作用激素受体与腺苷酸环化确是细跑膜上两类分开的蛋白质。微素受体结合的部分在细胞腰的外表面,而腺苷环 化确在障的胞浆面,在两者之间存在一种起押联作用的调节蛋白 一鸟苷酸结合蛋白(guanine pucleotide-bindingregulatory protein,简称 蛋白。G蛋白由a,B和v三个亚单 位组成,亚单位上有鸟苷酸结合位点。当G蛋白上结合的鸟苷酸为GTP时则激活而发挥作用,但当G蛋白上的 GTP水解为GDPA时则失去活性.当激素与受体结合时,活化的受体便与G蛋白的亚单位结合,并促使其与B、亚单位脱高,才能对豫苷酸环 化离起微活或抑制作用 激素作为信息物质与靶细胞上的受体结合后,如何把信息传递到细胞内,并经过怎样的错综复杂的反应过程,最终产生细胞生物效应的机 制,一直是内分泌学基础理论研究的重要领域。近一二十年来,随着分子生物学的发展,关于激素作用机制的研究,获得了迅速进展,不断丰 富与完善了关于激素作用机制的理论学说。激素按其化学性质分为两在类枣含氮激素和类固醇激素,这两类激素有作用机制也完全不同,现分 别叙述。 (一)含氮激素有作用机制枣第二信使学说 第二信使学说是Sutherland等于1965年提出来的。Sutherland学派在研究糖原酵解第一步所需限速酶枣磷酸化酶的活性时,发胰高血糖素与 肾上腺素可使肝匀浆在APT、Mg 2+与腺苷酸环化酶(adenylate cyclase,AC)的作用下产生一种新物质,这种物质具有激活磷酸体酶从而催化 糖原酵解的作用。实验证明,它是环-磷腺苷(cyclic AMP,cAMP),在Mg 2+存在的条件下,腺苷酸化酶促进ATPA转变为cAMP。CAMP在磷 酸二酯酶(phosphodiesterase)的作用下,降解为5ˊAMP。随后,进一步发现cAMP之所以能激活磷酸化酶,是由于cAMP激活了另一种酶,即 依赖cAMP的蛋白激酶(cAMP-dependent protein kinase,cAMP-PK,PKA)而完成的。 Sutherland综合这些资料提出第二信使学说,其主要内容包括:①激素是第一信使,它可与靶细胞膜上具有立体构型的专一性受体结合; ②激素与受体结合后,激活漠上的腺苷酸环化酶系统;③在mg 2+楔存在的条件下,腺苷酸环化酶促使ATP转变为cAMP,cAMP是第二信使, 信息由第一信使传递给第二信使;④cAMP是使无活性的蛋白激酶(PKA)激活。PKA具有两个亚单位,即调节亚单位与催化亚单位。CAMP 与PKA的调节亚单位结合,导致调节亚单位与催化亚脱离而使PKA激活,催化细胞内多种蛋白质发生磷酸化反应,包括一些蛋白发生磷酸化, 从而引起靶细胞各种生理生化反应(图11-2)。 图11-2 含氧激素作用机制示意图 H:激素 R:受体 GP:G蛋白 AC:腺苷酸环化酶PDE:磷酸 二酯酶 RKr :蛋白激酶调节亚单位 PKc:蛋白激酶催化亚单位 以cAMP为第二信使学说的指出,推动了激素作用机制的研究工作迅速深入发展。近年来的研究资料表明,cAMP并不是唯一的第二信使, 可能作为第二信使的化学物质还有cGMP、三磷酸肌醇、二酰甘油、Ca 2+等。另外,关于细胞表现受体调节、腺苷酸环化酶活化机制、蛋白激 酶C的作用等方面的研究都取得了很大进展,现概述如下: 1.激素与受体的相互作用 激素有膜受体多为糖蛋白,其结构一般分为三部分:细胞膜外区段、质膜部分和细胞膜内区段。细胞膜外区段 含有许多糖基,是识别激素并与之结合的部位。激素分子和靶细胞受体的表现,均由许多不对称的功能基团构成极为复杂而又可变的立体构 型。激素和受体可以相互诱导而改变本身的构型以适应对方的构型,这就为激素与受体发生专一性结合提供了物质基础。 激素与受体的结合力称为亲和力(affinity)。一般来说,由于相互结合是激素作用的第一步,所以亲和力与激素的生物学作用往往一致, 但激素的类似物可与受体结合而不表现激素的作用,相反却阻断激素与受体相结合。实验证明,亲和力可以随生理条件的变化而发生改变,如 动物性周期的不同阶段,卵巢颗粒细胞上的的卵泡刺激素(FSH)受体的亲和力是不相同的。某一激素与受体结合时,其邻近受体的亲和力也 可出现增高或降低的现象。 受体除表现亲和力改变外,其数量也可发生变化。有人用淋巴细胞膜上胰岛素受体进行观察发现,如长期使用大剂量的胰岛素,将出现胰 岛素受体数量减少,亲和力也降低;当把胰岛素的量降低后,受体的数量和亲和力可恢复正常。许多种激素(如促甲状腺激素、绒毛膜促性腺 激素、黄体生成素、卵泡刺激素等)都会出现上述情况。这种激素使其特异性受体数量减少的现象,称为减衰调节或简称下调(down regulation0)。下调发生的机制可能与激素-受体复合物内移入胞有关。相反,有些激素(多在剂量较小时)也可使其特异性受体数量增多,称 为上增调节或简称上调(up regulation),如催乳素、卵泡刺激素、血管紧张素等都可以出现上调现象。下调或上调现象说明,受体或上调现 象说明,受体的合成与降解处于动态平衡之中,其数量是这一平衡的结果,它的多少与激素有量相适应,以调节靶细胞对激素有敏感性与反应 强度。 2.G蛋白在信息传递中的作用激素受体与腺苷酸环化酶是细胞膜上两类分开的蛋白质。激素受体结合的部分在细胞膜的外表面,而腺苷环 化酶在膜的胞浆面,在两者之间存在一种起耦联作用的调节蛋白——鸟苷酸结合蛋白(guanine nucleotide-bindingregulatory protein),简称G 蛋白。G蛋白由α、β和γ三个亚单位组成,α亚单位上有鸟苷酸结合位点。当G蛋白上结合的鸟苷酸为GTP时则激活而发挥作用,但当G蛋白上的 GTP水解为GDPA时则失去活性。当激素与受体结合时,活化的受体便与G蛋白的α亚单位结合,并促使其与β、γ亚单位脱离,才能对腺苷酸环 化酶起激活或抑制作用