正在加载图片...
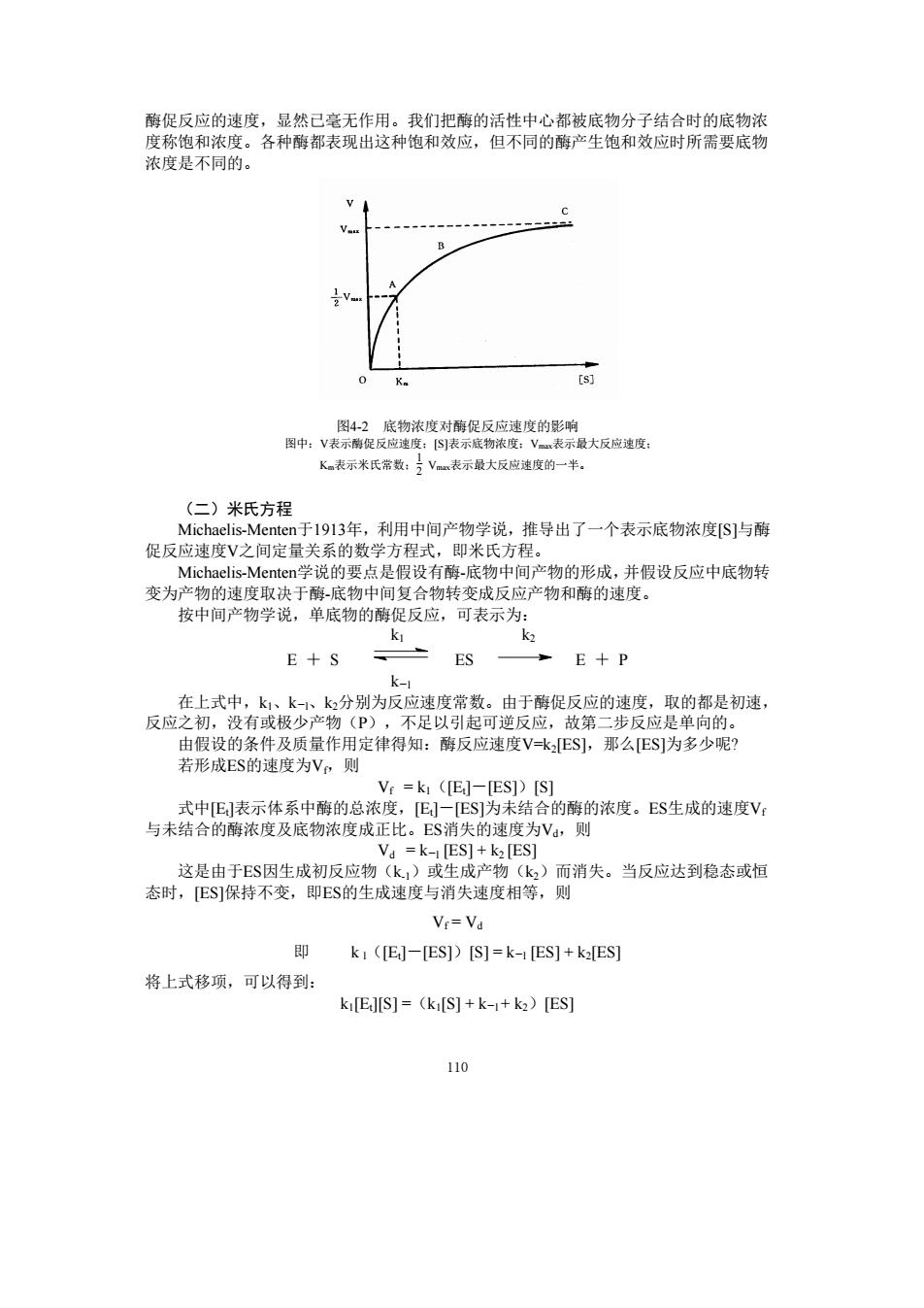
酶促反应的速度,显然已毫无作用。我们把酶的活性中心都被底物分子结合时的底物浓 和 。各种锋表现出这种饱和效应,但不同的鲜严生饱和效应时所需要底物 浓度是不同的。 K表示米氏常爱:方V表示最大反应逸度的一半。 (二)米氏方程 ,推导出了一个表示底物浓度S]与酶 即米 点是假 产物的形成,并假设反应中底物转 参为Mh决于酶底物中间复合物转变成反应产物和醇的速 按中间产物学说,单底物的酶促反应,可表示为 k k E+S ES E十P 在上式中,k1、k、k2分别为反应速度常数。由于酶促反应的速度,取的都是初速, 反应之初,没有或极少产物(P),不足以引起可逆反应,故第二步反应是单向的。 由假设的条件及质量作用定律得知:酵反应速度Vk:ES],那么ES]为多少呢? 若形成ES的速度为Vn则 Vr =k ([E]-[ES])[S] 一E]为 结合的酶的浓度。ES生成的速度V 度为Vd,则 这是由于ES因生成初反应物k 态时,ES]保持不变,即ES的生成速度与消失速度相等,则 ,)而消失。当反应达到稳态或恒 V=V 即 k1 ([E]-[ES])[S]=k-[ES]+k2[ES] 将上式移项,可以得到 ki[E][S]=(ki[S]+k+k2)[ES] 110 110 酶促反应的速度,显然已毫无作用。我们把酶的活性中心都被底物分子结合时的底物浓 度称饱和浓度。各种酶都表现出这种饱和效应,但不同的酶产生饱和效应时所需要底物 浓度是不同的。 图4-2 底物浓度对酶促反应速度的影响 图中:V表示酶促反应速度;[S]表示底物浓度;Vmax表示最大反应速度; Km表示米氏常数; 1 2 Vmax表示最大反应速度的一半。 (二)米氏方程 Michaelis-Menten于1913年,利用中间产物学说,推导出了一个表示底物浓度[S]与酶 促反应速度V之间定量关系的数学方程式,即米氏方程。 Michaelis-Menten学说的要点是假设有酶-底物中间产物的形成,并假设反应中底物转 变为产物的速度取决于酶-底物中间复合物转变成反应产物和酶的速度。 按中间产物学说,单底物的酶促反应,可表示为: k1 k2 E + S ES E + P k―l 在上式中,k1、k―l、k2分别为反应速度常数。由于酶促反应的速度,取的都是初速, 反应之初,没有或极少产物(P),不足以引起可逆反应,故第二步反应是单向的。 由假设的条件及质量作用定律得知:酶反应速度V=k2[ES],那么[ES]为多少呢? 若形成ES的速度为Vf,则 Vf = k1([Et]-[ES])[S] 式中[Et]表示体系中酶的总浓度,[Et]-[ES]为未结合的酶的浓度。ES生成的速度Vf 与未结合的酶浓度及底物浓度成正比。ES消失的速度为Vd,则 Vd = k―l [ES] + k2 [ES] 这是由于ES因生成初反应物(k-1)或生成产物(k2)而消失。当反应达到稳态或恒 态时,[ES]保持不变,即ES的生成速度与消失速度相等,则 Vf = Vd 即 k l([Et]-[ES])[S] = k―l [ES] + k2[ES] 将上式移项,可以得到: k1[Et][S] =(k1[S] + k―l + k2)[ES]