正在加载图片...
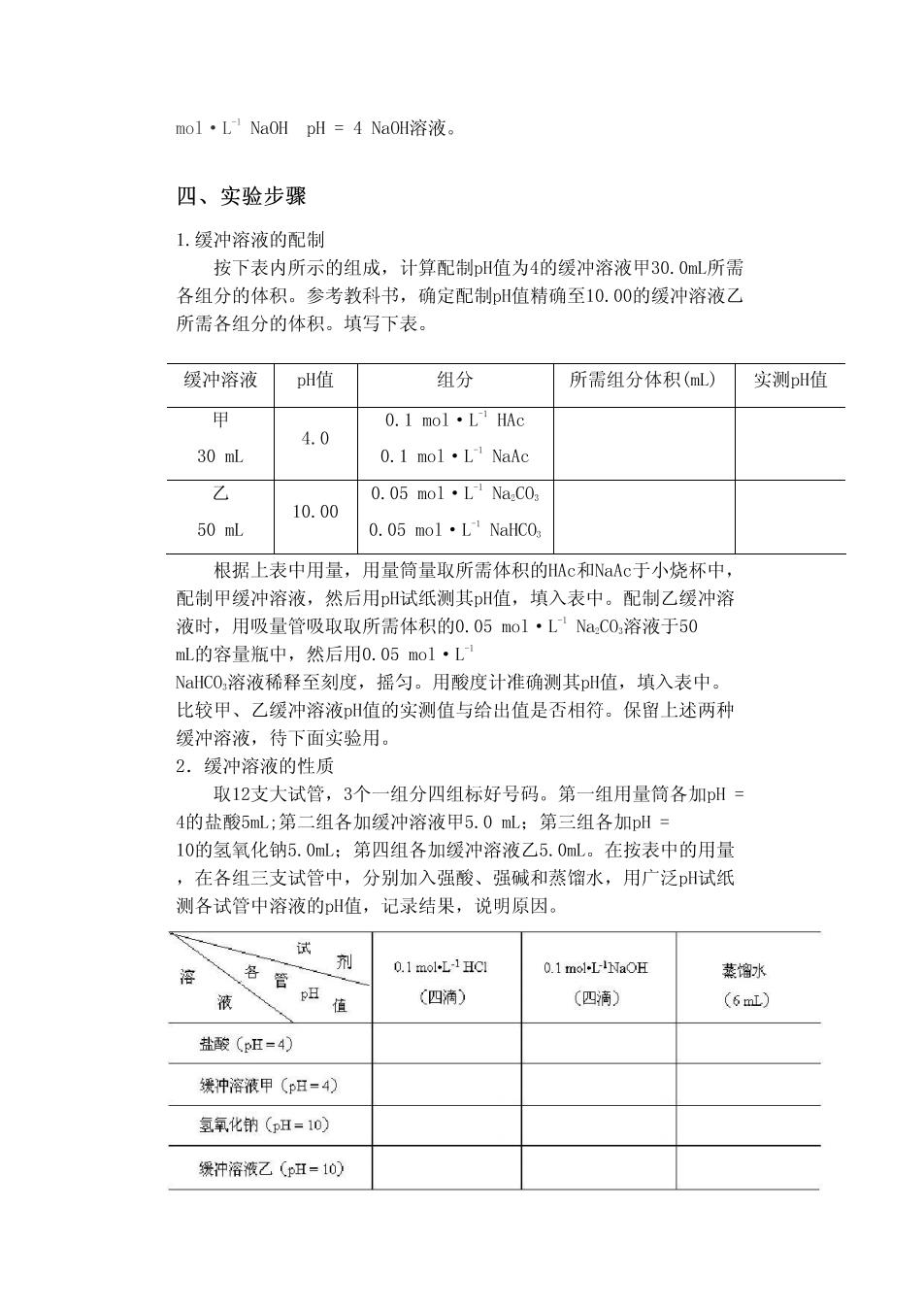
mol·L NaOH pH=4Na0H溶液 四、实验步骤 1.缓冲溶液的配制 按下表内所示的组成,计算配制H值为4的缓冲溶液甲30.0mL所需 各组分的体积。参考教科书,确定配制H值精确至10.00的缓冲溶液乙 所需各组分的体积。填写下表。 缓冲溶液pH值 组分分 所需组分体积(ml,)实测pH值 0.1mol·LHAc 4.0 30 mL 0.1mol·L'NaAc 乙 0.05mol·LNa.C0 10.00 50 mL 0.05mol·L'NaHC0 根据上表中用量,用量筒量取所需体积的Ac和NaAc于小烧杯中, 配制甲缓冲溶液,然后用pH试纸测其H值,填入表中。配制乙缓冲溶 液时,用吸量管吸取取所需体积的0.05mol·LNa,C0,溶液于50 mL的容量瓶中,然后用0.05mo1·L NaC0,溶液稀释至刻度,摇匀。用酸度计准确测其p值,填入表中。 比较甲、乙缓冲溶液H值的实测值与给出值是否相符。保留上述两种 缓冲溶液,待下面实验用。 2.缓冲溶液的性质 取12支大试管,3个一组分四组标好号码。第一组用量筒各加H 4的盐酸5mL:第二组各加缓冲溶液甲5.0mL:第三组各加pH= 10的氢氧化钠5.0mL:第四组各加缓冲溶液乙5.0ml。在按表中的用量 ,在各组三支试管中,分别加入强酸、强碱和蒸馏水,用广泛H试纸 测各试管中溶液的H值,记录结果,说明原因。 试 剂 0.1 mol-LHCI 0.1mi-l小aOF 馏水 液 (四滴) (四滴) (6ml) 盐酸(pH-4) 缓冲溶液甲(p日=4) 氢氧化的(p=10) 缓冲溶液乙(pH=10)