正在加载图片...
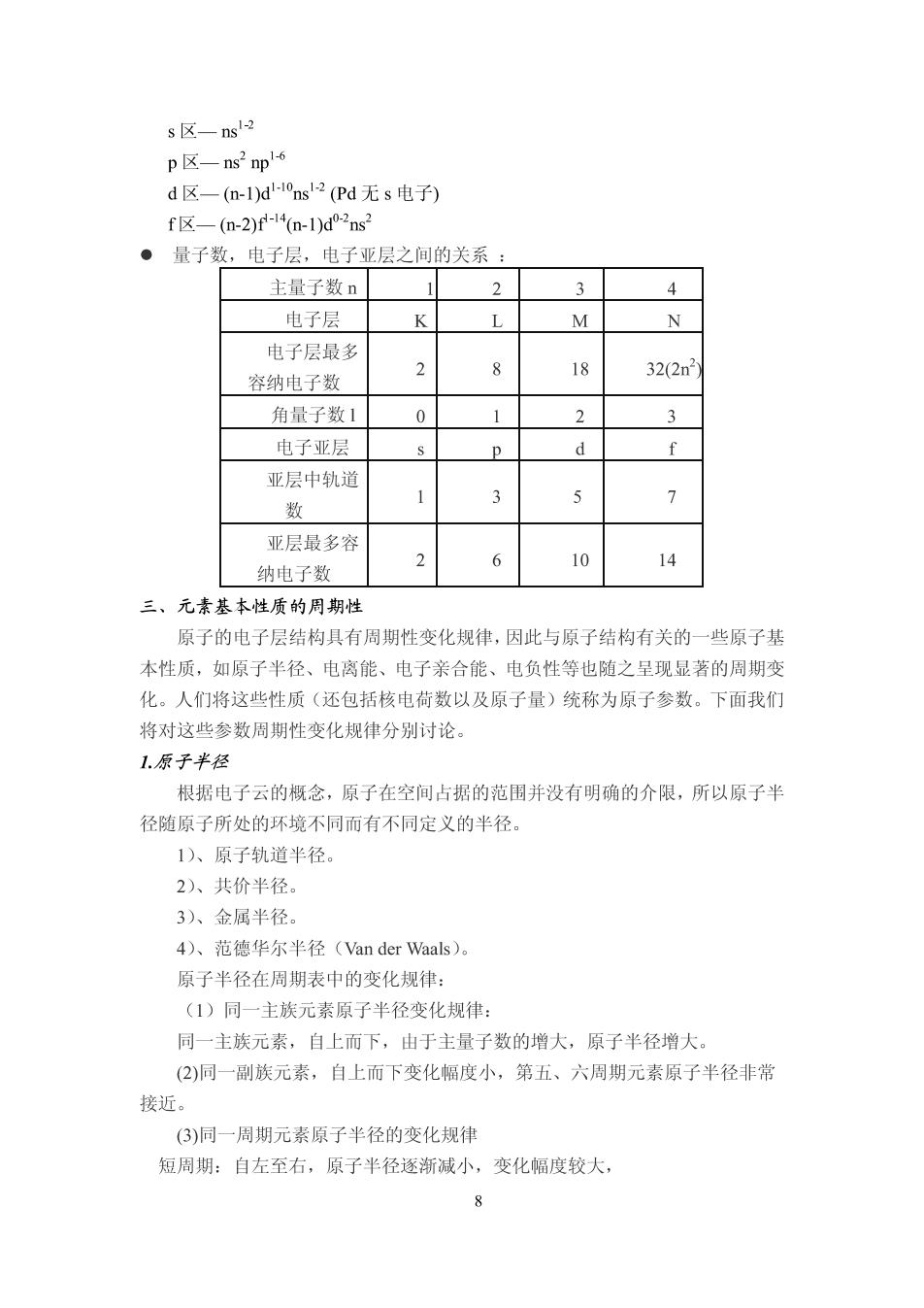
s区-ns2 p☒-ns2p-6 d区-(m-l)d-ns2Pd无s电子) f区-(m-2)f-l4n-1)d0-2ns2 ●量子数,电子层,电子亚层之间的关系: 主量子数n 1 2 3 4 电子层 M N 电子层最多 18 容纳电子数 32(2n 角量子数1 0 2 3 电子亚层 亚层中轨道 数 7 亚层最多容 纳电子数 2 10 14 三、元素基本性质的周期性 原子的电子层结构具有周期性变化规律,因此与原子结构有关的一些原子基 本性质,如原子半径、电离能、电子亲合能、电负性等也随之呈现显著的周期变 化。人们将这些性质(还包括核电荷数以及原子量)统称为原子参数。下面我们 将对这些参数周期性变化规律分别讨论 1.原子半径 根据电子云的概念,原子在空间占据的范围并没有明确的介限,所以原子半 径随原子所处的环境不同而有不同定义的半径。 1)、原子轨道半径。 2)、共价半径。 3)、金属半径。 4)、范德华尔半径(Van der Waals)。 原子半径在周期表中的变化规律: (1)同一主族元素原子半径变化规律: 同一主族元素,自上而下,由于主量子数的增大,原子半径增大。 (2)同一副族元素,自上而下变化幅度小,第五、六周期元素原子半径非常 接近。 (3)同一周期元素原子半径的变化规律 短周期:自左至右,原子半径逐渐减小,变化幅度较大