正在加载图片...
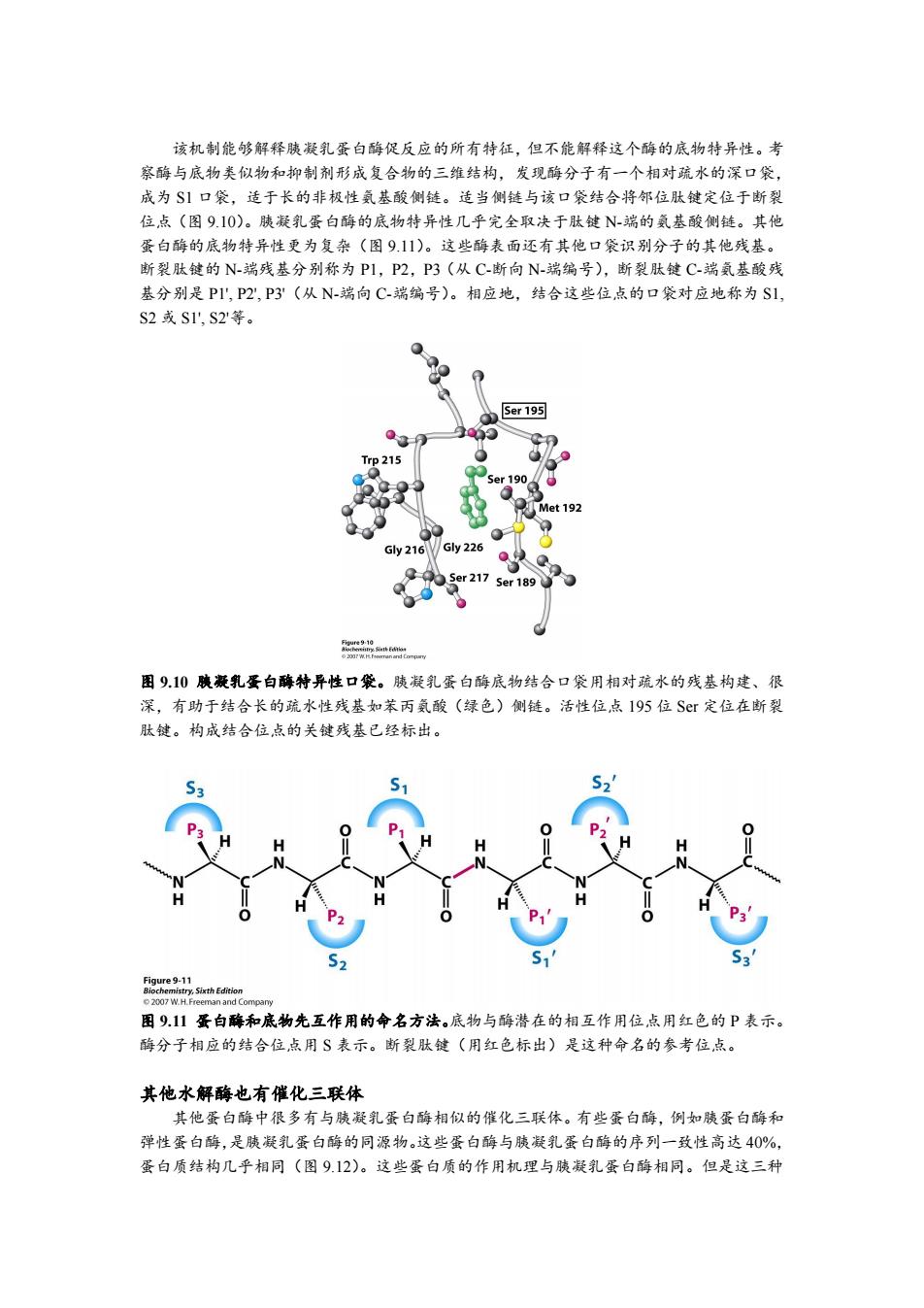
该机制能够解释胰凝乳蛋白酶促反应的所有特征,但不能解释这个酶的底物特异性。考 察酶与底物类似物和抑制剂形成复合物的三维结构,发现酶分子有一个相对疏水的深口袋, 成为S1口袋,适于长的非极性氨基酸侧链。适当侧链与该口袋结合将邻位肽键定位于断裂 位点(图9.10)。胰凝乳蛋白酶的底物特异性几乎完全取决于肽键N-端的氨基酸侧链。其他 蛋白酶的底物特异性更为复杂(图9.11)。这些酶表面还有其他口袋识别分子的其他残基。 断裂肽键的N-端残基分别称为P1,P2,P3(从C-断向N-端编号),断裂肽C-端氨基酸残 基分别是P1',P2,P3'(从N-端向C-端编号)。相应地,结合这些位点的口袋对应地称为S1, S2或S1',S2等。 0 Ser 195 ●3 Trp215 Ser 190 Q Met 192 Gy216 Gly 226 Ser 217 Ser 189 图9.10胰凝乳蛋白酶特异性口袋。胰凝乳蛋白酶底物结合口袋用相对疏水的残基构建、很 深,有助于结合长的疏水性残基如苯丙氨酸(绿色)侧链。活性位,点I95位Sr定位在断裂 肽键。构成结合位点的关键残基已经标出。 0 H ● 51 2007 W.H.Freeman and Company 图911蛋白酶和底物先互作用的命名方法。底物与酶潜在的相互作用位点用红色的P表示。 酶分子相应的结合位,点用S表示。断裂肽键(用红色标出)是这种命名的参考位点。 其他水解酶也有催化三联体 其他蛋白酶中很多有与胰凝乳蛋白酶相似的催化三联体。有些蛋白酶,例如胰蛋白酶和 弹性蛋白酶,是胰凝乳蛋白酶的同源物。这些蛋白酶与胰凝乳蛋白酶的序列一致性高达40%, 蛋白质结构几乎相同(图9.12)。这些蛋白质的作用机理与胰凝乳蛋白酶相同。但是这三种该机制能够解释胰凝乳蛋白酶促反应的所有特征,但不能解释这个酶的底物特异性。考 察酶与底物类似物和抑制剂形成复合物的三维结构,发现酶分子有一个相对疏水的深口袋, 成为 S1 口袋,适于长的非极性氨基酸侧链。适当侧链与该口袋结合将邻位肽键定位于断裂 位点(图 9.10)。胰凝乳蛋白酶的底物特异性几乎完全取决于肽键 N-端的氨基酸侧链。其他 蛋白酶的底物特异性更为复杂(图 9.11)。这些酶表面还有其他口袋识别分子的其他残基。 断裂肽键的 N-端残基分别称为 P1,P2,P3(从 C-断向 N-端编号),断裂肽键 C-端氨基酸残 基分别是 P1', P2', P3'(从 N-端向 C-端编号)。相应地,结合这些位点的口袋对应地称为 S1, S2 或 S1', S2'等。 图 9.10 胰凝乳蛋白酶特异性口袋。胰凝乳蛋白酶底物结合口袋用相对疏水的残基构建、很 深,有助于结合长的疏水性残基如苯丙氨酸(绿色)侧链。活性位点 195 位 Ser 定位在断裂 肽键。构成结合位点的关键残基已经标出。 图 9.11 蛋白酶和底物先互作用的命名方法。底物与酶潜在的相互作用位点用红色的 P 表示。 酶分子相应的结合位点用 S 表示。断裂肽键(用红色标出)是这种命名的参考位点。 其他水解酶也有催化三联体 其他蛋白酶中很多有与胰凝乳蛋白酶相似的催化三联体。有些蛋白酶,例如胰蛋白酶和 弹性蛋白酶,是胰凝乳蛋白酶的同源物。这些蛋白酶与胰凝乳蛋白酶的序列一致性高达 40%, 蛋白质结构几乎相同(图 9.12)。这些蛋白质的作用机理与胰凝乳蛋白酶相同。但是这三种