正在加载图片...
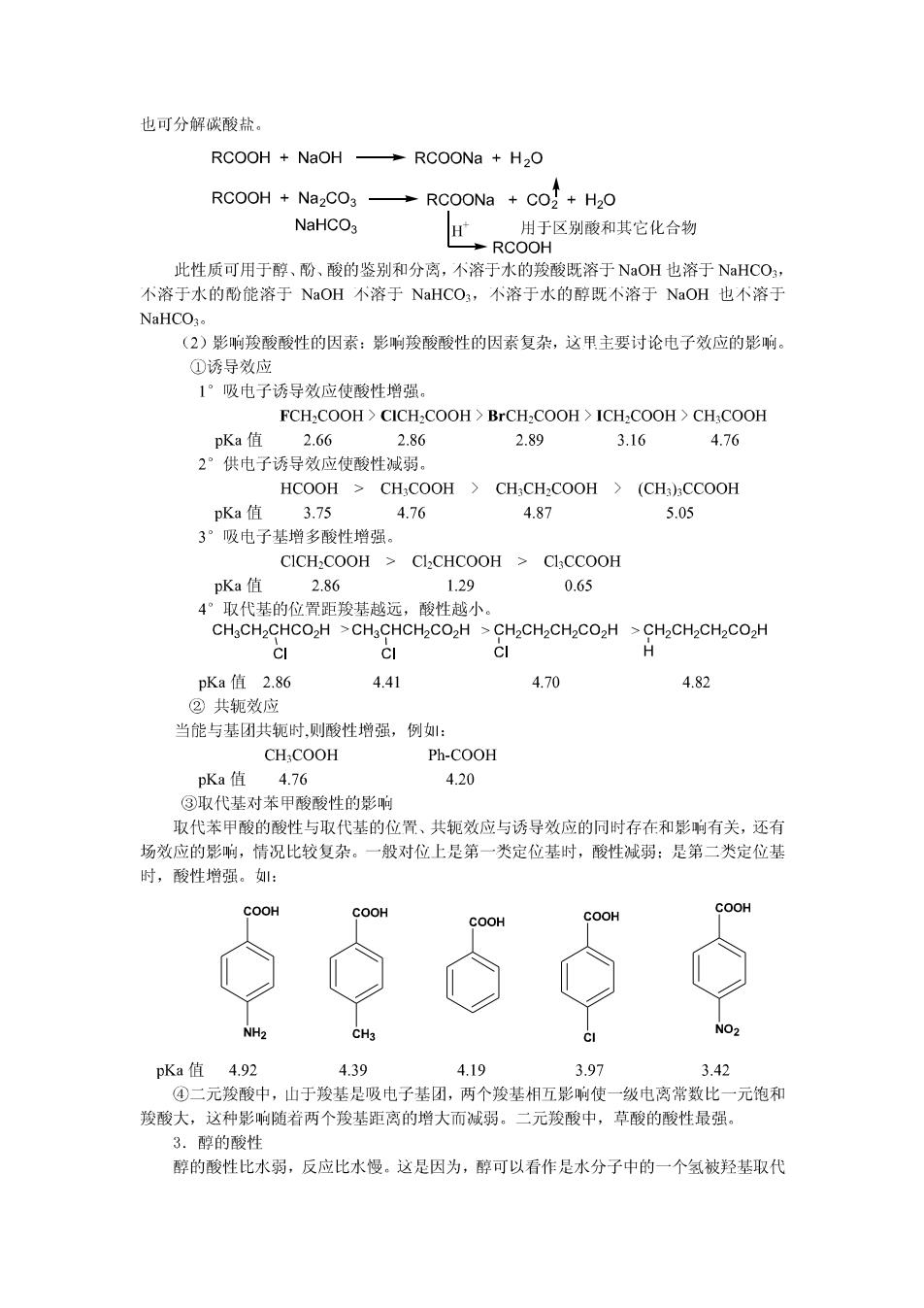
也可分解碳酸盐。 RCOOH NaOH RCOONa H2O RCOOH Na2CO3 RCOONa CO2+H2O NaHCO3 用于区别酸和其它化合物 RCOOH 此性质可用于醇、酚、酸的鉴别和分离,不溶于水的羧酸既溶于NaOH也溶于NaHCO, 不溶于水的酚能溶于NaOH不溶于NaHCO3,不溶于水的醇既不溶于NaOH也个溶于 NaHCO3。 (2)影响羧酸酸性的因素:影响羧酸酸性的因素复杂,这甲主要讨论电子效应的影响。 ①诱导效应 1°吸电子诱导效应使酸性增强。 FCH2COOH CICH2COOH BrCH2COOH ICH2COOH>CH:COOH pKa值 2.66 2.86 2.89 3.16 4.76 2°供电子诱导效应使酸性减弱。 HCOOH>CHCOOH CHCH-COOH (CH3CCOOH pKa值3.75 4.76 4.87 5.05 3°吸电子基增多酸性增强。 CICH COOH CLCHCOOH CICCOOH pKa值 2.86 1.29 0.65 4°取代基的位置距羧基越远,酸性越小。 CH3CH2CHCO2H >CH3CHCH2CO2H CH2CH2CH2CO2H CH2CH2CH2CO2H CI CI ci H pKa值2.86 4.41 4.70 4.82 ②共轭效应 当能与基团共轭时,则酸性增强,例: CHCOOH Ph-COOH pKa值 4.76 4.20 ③取代基对苯甲酸酸性的影响 取代苯甲酸的酸性与取代基的位置、共轭效应与诱导效应的同时存在和影响有关,还有 场效应的影响,情况比较复杂。一般对位上是第一类定位基时,酸性减弱:是第二类定位基 时,酸性增强。: COOH COOH COOH COOH COOH NH2 CH3 NO2 pKa值4.92 4.39 4.19 3.97 3.42 ④二元羧酸中,山于羧基是吸电子基团,两个羧基相五影响使一级电离常数比一元饱和 羧酸大,这种影响随着两个羧基距离的增大而减弱。二元羧酸中,草酸的酸性最强。 3.醇的酸性 醇的酸性比水弱,反应比水慢。这是因为,醇可以看作是水分子中的一个氢被羟基取代