
电子效应、立体效应和有机物的酸碱性 §1电子效应和立体效应 在有机化合物分子中,原子或基团之间有两类不同的效应:一类是电子效应(也叫做 极性效应),另一类是立体效应(也叫做空间效应)。电子效应又分为两类:诱导效应和共轭 效应。 一、诱导效应 1.定义 在有机化合物中,山于成键原子或基团的电负性的不同而使成键电子云向电负性较大 的原子团方向偏移的效应。诱导效应是山于成键原子的电负性不同产生的。 2.诱导效应的特点 (1)诱导效应是一种静电诱导作用,其影响随距离的增训而迅速减弱或消失,诱导效 应在一个·体系传递时,一般认为每经过一个原子,即降低为原来的三分之一,经过二个原 子以后,影响就极弱了,超过五个原子后便没有了。 。82-8计,-8 (2)诱导效应具有迭加性,当几个基团或原子同时对某一键产生诱导效应时,方向相 同,效应相加:方向相反,效应相减。 (3)诱导效应沿单键传递时,只涉及电子云密度分布的改变,共用电子对并不完全转 移到另一原子上。 3.诱导效应的表示方法 以I表示诱导效应,用直线箭头(一表示电子转移方向。 4.诱导效应的强度 诱导效应的强度山原子或基团的电负性决定,一般以氢原子作为比较基准。比氢原子 电负性大的原子或基团表现出吸电性,称为吸电子基,具有吸电诱导效应,一般用-」表示: 比氢原子电负性小的原子或基团表现出供电性,称为供电子基,具有供电诱导效应,一般用 +l表示。 6-& C-H ē-8 + 1=0 - 常见原子或基团的诱导效应强弱次序为: 吸电诱导效应(-):NO2>-CO0H>F>-C1>Br>I>-OH>RC=C->CH5-> R'CH=CR-o 供电诱导效应(+1):(CH)C->(CH3)2CH->CH,CH2->CH3。 上面所讲的是在静态分子中所表现出来的诱导效应,称为静念诱导效应,它是分子在 静止状态的固有性质,没有外界电场影响时也存在。 在化学反应中,分子受外电场的影响或在反应时受极性试剂进攻的影响而引起的电子 云分布的改变,称为动念诱导效应。 二、共轭效应 1.共轭分子 在了解共轭体系和共轭效应之前,首先要了解共轭分子的结构。现以1,3-丁二烯和苯 的结构为例来说明共轭分子的结构

(1)1,3-丁二烯的结构 1,3-丁二烯是最简单的共轭二烯烃,价键理论认为,在1,3-丁二烯分子中,四个碳原子 都是sp2杂化的,相邻碳原子之间以sp2杂化轨道相互轴向重叠形成三个C一Cσ键,其余的 sp2杂化轨道分别与氢原子的1s轨道重叠形成六个C一Ho键。这些o键都处在同一平面上, 即1,3-丁二烯的四个碳原子和六个氢原子都在同一个半面上。 此外,每个碳原子还有一个未参与杂化的p轨道,这些轨道垂直于分子平面月彼此间 相互半行。因此,不仪C1与C2、C3与C4的p轨道发生了侧面重叠,而且C2与C3的p轨 道也发生了一定程度的重叠(但比CC2或C一C4之间的重叠要弱一些),形成了包含四 个碳原子的四个电子的大键。 119.8。H 83nm H H. =C.0.108w H 122.4。 c0.1337nm H 1,3-丁烯的结构 T键所在半而与纸而垂直 σ健所在平面在纸面上 与乙烯不同的是,乙烯分子中的π电子是在两个碳原子间运动,称为电子定域,而在 1,3-丁二烯分子中,π电子云并不是“定域”在CC2和C3一C4之间,而是扩展(或称离 域)到整个共轭双键的四个碳原子周围,即发生了电子的离域,形成了包含四个碳原子的 四电子共轭体系。 山于π电子的离域,使得共轭分子中单、双键的键长趋于平均化。例如1,1,3-丁二烯分 子中C1-C2、C3-C4的键长为0.1337nm,与乙烯的双键键长0.134m相近:而C2-C3的键长 为0.148nm,比乙烷分子中的C-C单键键长0.154m短,显示了C2-C3键具有某些“双键” 的性质。 同样山于电子离域的结果,使共轭体系的能量显著降低,稳定性明显增加。这可以从氢 化热的数据中看出。例如1,1,3-戊二烯(共轭体系)和1,4-戊二烯(非共轭体系)分别加氢 时,它们的氢化热是明显不同的: CH2=C-CH=CH-CH,+2出CH3CH2CH2CH2CH氢化热226kJmo' CH,=C-CH-CH=CH2 +2H2- →CHsCH2CH2CH2CH氢化热251 kJ-mol 两个反应的产物相同,13-戊二烯的氢化热比1.4-戊二烯的低28kJmo,说明1,3-戊二 烯的能量比1,4-戊二烯的低。这种能量差值是山于共轭体系内电子离域引起的,故称为离域 能或共轭能。共轭体系越长,离域能越大,体系的能量越低,化合物越稳定。 (2)苯分子的结构 近代物理方法测定证明,苯分子中的六个碳原子和六个氢原子都在同一半面上,碳-碳 键长均相等(0.1396m),六个碳原子组成一个正六边形,所有键角均为120°。 H 1200 1200 H H 1200 0.1396nm H H 苯分子的结构 现代价键理论认为,苯分子中的碳原子均为$p杂化,每个碳原子的三个sp杂化轨道 分别与相邻的两个碳原子的p杂化轨道和氢原子的s轨道重叠形成二个o键。山于二个Sp 杂化轨道都处在同一半面内,所以苯分子中的所有碳原子和氢原子必然都在同一半面内,六

个碳原子形成一个正六边形,所有键角均为120°。另外,每个碳原子上还有一个未参加杂化 的p轨道,这些p轨道的对称轴互相平行,月垂直于苯环所在的平面。p轨道之间彼此重叠 形成一个闭合共轭大π键,闭合共轭大π键电子云呈轮胎状,对称分布在苯环平面的上方和 下方。因此J.Thiele建议用 来表示苯的结构。 (a) (b) 苯分子中的p轨道及p轨道重叠形成的闭合共轭大π键示意图 山于六个碳原子完全等同,所以大π键电子云在六个碳原子之间均匀分布,即电子云分 布完全平均化,因此碳-碳键长完全相等,不存在单双键之分。山于苯环共轭大π键的高度 离域,使分子能量大大降低,因此苯环具有高度的稳定性。 苯分子的稳定性可用热化学常数一氢化热来证明。例,环己烯的氢化热为119.5k灯 "mol- H2 119.5 kJ-mol-l 果把苯的结构看成是凯库勒式所表示的环已二烯,它的氢化热应是环己烯的三倍,即 为358.5kJmo,而实际测得苯的氢化热仪为208kJ·mol,比358.5kJ·mo低150.5kJ ·o。这充分说明苯分子个是环己二烯的结构,即分子中不存在三个典型的碳-碳双键。我 们把苯和环己二烯氢化热的差值150.5k·mo称为苯的离域能或共轭能。正是山于苯具有 离域能,使苯比环己二三烯稳定得多。事实上,环己三烯的结构是根本不可能稳定存在的。 2.共轭体系 (1)共轭体系的涵义(共轭一半均分担之意,1牛之轭) 在分子结构中,含有二个或三个以上相邻月共平面的原子时,这些原子中相互平行的轨 道之间相互交盖连在一起,从而形成离域键(大π键)体系称为共轭体系。 (2)共轭体系的特点: 1。组成共轭体系的原子具共平面性 2°键长趋于平均化。(因电子云离域而致)。 正常C-C键键长0.154nm 丁二烯中 C-C键长0.147nm C=C 0.133nm C=C 0.1337nm 苯分之中 C-C键长均为0.1397nm 3°内能较低,分子趋于稳定(可从氢化热得知)。 (3)共轭体系的类型 1°r-r共轭体系: CH2=CH-CH=CH2 CH2=CH-CH=CH-CH=CH> 2°P.π共轭体系: CH2=CH-CI CH2=CH-CH2 u-个u

3°o-π共轭体系:CH-CH=CH2( 丙烯分子中的超共轭 4°g-P共轭体系:CHaCH2 CHaCH2 正碳离子的超共轭 自由基的超共轭 0-π共轭和0-p共轭,统称为超共轭体系。 3.共轭效应 (1)共轭效应的含义 在共轭效应中,山于轨道之间的相互交盖,使共轭体系中电子云分布产生离域作用, 键长趋于半均化,分子的内能降低,更稳定的现象称为共轭效应。 (2)共轭效应的传递:沿着共轭链交替传递,不因链长而减弱(交替、远程传递)。例 如: CHa-CH-CH=CH-CH=CH2 CHs-8H--CH--8H--CH-CH CHa-CH--CH--CH--CH--CH2 (3)静念共轭效应的用对强度 1°对P-共轭效应有两种情况: a富电子时,P电子朝着双键方向转移,呈供电子共轭效应(+C)。 ⊙¥ X-CH-CH- CH2-CH-CH b缺电子时,π电子云向P轨道转移,呈吸电子共轭效应(-C)。共相对强度视体 系结构而定。 2°π-共轭的相对强度 双键与电负性大的不饱和基团共轭时,共轭体系的电子云向电负性大的元素偏移,呈 现出吸电子的共轭效应(-C)。例: -cc∂ 其相对强度为:=O>=NR>=CR2 =O>=S 3°超共轭效应 因0-π共轭效应,0-P共轭效应比π-Ⅱ共轭效应和P.Ⅱ共轭效应要弱得多,所以将 其称为超共轭效应。通过氢化热数据可以说明超共轭效应是存在的。 CH:CH,CH=CH,+H,>CHCH,CH,CH 氢化热126.8KJ/mol Z-CH3CH=CHCH3+H2->CH:CH2CH2CH3 氢化热119.7KJ/mol CH:C=CHCH3+H2>CH:CHCH,CH 氢化热112.5KJ/mol CHs CHs 可见,与双键碳相连的CH键越多其超共轭效应越明显。 应当指出共轭效应常与诱导效应同时存在,同时影响着分子的电子云分布和化学性

质。利用它们可以解释有机化学中的许多问题。 三、立体效应 有机化合物分子中原子或基团的大小,对有机物的性质有影响,这种影响就是原子或基 团的立体效应(空间效应)。 §2有机物的酸碱性 一、概述 有机化学中的酸碱理论是理解有机反应的最基本的概念之一,目前广泛应用于有机化学 的是布朗斯特(J.N.Bronsted)酸碱质子理论和路易斯(G.N.Lewis)酸碱电子理论。 1.布朗斯特酸碱质子理论 布朗斯特认为,凡是能给出质子的分子或离子都是酸:凡是能与质子结合的分子或离子 都是碱。酸失去质子,剩余的基团就是它的共轭碱:碱得到质子生成的物质就是它的共轭酸。 例,醋酸溶于水的反应可表示1下: CH3C00H+H20、÷ CH3C00+H,0 在正反应中,CH,C00H是酸,CH;COO是它的共轭碱:H0是碱,HO是它的共轭酸。 对逆反应来说,HO是酸,H2O是它的共轭碱:CH.COO°是碱,CH:COOH是它的共轭酸。 在共轭酸碱中,一种酸的酸性愈强,其共轭碱的碱性就愈弱,因此,酸碱的概念是相对 的,某一物质在一个反应中是酸,而在另一反应中可以是碱。例1,H0对CHCO0来说 是酸,而H2O对NH4则是碱: H20+CH3C00 CH3COOH 0H (酸) (碱) (共轭酸) (共轭碱) H20 NH NH3 +H0 (碱) (酸) (共轭碱) (共轭酸) 酸的强度,通常用离解平衡常数Ka或pKa表示:碱的强度则用Kb或pKb表示。在水溶 液中,酸的pKa与共轭碱的pKb之和为14。即: 碱的pKb=14-共轭酸的pKa 在酸碱反应中,总是较强的酸把质子传递给较强的碱。例如: RONa H20 ROH NaOH (较逆碱)(较强酸》 (较羽酸)(较弱碱) 2.路易斯酸碱电子理论 布朗斯特酸碱理论仪限于得失质子,而路易斯酸碱理论着眼于电子对,认为酸是能接受外 来电子对的电子接受体:碱是能给出电子对的电子给予体。因此,酸和碱的反应可用下式表 示: A+B亡A:B 上式中,A是路易斯酸,它全少有一个原子具有空轨道,具有接受电子对的能力,在有 机反应中常称为亲电试剂:B是路易斯碱,它全少含有一对未共用电子对,具有给予电子对 的能力,在有机反应中常称为亲核试剂。酸和碱反应尘成的AB叫做酸碱加合物。 路易斯碱与布朗斯特碱两者没有多大区别,但路易斯酸要比布朗斯特酸概念广泛得多
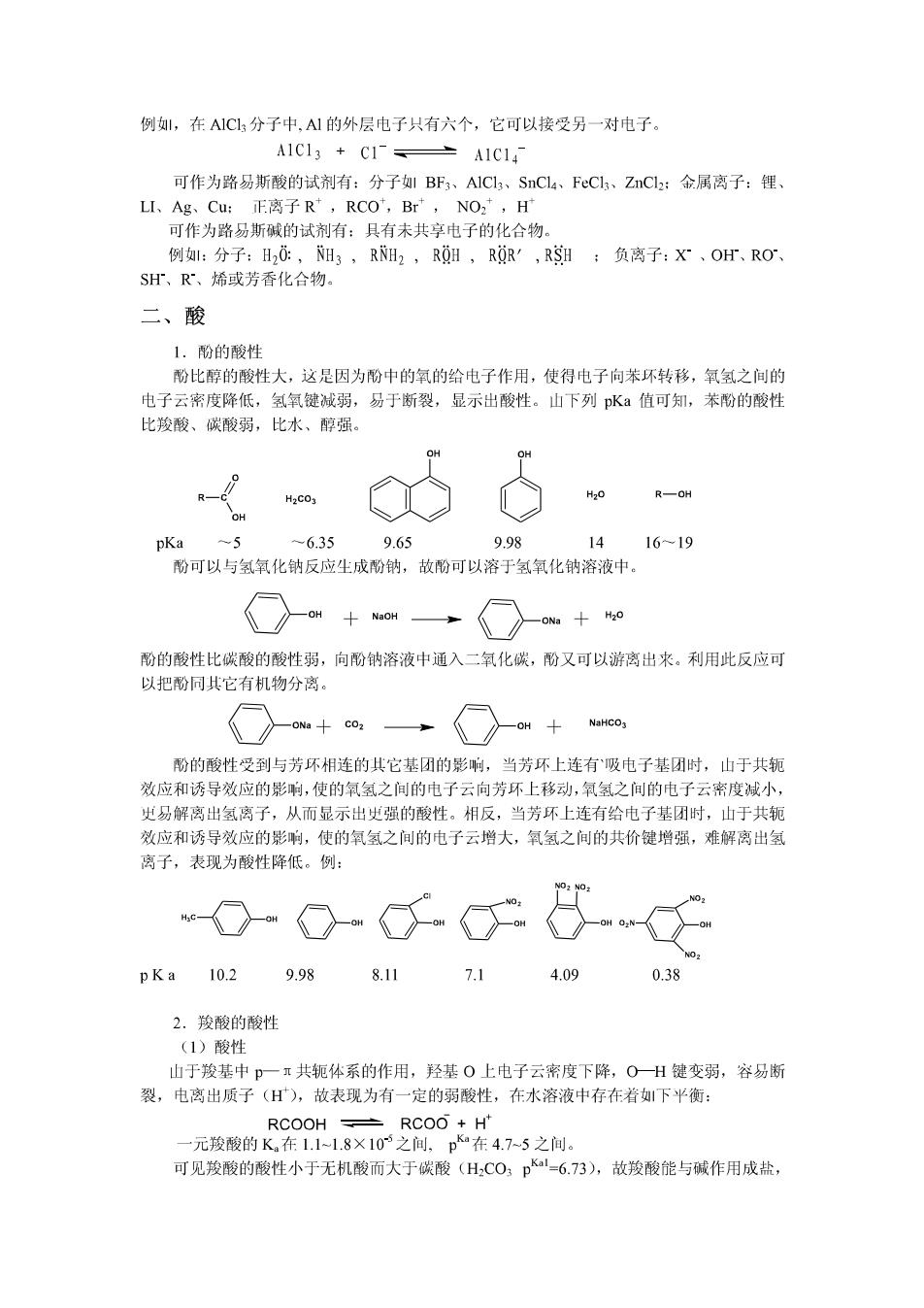
例1,在A1C13分子中,A1的外层电子只有六个,它可以接受另一对电子。 A1C13+C1产A1C14 可作为路易斯酸的试剂有:分子1BF3、A1Cl3、SnCl4、FeCl、ZnCl2:金属离子:锂、 LI、Ag、Cu:E离子R,RCO,Br,NO2,H 可作为路易斯碱的试剂有:具有未共享电子的化合物 例:分子:H20:,NH3,RNH2,R0H,RQR',RSI;负离子:X°、OH、RO、 SH、R°、烯或芳香化合物。 二、酸 1.酚的酸性 酚比醇的酸性大,这是因为酚中的氧的给电子作用,使得电子向苯环转移,氧氢之间的 电子云密度降低,氢氧键减弱,易于断裂,显示出酸性。山下列pK:值可知,苯酚的酸性 比羧酸、碳酸弱,比水、醇强。 H20 R—OH pKa 6.35 9.65 9.98 14 16-19 酚可以与氢氧化钠反应生成酚钠,故酚可以溶于氢氧化钠溶液中。 ONa H20 酚的酸性比碳酸的酸性弱,向酚钠溶液中通入二氧化碳,酚又可以游离出来。利用此反应可 以把酚同其它有机物分离。 -ONa CO2 -OH NaHCO3 酚的酸性受到与芳环相连的共它基团的影响,当芳环上连有`吸电子基团时,山于共轭 效应和诱导效应的影响,使的氧氢之间的电子云向芳环上移动,氧氢之间的电子云密度减小, 史易解离出氢离子,从而显示出史强的酸性。相反,当芳环上连有给电子基团时,山于共轭 效应和诱导效应的影响,使的氧氢之间的电子云增大,氧氢之间的共价键增强,难解离出氢 离子,表现为酸性降低。例: pKa 10.2 9.98 8.11 7.1 4.09 0.38 2.羧酸的酸性 (1)酸性 山于羧基中p一π共轭体系的作用,羟基O上电子云密度下降,O一H键变弱,容易断 裂,电离出质子(H),故表现为有一定的弱酸性,在水溶液中存在着下平衡: RCOOH±RCOO+Ht 一元羧酸的K在1.11.8×105之间,pa在4.75之间。 可见羧酸的酸性小于无机酸而大于碳酸(HCO,pKl=6.73),故羧酸能与碱作用成盐
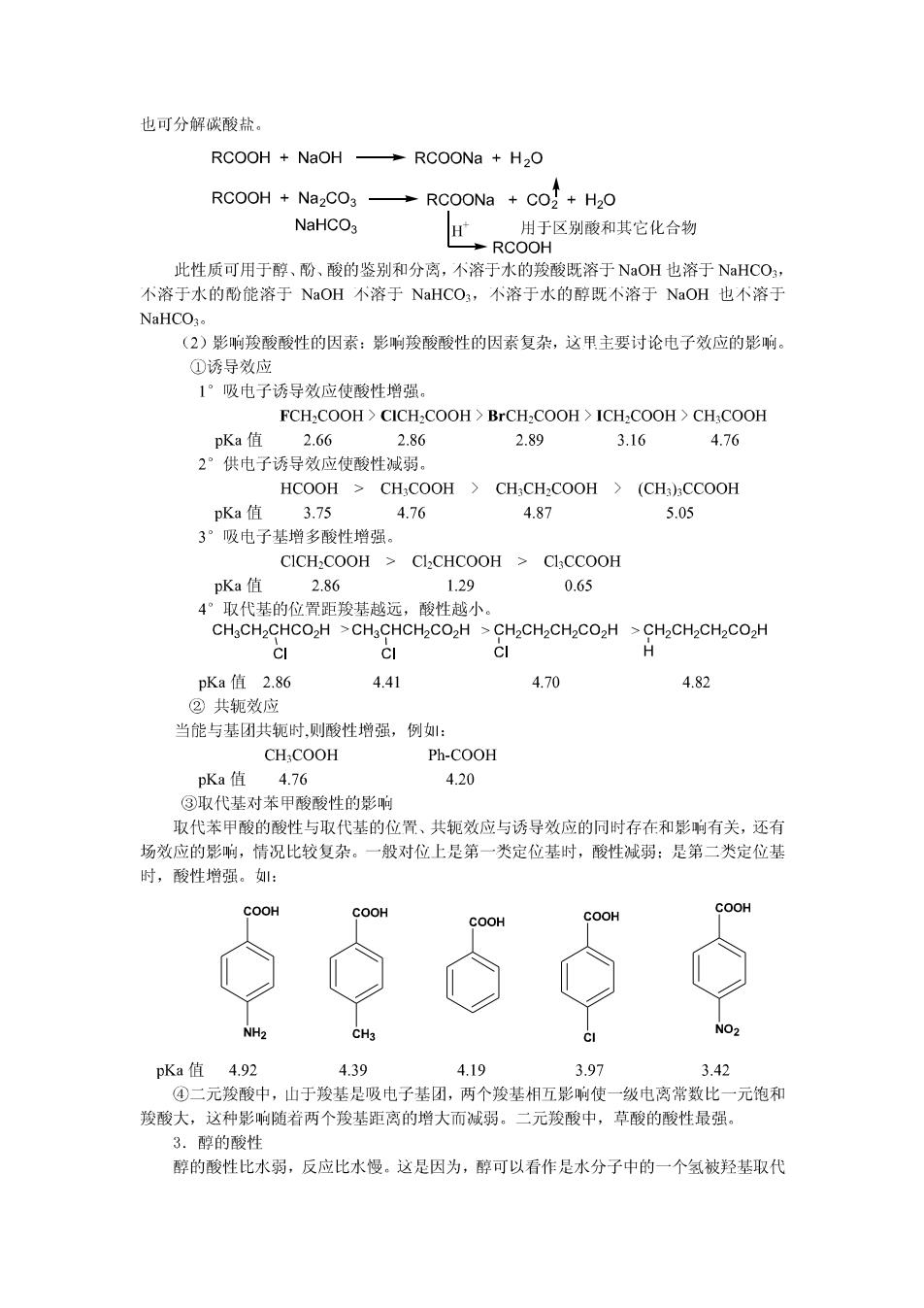
也可分解碳酸盐。 RCOOH NaOH RCOONa H2O RCOOH Na2CO3 RCOONa CO2+H2O NaHCO3 用于区别酸和其它化合物 RCOOH 此性质可用于醇、酚、酸的鉴别和分离,不溶于水的羧酸既溶于NaOH也溶于NaHCO, 不溶于水的酚能溶于NaOH不溶于NaHCO3,不溶于水的醇既不溶于NaOH也个溶于 NaHCO3。 (2)影响羧酸酸性的因素:影响羧酸酸性的因素复杂,这甲主要讨论电子效应的影响。 ①诱导效应 1°吸电子诱导效应使酸性增强。 FCH2COOH CICH2COOH BrCH2COOH ICH2COOH>CH:COOH pKa值 2.66 2.86 2.89 3.16 4.76 2°供电子诱导效应使酸性减弱。 HCOOH>CHCOOH CHCH-COOH (CH3CCOOH pKa值3.75 4.76 4.87 5.05 3°吸电子基增多酸性增强。 CICH COOH CLCHCOOH CICCOOH pKa值 2.86 1.29 0.65 4°取代基的位置距羧基越远,酸性越小。 CH3CH2CHCO2H >CH3CHCH2CO2H CH2CH2CH2CO2H CH2CH2CH2CO2H CI CI ci H pKa值2.86 4.41 4.70 4.82 ②共轭效应 当能与基团共轭时,则酸性增强,例: CHCOOH Ph-COOH pKa值 4.76 4.20 ③取代基对苯甲酸酸性的影响 取代苯甲酸的酸性与取代基的位置、共轭效应与诱导效应的同时存在和影响有关,还有 场效应的影响,情况比较复杂。一般对位上是第一类定位基时,酸性减弱:是第二类定位基 时,酸性增强。: COOH COOH COOH COOH COOH NH2 CH3 NO2 pKa值4.92 4.39 4.19 3.97 3.42 ④二元羧酸中,山于羧基是吸电子基团,两个羧基相五影响使一级电离常数比一元饱和 羧酸大,这种影响随着两个羧基距离的增大而减弱。二元羧酸中,草酸的酸性最强。 3.醇的酸性 醇的酸性比水弱,反应比水慢。这是因为,醇可以看作是水分子中的一个氢被羟基取代

的产物,山于烷基的推电子能力比氢大,氧氢之间电子云密度大,同水相比,O一H键难于 断裂。 三、碱 1.胺的碱性 胺和氨相似,N原子上有孤对电子,可以接受质子,从而显碱性。能与大多数酸作用成 盐。 RNH2+HCI→R-NHaCl R-NH2 HOSO,H-R-NH3 OSO3H 胺的碱性较弱,其盐与氢氧化钠溶液作用时,释放出游离胺。 R-NHaCI+NaOH--RNH2 Cl+H2O 胺的碱性强弱,可用K,或pK表示,不同类型胺的碱性: 脂肪胺〉氨〉芳香胺 pKb 8.40 解释: ()胺碱性比氨弱:烷基的推电子作用,使N上电子云密度高,接受质子的能力增强。 (2)芳胺的碱性比氨弱:芳胺中山于p-π共轭作用,N原子上的电子云密度降低,因 此碱性比氨弱。 脂肪胺之间:在气念时碱性为:(CH)N>(CH)NH>CHNH2>NH 在水溶液中减性为:(CH)2NH>CHNH2>(CH)N>NH3 解释 (1)气念时,仪有烷基的供电子效应,烷基越多,供电子效应越大,故碱性次序上。 (2)在水溶液中,碱性的强弱决定于电子效应、溶剂化效应等。溶剂化效应一铵正 离子与水的溶剂化作用(胺的氮原子上的氢与水形成氢键的作用)。 胺的氮原子上的氢越多,溶剂化作用越大,铵正离子越稳定,胺的碱性越强。 H--OH2 R-N<-H--OH2 R2-N<H--OH2 H H--OH2 -H--OH2 R3-N-H--O< H 芳胺之间的碱性: ArNH Ar2NH ArN 例 NH: PhNH2 (Ph)2NH (Ph)N pK4.759.38 13.21 中性 对取代芳胺,苯环上连供电子基时,碱性略有增强:连有吸电子基时,碱性则降低。 季氨碱:碱性与氢氧化钠碱性相当。 一般有机胺碱性强弱排列次序举例:水溶液中 苯胺<NH3<(CH)N<CHNH2<(CH3)NH< 季氨碱 pKb:9.374.75 4.22 3.35 3.27 强碱 2.吡咯和吡啶的酸碱性 (1)吡咯 含氮化合物的碱性强弱主要取决于氮原子上未共用电子对与的结合能力。在毗咯分 子中,山于氮原子上的未共用电子对参与环的共轭体系,使氮原子上电子云密度降低,吸 引的能力减弱。另一方面,山于这种pπ共轭效应使与氮原子相连的氢原子有离解成 的可能,所以吡咯不但不显碱性,反而呈弱酸性,可与碱金属、氢氧化御或氢氧化钠作

用生成盐。 ]+KOH△→ 吡咯的酸性介与乙醇和苯酚之间。 OH CH3CH2OH N H K2=13×1010 1×1015 1×10-18 (2)吡啶 吡啶氮原子上的未共电子对不参与环共轭体系,能与H结合成盐,所以吡啶显弱碱性, 比苯胺碱性强,但比脂肪胺及氨的碱性弱得多。 HCI 吡啶的碱性小于氨大于苯胺。 CHgNH2 NH3 -NH2 N pK3.38 4.76 8.80 9.42 解释:原子轨道杂化念对N原子的碱性具有很重要的影响,一般为SP<SP<SP。吡啶 中N原子为SP杂化,NH中N原子为SP杂化,故吡啶碱性比无机氨弱。当吡啶和吡咯氢化 生成六氢吡啶和四氢吡咯后,分子中的N原子杂化念变为SP,它们即显示仲胺较强碱性。 3.酰胺酸碱性 酰胺分子中,氨基上的未共用电子对与羰基形成Dπ共轭体系,使氮原子上的电子云 密度降低,减弱了氨基接受质子的能力,是近乎中性的化合物。 1 同步练习题 1.将下列化合物按酸性增强的顺序排列: a.CH:CH2CHBrCO2H b.CH:CHBrCH2CO2H c.CH:CH2CH2CO2H d.CH3CH2CH2CH2OH e.CoHsOH f.H2CO3 g.Br3CCO2H h.H2O 2.比较下列化合物的相对酸性强弱: 苯酚对甲氧基苯酚对硝基苯酚2,4二硝基苯酚对溴苯酚 对甲基苯酚 3.将下列化合物按碱性增强的顺序排列: a.CHCONH2 b.CH;CH-NH2 c.H2NCONH2 d.(CH,CH2)2NH e.(CHCH2)N OH

4.如1何解释下列事实? a.卡胺(CcHsCH2NH2)的碱性与烷基胺基本相同,而与芳胺不同。 b.下列化合物的pK为 NH2 H3C〈 -NH2 pKb=13.0 pK=9.37 pK=8.70