
有机化学反应历程 §1共价键的断裂方式和有机化学反应类型 有机分子之间发生反应,其本质就是这些分子中某些共价键的断裂和新共价键的形成。 一、共价键的断裂 共价键的断裂有两种方式。一种方式是共价键断裂时,成键的一对电子平均分给两个 原子或原子团。 CY-C.Y. 均裂 这种断裂方式称为均裂。均裂生成的带单电子的原子或原子团称为自山基或游离基。如 CH?叫甲基自山基。自山基通常用R·表示。均裂反应一般要在光照条件或高温加热下进行。 共价键断裂的另一种方式是异裂。共价键异裂时,成键的一对电子保在一个原子上。 异裂有两种情况: 碳正离了 CY →C++y 异裂 或 碳负离了 CY→C+y 异裂 共价键异裂产生的是离子。异裂一般需要酸、碱催化或在极性物质存在下进行。 二、有机反应类型 根据共价键的断裂方式,有机反应分为两大类:游离基反应类型和离子型反应类型。共 价键均裂生成游离基而引发的反应称为游离基反应:共价键异裂生成离子而引发的反应称为 离子型反应。 离子型反应根据反应实际类型的不同,又可分为亲电反应和亲核反应。 亲电反应一山亲电试剂进攻而引发的反应。 离子型反 亲核反应一山亲核试剂进攻而引发的反应。 亲电反应又可再分为亲电加成反应和亲电取代反应:亲核反应也可再分为亲核加成反 应和亲核取代反应。 亲电试剂一在反应过程中接受电子的试剂称为亲电试剂。 亲核试剂 在反应过程中能提供电子而进攻反应物中带部分正电荷的碳原子的试剂 §2重要有机化学反应历程 一、概述 反应历程一化学反应所经历的途径或过程,又称为反应机理。 反应历程是根据大量的实验事实作出来的理论推导,实验事实越丰富,可靠的程度就越 大。到目前为止,有些已被公认确定下来,有些尚欠成熟,有待于理论化学工作者的进一步

勞力。 二、亲电加成反应历程 1.亲电加成反应历程 以乙烯和溴的加成反应为例来讨论。 (1)实验事实烯烃的亲电加成反应历程可山实验证明 CH2=CH2+Br2NaC(水溶液) CH2-CH2 CH2-CH2 尤CH2CH2 Br BrBr Cl CI CI 实验说明:与溴的加成不是一步,而是分两步进行的。因若是一步的话,则两个溴原 子应同时加到双键上去,那么C1就不可能加进去,产物应仪为1,2-二溴乙烷,而不可能 有1-氯-2-溴乙烷。但实际产物中党然有1-氯-2-溴乙烷,没有1,2-二氯乙烷。因而可以 肯定C是在第二步才加上去的,没有参加第一步反应。 (2)亲电加成历程 溴在接近碳碳双键时极化成B户一B泸,山于带微正电荷的溴原子较带微负电荷的溴 原子史不稳定,所以,第一步反应是Br+首先进攻双键碳中带微负电荷的碳原子,形成溴 鎓离子,第二步负离子从反面进攻溴鎓离子尘成产物。 H、H 第一步 -Br-Br→ Br+Bro HH CH2 Br+ CH2\ CH2-Br 第二步 Br-CH2 (c9) ChBr (c9 在第一步反应时体系中有Na、Br,但Na具饱和电子结构,有惰性,故第一步只有 B参与反应,因而无1,2-二氯乙烷生成。第一步是因难的,它的速率基本上或完全控制着 整个加成的速率,为律速步骤。 上面的加成反应实质上是亲电试剂B对键的进攻引起的,所以叫做亲电加成反应。 山于加成是山溴分子发尘异裂后尘成的离子进行的,故这类加成又称为离子型亲电加成反 应。 两点说明: 1°亲电加成反应历程有两种,都是分两步进行的,作为第一步都是形成带正电的中间 体(一种是鎓离子,另一种是碳正离子)。 2°山于形成的中间体的结构不同,第二步加负性基团时,进攻的方向不一样,中间体 为鎓离子时,负性基团只能从反面进攻,中间体为碳正离子时,正反两面都可以。 Nu Nu~ 反向进政一 Et 反式加成产物 两向进攻 Nu 顺式加成 反式加成 (第步) (第二步) 混合产物

一股Br2I2通过嗡离子历程,HⅨ等通过碳下离子力程。 2.历程为亲电侧成的有机化学反应 通常烯烃的加成反应,炔烃、共轭二烯烃与卤素、卤化氢的加成反应都是亲电加成反应。 3.马尔可夫尼可夫规则及其解释 ①马氏规则:不对称烯烃与不对称试剂发尘加成反应时,氢原子总是加到含氢较多的双 键碳原子上,卤原子或共它原子或基团加在舍氢较少的双键碳原子上。这个规则称为 Markovnikov规则,简称马氏规则。应用马氏规则可以预测不对称烯烃与个对称试剂加成时 的主要产物。 ②解释 根据诱导效应就不难理解马氏规则,例当丙烯与HB加成时,丙烯分子中的甲基是 一个供电子基,甲基表现出向双键供电子,结果使双键上的电子云发生极化,π电子云发 生极化的方向与甲基供电子方向一致,这样,含氢原子较少的双键碳原子带部分正电荷 (δ),含氢原子较多的双键碳原子则带部分负电荷(8)。加成时,进攻试剂HBr分子中 带正电荷的H首先加到带负电荷的(即含氢较多的)双键碳原子上,然后,B才加到另 一个双键碳上,产物符合马氏规则。 CHCHCHCHs CH-CHB CH3CHCHs Br 马氏规则也可以山反应过程中生成的活性中间体正碳离子的稳定性来解释。例,丙 烯和HBr加成,第一步反应尘成的正碳离子中间体有两种可能: →CH,-CH-CH (① CH;-CH-CH+HBr-Br →CH,CH2tH2] (四 究竞尘成哪一种正碳离子,这取决于正碳离子的相对稳定性。根据物理学上的规律, 一个带电体系的稳定性取决于所带电荷的分散程度,电荷愈分散,体系愈稳定。丙烯分子中 的甲基是一个供电子基,表现出供电诱导效应,甲基的成键电子云向缺电子的正碳离子方向 移动,使正碳离子的正电荷减少一部分,因而使其正电荷得到分散,体系趋于稳定。因此, 带正电荷的碳上连接的烷基越多,供电诱导效应越大,正碳离子的稳定性越高。 一般烷基正碳离子的稳定性次序为:叔>仲>伯>甲基正离子,即3>2>1>CH3。例如: (CH3)C>(CH3CH>CHCH>CH 根据正碳离子的稳定性次序,正碳离子(I)比()稳定,所以正碳离子(I)为该加成 反应的主要中间体。()一旦生成,很快与B·结合,生成2-溴丙烷,符合马氏规则。 4.烯烃结构对亲电加成反应活性和反应取向的影响: (1)反应活性指反应的速率大小:一般地,双键上电子云密度越大,亲电反应活性越 大。反应取向指区域选择性,即当反应有可能产生几个异构体时,只生成或主要生成一个产 物。与双键直接相连的基团的电子效应影响反应活性和反应取向。 当R是烷基时,一般地,烷基有推电子的诱导效应+I,有的还有推电子的超共轭效应+C, 使C=C双键上的电子云密度增大,反应速率比乙烯大,双键上烷基越多,反应速率越快。 此时,反应速率与空间效应关系不大。产物符合马氏规则,HⅨ与丙烯反应主要生成产物 (i)

X CH:CH =CH2 +HX >CH3CHCH3 (i) CH:CH=CH2 +HX->CH3CH2CHzX (ii) 这种取向可以用电子效应来解释,即酸与烯烃加成的位置与形成碳正离子的稳定性有关,! 按(i)式加成,话性中间体为二级碳正离子(iii),(iii)上有两个甲基的推电子诱导效 应和超共轭效应。如按(ii)反应,活性中间体为一级碳正离子(iv),只有一个乙基有推 电子诱导效应与超共轭效应。因此,(iii)比(iv)稳定。 H H H C-C>-H HH H H (n) (iv). (2)当R是卤素原子时,卤素原子的电子效应为:-1,+C,条电试剂进攻烯烃前, -I>+C,双键电子云密度降低,反应速率比乙烯小:生成碳正离子时,+C>-1, HC CH3 CH2 (I) (II 即(I)比(II)稳定,所以产物仍然符合马氏规则。 (3)当R是-CF3,-NO2,-CN,-COOH,-CH0等基团时,山于它们的电子效应为:-I, -C,所以,反应速率比乙烯小。在很多情况下,反应取向是反马式规则的,但仍符合电性规 律,即可以山电子效应来解释,: FFC-CIs-CH:F.CHCHX "F 山于FC吸电子,使电子向它转移,双键上的电子也向C-2方向转移,使C-2带上部 分负电荷,C-1带部分正电荷。故在进行亲电加成时,H与C-2结合,然后X与C-1结合, 得反马氏规则的产物。 三、亲电取代反应历程 1.苯环的亲电取代反应历程 苯及同系物的取代反应都是亲电取代历程,其历程可用通式表示下: π络个物 6绍介物 实验证明,硝化、磺化和氯代是只形成σ络合物的历程,溴化是先形成π络合物,再转 变为σ络合物的历程。具体以卤化和付氏烷基化反应为例来讨论 (1)卤代反应

Fe或FeBr3 +Br2 HBr 55-60℃ 反应历程: Br-Br FeBr [FeBr4] Br HCI FeBr π络合物 。络合物 (2)烷基化反应 苯与烷基化剂在路易斯酸的催化下生成烷基苯的反应称为付一克烷基化反应。 AlCh CHCH,Br -CH2CH3+HBr 0-25C 76% 反应历程: CH CHaBr AlClCH,CH2-Br...ACl 、→CH,CH2+[A1C13Bm CH2CH3 +CH CHz H-H CH2CHs+HBr AICI 此反应中应注意以下几点: 1°常用的催化剂是无水A1Cl3,此外FeCl3、BF3、无水HF、SnCl4、ZnCl2、HPO4、 H2S04等都有催化作用。 2°当引入的烷基为三个碳以上时,引入的烷基会发尘碳链异构现象。 例如: CH3 CH:CH-CH,CI CH CH2CH2CH3 异丙苯(65~69% 正丙苯(35~31% 原因:反应中的活性中间体碳正离子发生重排,产生史稳定的碳下离子后,再进攻苯环 形成产物。 上述反应是山亲电试剂(Br等)进攻富电子的苯环发生的,因此苯环上的取代反应属 于亲电取代反应。 2.历程为亲电取代的有机化学反应 一般苯及其衍生物的取代反应,萘的取代以及具有芳香性的杂环的取代反应,共历程为 亲电取代反应历程。 四、亲核取代反应历程 1.卤代烷的亲核取代反应历程 在卤代烷的取代反应中,负离子(HO、RO、CN、NO3ˉ等)或带未共用电子对的 分子(NH3、NHR、NHR2、NR3等)能进攻卤原子的a-碳发生亲核取代反应。这些试剂的 电子云密度较大,具有较强的亲核性,能提供一对电子与α-碳原子形成新的共价键,所以 又称为亲核试剂。山亲核试剂进攻而引起的取代反应叫做亲核取代反应,用符号S Nucleophilic Substitution)表示。卤代烷的亲核取代反应可用下列通式表示: Ni:+R-8i,- R—CH2—Nu+X: 亲核试剂 卤代烷 取代产物 离去基团

通过动力学和立体化学的研究发现,卤代烷的亲核取代反应可按两种反应历程进行,即 单分子亲核取代(S、1)和双分子亲核取代(S2)反应历程。 (1)单分子亲核取代(SN1) 叔丁基溴在氢氧化钠水溶液中的水解反应是按S、1历程进行的,反应速度仪与淑丁基 溴的浓度成正比,与亲核试剂OH的浓度无关,在动力学上属于一级反应。 v=k[(CH3)3 CBr S1反应分两步完成,第一步是C-Br键断裂生成正碳离子和溴负离子,第二步是正碳 离子和OH厂结合尘成醇。 CH3 CH3 CH: CH3 Br- CH:- CH:- + Br CH3 CH3 CH 渡态1 正碳离了 CH3 CH3 CH+- + OH快 0+ CH; CH:- OH CH CH 过渡态2 第一步中,叔丁基溴在极性溶剂作用下,CBr键逐渐伸长到达过渡态1,然后发生异 裂形成正碳离子中间体。这一步活化能△E,较高,反应较慢。第二步中,正碳离子中间体立 即与亲核试剂OH厂结合,经过渡态2形成醇。这一步活化能AE2较低,反应较快。因为整个 反应速度山第一步决定,所以反应速度仪与叔丁基溴的浓度成正比,而与亲核试剂OH厂的 浓度无关,称为S1取代反应。反应的能量变化图。 [CH),C…Br [(CH)C.-OH] (CHC*+Br +0H (CH,),CBr +OH- (CHi,CoF于Br 反应进程一— S1反应历程中的能量变化 既然S1反应速度山第一步决定,因此在这步中生成的正碳离子中间体越稳定,反应 越容易进行,反应速度越快。所以不同类型卤代烷按S1历程反应的活性次序为: R3C-X>R2CH-X>RCH2-X>CH;-X (2)双分子亲核取代(S2) 溴甲烷在氢氧化钠水溶液中的水解反应是按S2历程进行的,反应速度既与溴甲烷的浓
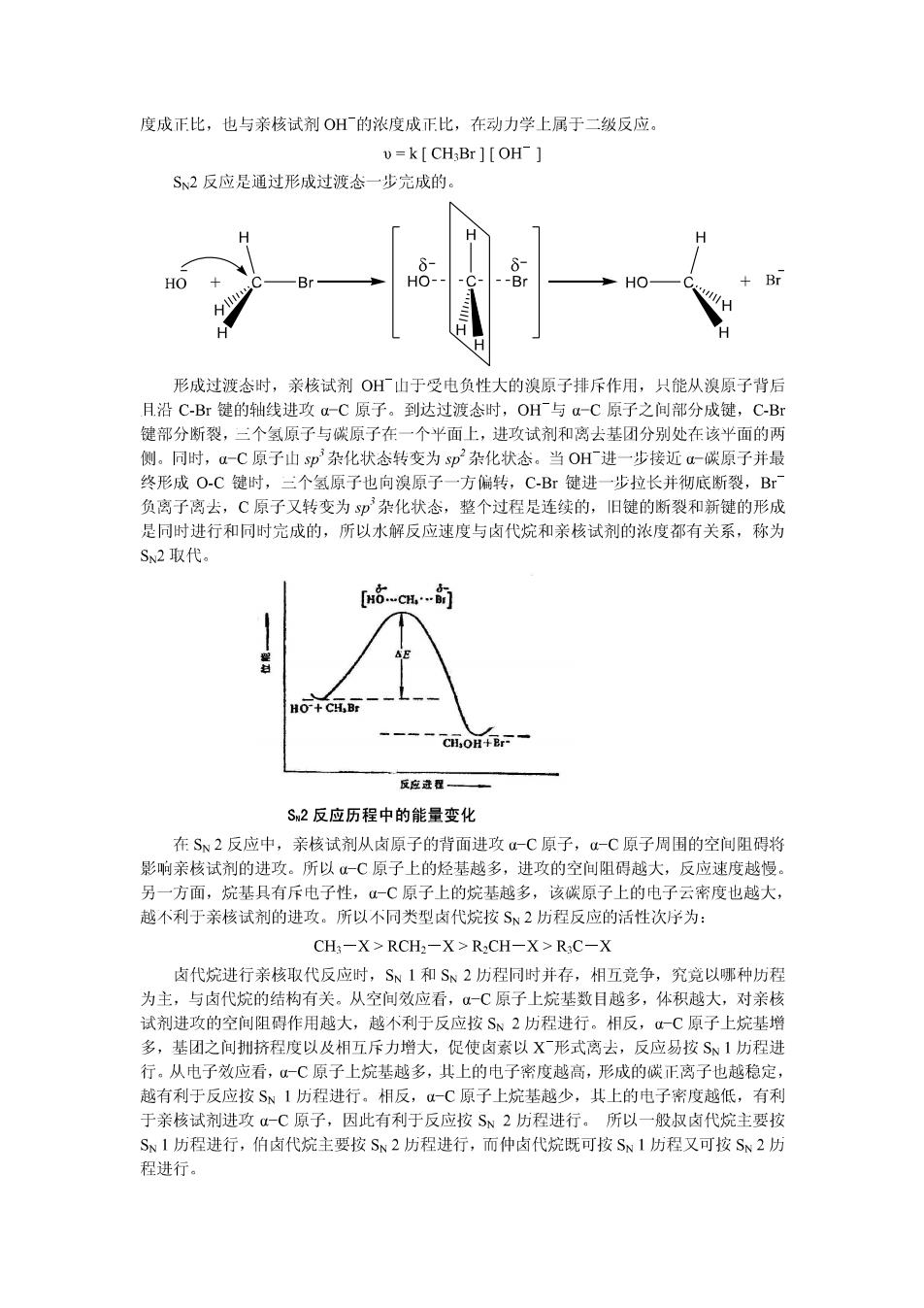
度成正比,也与亲核试剂OH的浓度成正比,在动力学上属于二级反应。 =k[CH3Br ][OH S、2反应是通过形成过渡念一步完成的。 H H δ HO Br HO Br HO Br 形成过渡态时,亲核试剂OH厂山于受电负性大的溴原子排斥作用,只能从溴原子背后 月沿C-Br键的轴线进攻a一C原子。到达过渡念时,OH厂与a-C原子之间部分成键,C-Br 键部分断裂,三个氢原子与碳原子在一个平面上,进攻试剂和离去基团分别处在该平面的两 侧。同时,α-C原子山sp杂化状念转变为sp杂化状态。当OH厂进一步接近a-碳原子并最 终形成O-C键时,三个氢原子也向溴原子一方偏转,C-Br键进一步拉长并彻底断裂,Br 负离子离去,C原子又转变为p杂化状态,整个过程是连续的,旧键的断裂和新键的形成 是同时进行和同时完成的,所以水解反应速度与卤代烷和亲核试剂的浓度都有关系,称为 SN2取代。 HO+CH,Br ----ci,0H+BrF一 反应进程一 Sm2反应历程中的能量变化 在S、2反应中,亲核试剂从卤原子的背面进攻4-C原子,4-C原子周围的空间阻碍将 影响亲核试剂的进攻。所以α一C原子上的烃基越多,进攻的空间阻碍越大,反应速度越慢。 另一方面,烷基具有斥电子性,一C原子上的烷基越多,该碳原子上的电子云密度也越大, 越不利于亲核试剂的进攻。所以不同类型卤代烷按S2历程反应的活性次序为: CH;-X>RCH2-X>R2CH-X>R:C-X 卤代烷进行亲核取代反应时,S、1和S、2历程同时并存,相互竞争,究竞以哪种历程 为主,与卤代烷的结构有关。从空间效应看,一C原子上烷基数目越多,体积越大,对亲核 试剂进攻的空间阻碍作用越大,越不利于反应按S、2历程进行。相反,一C原子上烷基增 多,基团之间拥挤程度以及相互斥力增大,促使卤素以X形式离去,反应易按S、1历程进 行。从电子效应看,一C原子上烷基越多,其上的电子密度越高,形成的碳正离子也越稳定, 越有利于反应按S、1历程进行。相反,一C原子上烷基越少,其上的电子密度越低,有利 于亲核试剂进攻-C原子,因此有利于反应按S、2历程进行。所以一般叔卤代烷主要按 SN1历程进行,伯卤代烷主要按SN2历程进行,而仲卤代烷既可按SN1历程又可按S2历 程进行

另外,卤原子对亲核取代反应速度也有影响。当卤代烷分子中的烷基相同而卤原子不同 时,其反应活性次序为: R-I>R-Br>R-CI 因为无论反应按S、1还是SN2历程进行,都必须断裂C一X键。从C一X键的键能和 卤原子的极化度看,卤原子半径大小次序为I>Br>C1,原子半径越大,可极化性越大,反 应活性越大,因此,C一I键最容易断裂,C一Br键其次,C一C1键较难断裂。 卤代烷发尘的水解、醇解、氰解、氨解等反应都是山亲核试剂首先进攻而引发的取代 反应,因此反应为亲核取代反应。 2.羧酸衍生物的亲核取代反应历程 酸酸衍生物的水解、醇解、氨解都属于亲核取代反应历程,可用下列通式表示: 一- R Nu +HA A=X,0一C-R,OR HNu =H20,R OH,NH3 反应实际上是通过先加成再消除完成的。第一步山亲核试剂Hu进攻酰基碳原子,形 成加成中间产物,第二步脱去一个小分子HA,恢复碳氧双键,最后酰基取代了活泼氢和 Nu结合得到取代产物。所以这些反应又称为HNu的酰基化反应。 显然,酰基碳原子的正电性越强,水、醇、氨等亲核试剂向酰基碳原子的进攻越容易, 反应越快。在羧酸衍生尘物中,基团A有一对未共用电子对,这个电子对可与酰基中的C=O 形成nI共钜体系R二 。基团A的给电子能力顺序为: 0 -CI酸酐>脂>酰胺。另一方面,反应的难易 程度也与离去基团A的碱性有关,A的碱性愈弱愈容易离去。离去基团A的碱性强弱顺序 为:NH2>RO>RCO2>X,即离去的难易顺序为:NH2酸惭 >酯≥酰胺。酰氯和酸酐都是很好的酰基化试剂。 五、亲核加成反应 1.醛酮羰基的亲核加成 山于羰基的极性,碳氧双键加成反应的历程与烯烃碳碳双键加成反应的历程有显著的差 异。碳碳双键上的加成是山亲电试剂进攻而引起的亲电加成,羰基上的加成是山亲核试剂向 电子云密度较低的羰基碳进攻而引起的亲核加成。 羰基的碳氧双键山一个σ-键和一个一键组成,氧原子的电负性强,电子云偏向氧原子 使其带部分负电荷,碳原子带部分正电荷。果试剂的负性部分(亲核试剂)首先进攻羰基 碳原子,则形成氧负离子中间体:果试剂的正性部分(亲电试剂)首先进攻羰基氧原子, 则形成碳正离子中间体

OH >o+cNw→>C-CN>C-C 快 6+6 亲核加成 QH OH NC-CN 亲电加成 两种加成方式哪种占优,主要取决于各自中间体的相对稳定性。碳正离子中,碳原子 外层只有六个电子,又与电负性较强的氧原子相连,所以它是不稳定的中间体。氧负离子 中,氧原子外层有八个电子,是比较稳定的八隅体结构,而且氧原子的电负性大,具有较 强的容纳负电荷的能力,所以是较稳定的中间体。因此从理论上看,羰基与氢氰酸的加成 反应是亲核加成,而不是亲电加成。反应的第一步是CN加到羰基碳上,速度较慢,反应速 度只与CN的浓度有关:第二步是带正电荷的基团加到羰基氧上,速度较快。整个反应的速 度决定于第一步的速度。碱的作用,是将弱亲核试剂HCN转变成为亲核性较强的CN。 实验事实也证明羰基与氢氰酸的加成反应是亲核加成。例丙酮和氢氰酸反应3-4小 时,仪有一半原料起作用:若在反应体系中加入一滴氢氧化御溶液,则反应可在几分钟内完 成:若加入大量酸,则放置几周也不起反应。这种少量碱加速反应,酸抑制反应的事实,说 明反应中首先进攻羰基的试剂一定是C,而不是H。因为氢氰酸是弱酸,在水溶液中存 在1下电离平衡: HCN H+CN 州碱有利于氢氰酸离解,提高C的浓度:加酸使平衡向生成氢氰酸的方向移动,降低CN 的浓度。 不同结构的醛、酮对氢氰酸反应的活性有明显差异,这种活性受电子效应和空间效应 两种因素的影响。从电子效应考虑,羰基碳原子上的电子云密度愈低,愈有利于亲核试剂的 进攻,所以羰基碳原子上连接的给电子基团(烃基)愈多,反应愈慢。从空间效应考虑, 羰基碳原子上的空间位阻愈小,愈有利于亲核试剂的进攻,所以羰基碳原子上连接的基团愈 多、体积愈大,反应愈慢。山此可见,电子效应和空间效应对醛、酮的反应活性影响是一致 的,不同结构的醛、酮对氢氰酸的加成反应活性次序大致下: 0 Rc=O>CH,-H>R-&-H>○ C-HCHsCCH3 H ● 8-R>R8-R>8 0 实际上,只有醛、脂肪族甲基酮、八个碳原子以下的环酮小能与氢氰酸反应。 2.历程为亲核加成的有机化学反应 含羰基的醛酮、醌等发尘的加成反应通常为亲核加成反应历程。 六、消除反应历程

1.卤代烃的消除反应 卤代烃发生消除反应时,卤原子是和阝-C原子上的氢形成HX脱去的,这种形式的消除 反应称阝-消除反应。消除反应也有单分子消除(E)和双分子消除(E2)两种反应历程。 (1)单分子消除反应历程与S、1反应一样,E1反应也是分两步进行的。 (CH3)CBr (CH3)3C+Bf CH3 CH3 CH3-C+ OH快→CH2=C k +H2O CH2⊥H、 CH3 v=k[(CH3);CBr] 整个反应的速度取决于第一步中叔丁基溴的浓度,与试剂OH厂的浓度无关,故称为单 分子消除反应历程,用E1表示。 与S1反应历程个同,E1历程的第二步中OH厂不是进攻碳正离子生成醇,而是夺取碳 正离子的B-H生成稀烃。显然,E1和SN1这两种反应历程是相互竞争、相互伴随发尘的。 例,在25℃时,叔丁基溴在乙醇溶液中反应得到81%的取代产物和19%的消除产物: (CHa)CBr CzHsOH -250C-(CH3)sC-OCzHs +(CHa)C=CH2 81% 19% 从E1反应历程可以看出,不同卤代烷的反应活性次序和SN1相同,即: R3C-X>R2CH-X>RCH2-X (2)双分子消除反应历程E2和S、2也很相似,旧键的断裂和新键的形成同时进行, 整个反应经过一个过渡念。 CH2-Br+OH- CH3-CCH2…B CH3-CH=CH2 +Br +H2O H…OH =k [CH3CH2CH2Br][OH 整个反应速度既与卤代烷的浓度成正比,也与碱的浓度成正比,故称为双分子消除反应 历程,用E2表示。 与S、2反应历程不同,E2历程中OH厂不是进攻a-C原子生成醇,而是夺取B一H原子 生成烯烃。显然,E2与S、2这两种反应历程也是相互竞争、相互伴随发生的。例: (CH)CHCH.BrCHCCH+ROCH:CH(CH 60% 40% 当一碳原子上的烷基数目增加,意味着空间位阻加大和阝-H原子增多,因此不利于亲 核试剂进攻一碳原子,而有利于碱进攻-氢原子,因而有利于E2反应。所以在E2反应中, 不同卤代烷的反应活性次序和E1相同,即: R3C-X>R2CH-X>R-CH2-X (3)取代反应和消除反应的竞争山于亲核试剂(如OH、RO、CN一等)本身也是 碱,所以卤代烷发生亲核取代反应的同时也可能发生消除反应,而月每种反应都可能按单分