
含氨有机化合物的化学性质摘要 §1硝基化合物 一、概述 硝基化合物山于具有较强的极性,因此硝基化合物的熔点、沸点比相应的卤代烃高,多 为高沸点的液体或固体。多硝基化合物具有爆炸性。液念的硝基化合物是许多有机化合物的 优良溶剂,但硝基化合物有毒,它的蒸气能透过皮肤使人中毒,因此应尽量避免使用硝基化 合物做溶剂。 二、还原反应 硝基容易被还原,尤其是直接连在芳环上的硝基,还原产物随还原介质的不同而有所不 同。硝基苯在酸性条件下,可用铁等金属还原为芳香族伯胺。 Fe+HCI NH §2胺 一、概述 与氨相似,氨基中的氮原子上含有一对未共用电子对,有与其它原子共享这对电子的倾 向,所以胺具有碱性和亲核性。在芳香胺中,山于未共用电子对与苯环π键发生部分重叠, 使N原子的sp轨道的未成键电子对的p轨道性质增加,N原子山p杂化趋向于sp杂化。 因此,这对未共用电子对与芳环的T电子可以形成广π共轭体系,使芳香胺的碱性和亲核 性都有明显的减弱。另外,芳香胺中的这种口π共轭体系使芳环的电子云密度增大,因此 芳香胺在芳环上容易发生亲电取代反应。 二、烷基化反应 卤代烃可以与氨作用生成胺,胺作为亲核试剂又可以继续与卤代烃发生亲核取代反应, 结果得到仲胺、叔胺,直全生成季铵盐。 NH+RX RNH,+HX RNH2+RX- RNH+HX RNH+RX RN+HX R3N+RX (R4N)X 季铵盐是强酸强碱盐,不能与碱作用尘成季铵碱。若将它的水溶液与氢氧化银作用,因 生成卤化银沉淀,则可转变为季铵碱。 RANX+AgOH RNOH+AgX↓ 胺与卤代芳香烃在一般条件下不发生反应。 三、酰基化反应 伯胺和仲胺作为亲核试剂,可以与酰卤、酸酐和酯反应,生成酰胺

0 0 RNH2+RC—X RNH—C-R'+HX 0 0 R2NH+RC—X R2N—C-R+HX (X=肉素、O0CR、OR) 叔胺的氮原子上没有氢原子,不能进行酰基化反应。 除甲酰胺外,其它酰胺在常温下大多是具有一定熔点的固体,它们在酸或碱的水溶液中 加热易水解生成原来的胺。因此利用酰基化反应,不但可以分离、提纯胺,还可以通过测定 酰胺的熔点来鉴定胺。 酰胺在酸或碱的作用下可水解除去酰基,因此在有机合成中常利用酰基化反应来保护 氨基。例如,要对苯胺进行硝化时,为防止苯胺的氧化,可先对苯胺进行酰基化,把氨基“保 护”起来再硝化,待苯环上导入硝基后,再水解除去酰基,可得到对硝基苯胺。 NH2 NHOCCH3 NHOCCH NH2 HNO. H2O CHCOCI OH- NO2 四、磺酰化反应 在氢氧化钠存在下,伯、仲胺能与苯磺酰氯或对甲苯磺酰氯反应生成磺酰胺。叔胺氮 原子上无氢原子,不能发生磺酰化反应。磺酰化反应又称兴斯堡(Hinsberg).反应, NaOH RNH2 ArSO2Cl ArSO2NHR- [ArSO2N R INa' (水溶性盐) R2NH ArSO2C1 (不溶于逆碱) RiN Ar-SO,Cl 。不反应 伯胺生成的磺酰胺中,氮原子上还有一个氢原子,山于受到磺酰基强吸电子诱导效应的 影响而显酸性,可溶于氢氧化钠溶液生成盐。仲胺生成的磺酰胺中,氮原子上没有氢原子, 不能溶于氢氧化钠溶液而呈固体析出。叔胺不发生磺酰化反应,也不溶于氢氧化钠溶液而出 现分层现象。因此,利用兴斯堡反应可以鉴别或分离伯、仲、叔胺。例如:将三种胺的混合 物与对甲苯磺酰氯的碱性溶液反应后再进行蒸馏,因叔胺个反应,先被蒸出:将剩余液体过 滤,固体为仲胺的磺酰胺,加酸水解后可得到仲胺:滤液酸化后,水解得到伯胺。 五、与亚硝酸反应 不同的胺与亚硝酸反应,产物各不相同。山于亚硝酸不稳定,在反应中实际使用的是亚 硝酸钠与盐酸的混合物。 NaNO2+HC1 HNO2 NaCl 脂肪族伯胺与亚硝酸反应,尘成醇、烯烃、卤代烃等混合物,在合成上没有价值。但 放出的氮气是定量的,可用于氨基的定量分析。 RNH2 NaNO2+HCl- 醇、烯、卤代烃等混合物+↑
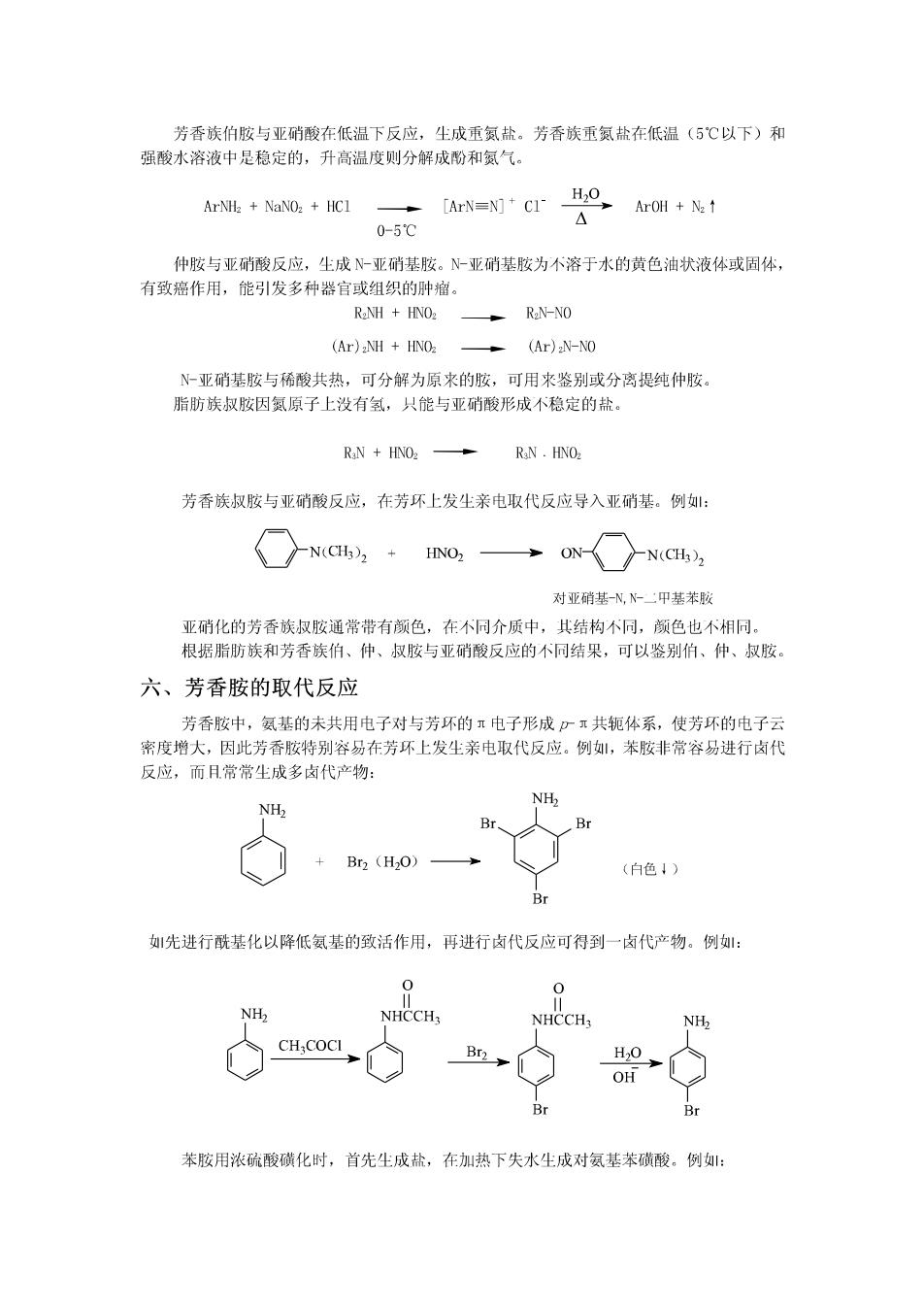
芳香族伯胺与亚硝酸在低温下反应,生成重氮盐。芳香族重氨盐在低温(5℃以下)和 强酸水溶液中是稳定的,升高温度则分解成酚和氨气。 ArNH2 NaNO2+HC1 [ArN=N]CI-H2o ArOH+N2↑ 0-5℃ 仲胺与亚硝酸反应,生成N-亚硝基胺。N-亚硝基胺为不溶于水的黄色油状液体或固体, 有致癌作用,能引发多种器官或组织的肿瘤。 R2NH HNO2 R2N-NO (Ar)2NH HNO2 (Ar)2N-NO N-亚硝基胺与稀酸共热,可分解为原来的胺,可用来鉴别或分离提纯仲胺。 脂肪族叔按因氮原子上没有氢,只能与亚硝酸形成不稳定的盐。 RaN HNO2 RaN HNOz 芳香族叔胺与亚硝酸反应,在芳环上发生亲电取代反应导入亚硝基。例: N(CH3),HNO2 ON N(CH3) 对亚硝基-N,N甲基苯胺 亚硝化的芳香族叔胺通常带有颜色,在不同介质中,其结构不同,颜色也不相同。 根据脂肪族和芳香族伯、仲、叔胺与亚硝酸反应的不同结果,可以鉴别伯、仲、叔胺。 六、芳香胺的取代反应 芳香胺中,氨基的未共用电子对与芳环的π电子形成少π共轭体系,使芳环的电子云 密度增大,因此芳香胺特别容易在芳环上发生亲电取代反应。例,苯胺非常容易进行卤代 反应,而且常常尘成多卤代产物: NHz NH> Br Br2(H2O) (白色1) Br 先进行酰基化以降低氨基的致活作用,再进行卤代反应可得到一卤代产物。例: 0 O NH2 NHCCH3 NHCCH3 NH2 CH:COCI Br H,O OH Br 苯胺用浓硫酸磺化时,首先生成盐,在加热下失水生成对氨基苯磺酸。例:
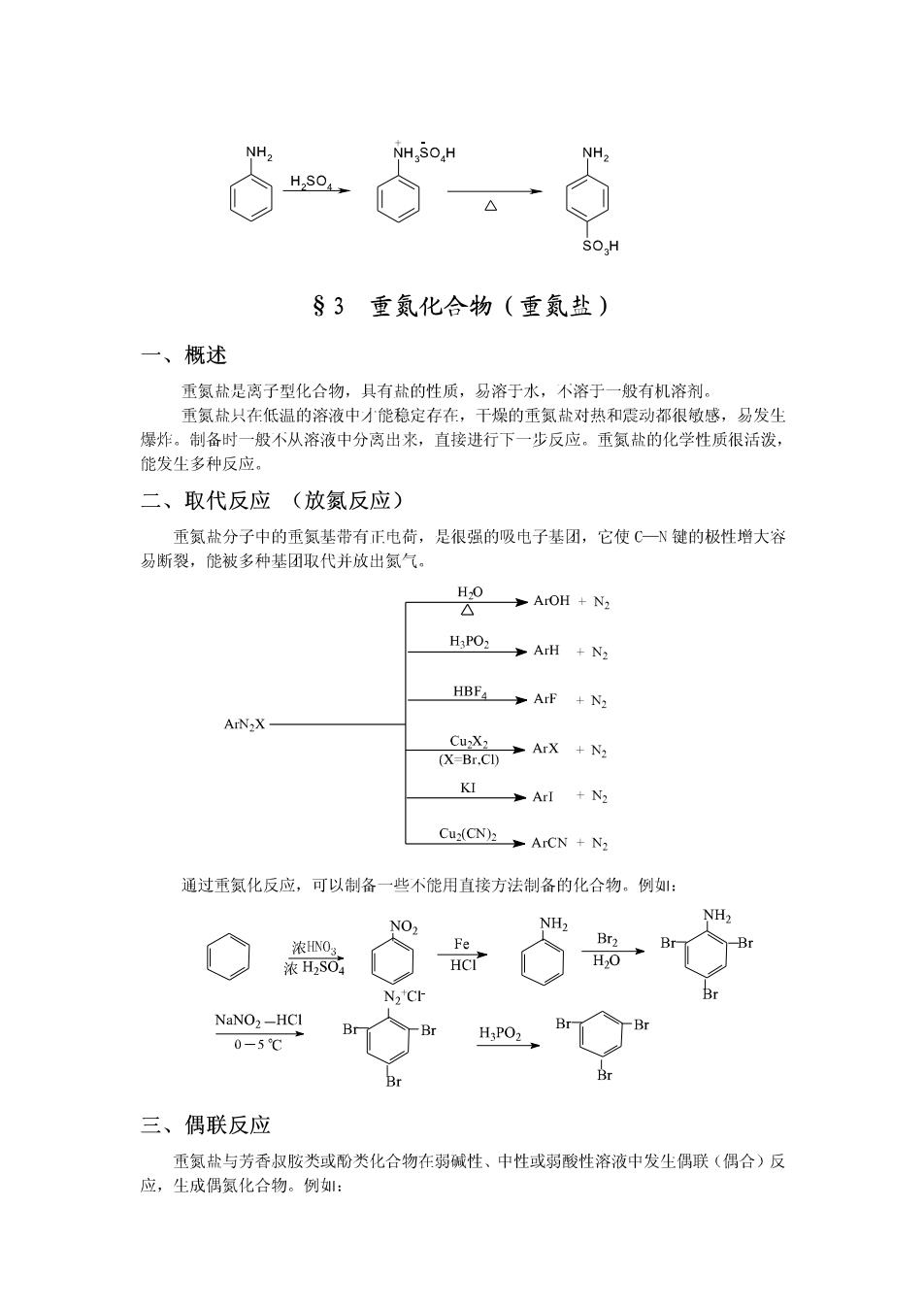
NH2 NH SOH Hs04, SO H §3重氨化合物(重氨盐) 一、概述 重氮盐是离子型化合物,具有盐的性质,易溶于水,不溶于一般有机溶剂。 重氮盐只在低温的溶液中才能稳定存在,干燥的重氮盐对热和震动都很敏感,易发生 爆炸。制备时一般不从溶液中分离出来,直接进行下一步反应。重氮盐的化学性质很活泼, 能发生多种反应。 二、取代反应(放氮反应) 重氮盐分子中的重氮基带有正电荷,是很强的吸电子基团,它使C一N键的极性增大容 易断裂,能被多种基团取代并放出氮气。 H2O △ ArOH N2 HPO> >ArH +N2 HBF4>ArF +N2 ArN2X CuX2 (X-Br.Cl) 多ArX+2 KI ArI N2 Cu(CN2→ArCN+N, 通过重氮化反应,可以制备一些不能用直接方法制备的化合物。例: NH2 NH2 NO? 浓HNO3 Fe Br2 Br 浓H2SO HCI H2O NaNO2-HCI Br Br H:PO2 0-5℃ 三、偶联反应 重氮盐与芳香叔胺类或酚类化合物在弱碱性、中性或弱酸性溶液中发生偶联(偶合)反 应,生成偶氮化合物。例:
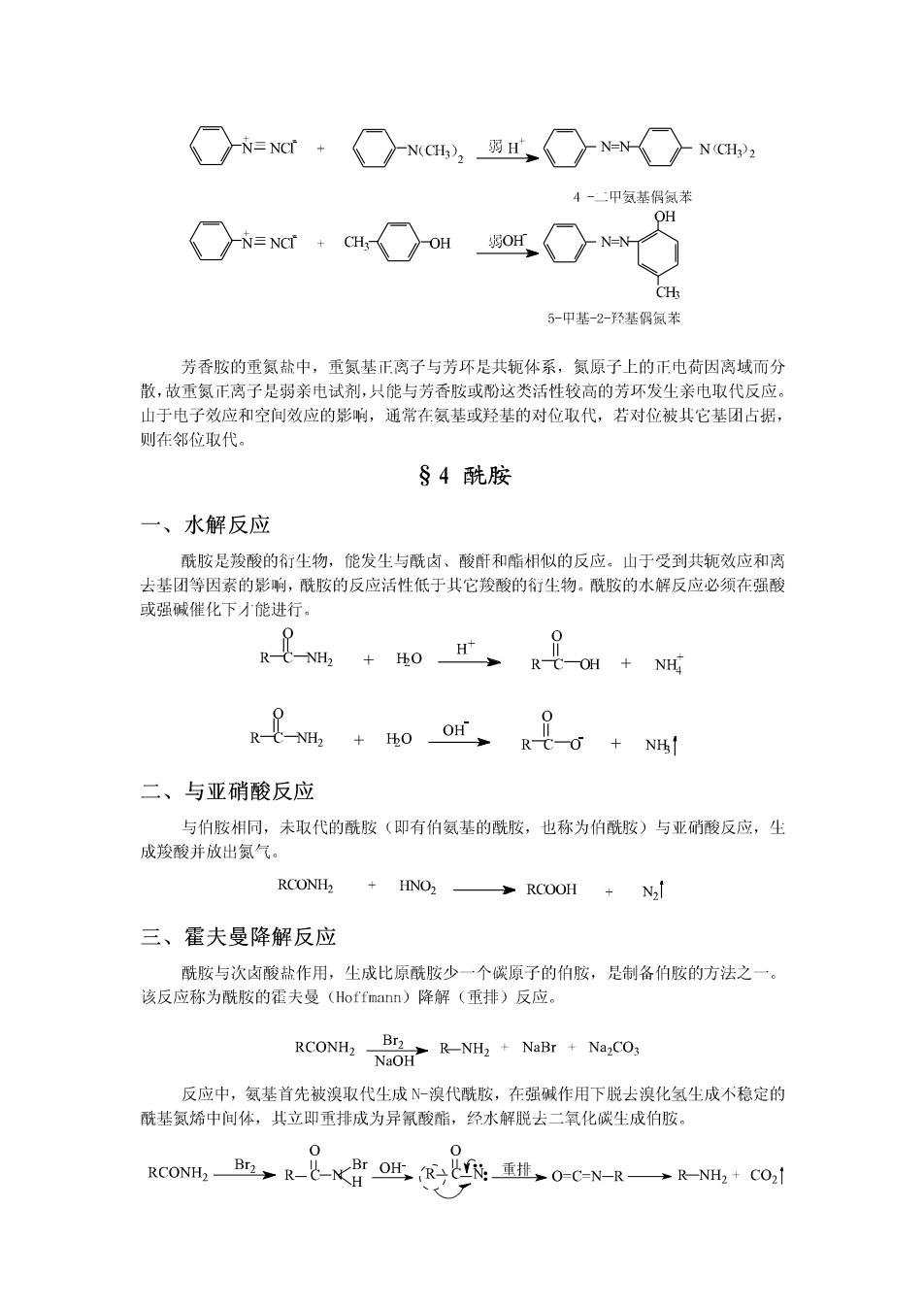
N=NCT+ N(CH2弱 N(CH?2 4-:甲氨基偶氮苯 OH N≡Ncr+CH OH 弱OH H 5-甲基-2-径基偶氮苯 芳香胺的重氮盐中,重氮基正离子与芳环是共轭体系,氮原子上的正电荷因离域而分 散,故重氨正离子是弱亲电试剂,只能与芳香胺或酚这类活性较高的芳环发生亲电取代反应。 山于电子效应和空间效应的影响,通常在氨基或羟基的对位取代,若对位被共它基团占据, 则在邻位取代。 §4酰胺 一、水解反应 酰胺是羧酸的衍生物,能发尘与酰卤、酸断和脂相似的反应。山于受到共轭效应和离 去基团等因素的影响,酰胺的反应活性低于其它羧酸的衍尘物。酰胺的水解反应必须在强酸 或强碱催化下才能进行。 t+o R-C-OH NH +40or、R 二、与亚硝酸反应 与伯胺相同,未取代的酰胺(即有伯氨基的酰胺,也称为伯酰胺)与亚硝酸反应,尘 成羧酸并放出氮气。 RCONH, 多RCOOH+ N2l 三、霍夫曼降解反应 酰胺与次卤酸盐作用,生成比原酰胺少一个碳原子的伯胺,是制备伯胺的方法之一。 该反应称为酰胺的霍夫曼(Hoffmann)降解(重排)反应。 RCONH2 NO R-NH2 NaBr NazCO; 反应中,氨基首先被溴取代生成N-溴代酰胺,在强碱作用下脱去溴化氢生成不稳定的 酰基氮烯中间体,其立即重排成为异氰酸酯,经水解脱去二氧化碳生成伯胺。 0 RCONHa,B,R-北-OH,Ry袋:重挂0C=N-R一→RNH,+CO,1

§5氨基酸 一、概述 氨基酸分子中既含有氨基又含有羧基,因此它具有羧酸和胺类化合物的性质:同时,山 于氨基与羧基之间相互影响及分子中R-基团的某些特殊结构,又显示出一些特殊的性质。 二、氨基酸的两性性质和等电点 氨基酸分子中同时含有羧基(-C0OH)和氨基(-NH2),不仪能与强碱或强酸反应生成盐, 而月还可在分子内形成内盐。 0 0 RCHCOH =±RCHCO NH2 +NH; 内盐(得极离了) 氨基酸内盐分子是既带有正电荷又带有负电荷的离子,称为两性离子或偶极离子。固体 氨基酸以偶极离子形式存在,静电引力大,具有很高的熔点,可溶于水而难溶于有机溶剂。 氨基酸分子是偶极离子,在酸性溶液中它的羧基负离子可接受质子,发生碱式电离带正 电荷:而在碱性溶液中铵根正离子给出质子,发尘酸式电离带负电荷。偶极离子加酸和加训碱 时引起的变化,可用下式表示: 0 0 0 RCHCOH 、OH RCHCO、OH RCHCO +NHg H +NH3 H NH2 正离了 侣极离了 负离了 pHpI 因此,在不同的H值中,氨基酸能以正离子、负离子及偶极离子二种不同形式存在。 果把氨基酸溶液置于电场中,它的正离子会向阴极移动,负离子则会向阳极移动。当调节 溶液的H值,使氨基酸以偶极离子形式存在时,它在电场中既不向阴极移动,也不向阳极 移动,此时溶液的pH值称为该氨基酸的等电点,通常用符号pI表示。当调节溶液的pH值 大于某氨基酸的等电点时,该氨基酸主要以负离子形式存在,在电场中移向阳极:当调节溶 液的pH值小于某氨基酸的等电点时,该氨基酸主要以正离子形式存在,在电场中移向阴极。 氨基酸在等电点时溶解度最小,最容易沉淀,因此可以通过调节溶液p州值达到等电点 来分离氨基酸混合物:也可以利用在同一p州值的溶液中,各种氨基酸所带净电荷不同,它 们在电场中移动的状况不同和对离子交换剂的吸附作用不同的特点,通过电泳法或离子交换 层析法从混合物中分离各种氨基酸。 三、氨基酸中氨基的反应 (1)与亚硝酸反应大多数氨基酸中含有伯氨基,可以定量与亚硝酸反应,生成á-羟基 酸,并放氨气

R-CH-COOH+HNO2一→R-CH-COOH+H0+N2↑ NH2 OH 该反应定量进行,从释放出的氮气的体积可计算分子中氨基的含量。这个方法称为范 斯莱克(Van Slyke)氨基测定法,可用于氨基酸定量和蛋白质水解程度的测定。 (2)与甲醛反应氨基酸分子中的氨基能作为亲核试剂进攻甲醛的羰基,生成(N,N- 二羟甲基)氨基酸。 R-CH-COOH 2HCHO R-CH-COOH NH2 HOH2C-N-CH2OH 在(N,N二羟甲基)氨基酸中,山于羟基的吸电子诱导效应,降低了氨基氮原子的电子 云密度,削弱了氮原子结合质子的能力,使氨基的碱性削弱或消失,这样就可以用标准碱液 来滴定氨基酸的羧基,用于氨基酸含量的测定。这种方法称为氨基酸的甲醛滴定法。 (3)与2,4-二硝基氟苯反应氨基酸能与2,4-二硝基氟苯(DNFB)反应生成N-(2,4 二硝基苯基)氨基酸,简称N-DNP-氨基酸。这个化合物显黄色,可+用于氨基酸的比色测定。 英国科学家桑格尔(Sanger)首先用这个反应来标记多肽或蛋白质的N-端氨基酸,再将队 链水解,经层析检测,就可识别多肽或蛋白质的、-端氨基酸。 F+HN-CHCOOH弱臧 O2N- NH-CHCOOH +HF R R NO2 NO2 N-DNP-氨恭酸(黄色) 四、氨基酸中羧基的反应 (1)与醇反应氨基酸在无水乙醇中通入干燥氯化氢,加热回流时生成氨基酸酯。 0 0 R-CH-C-oH+CL-OH于HC☒ R-CH-C-0-C2Hs H20 NHa NH2 ā-氨基酸酯在醇溶液中又可与氨反应,生成氨基酸酰胺。 R-CH-C-OCHs+NH一→R-CH-CNH2+C2ls-OH H NHa 这是生物体内以谷氨酰胺和天冬酰胺形式储存氮素的一种主要方式。 (2)脱羧反应将氨基酸缓缓加热或在高沸点溶剂中回流,可以发生脱羧反应生成胺。 生物体内的脱羧酶也能催化氨基酸的脱羧反应,这是蛋白质腐败发臭的主要原因。例赖氨 酸脱羧生成1,5-戊二胺(尸胺)。 HN-CH (CH)-CH-COOHHN-(CH)-NI N 戊胺()胺)
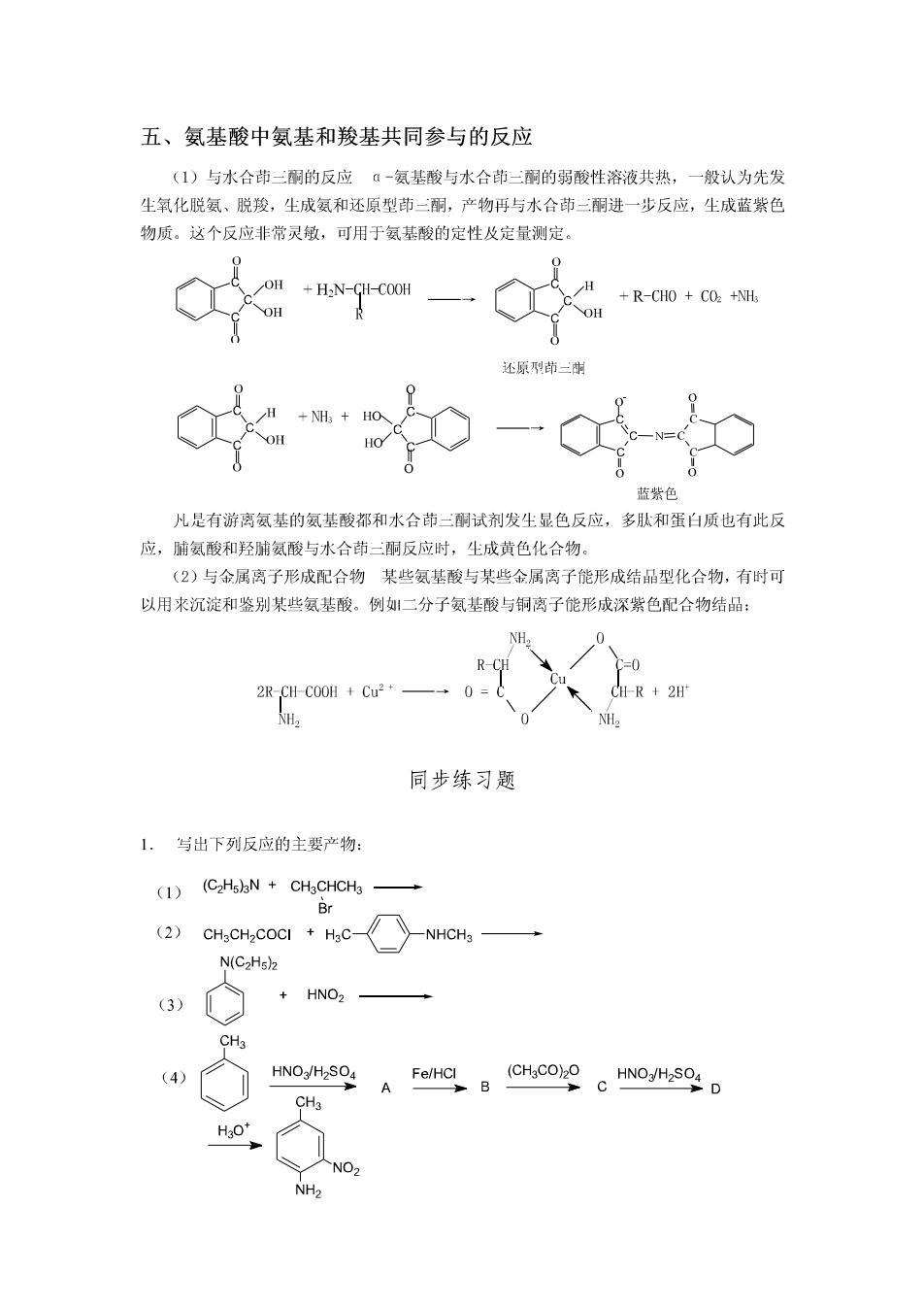
五、氨基酸中氨基和羧基共同参与的反应 (1)与水合茚二酮的反应α-氨基酸与水合茚一酮的弱酸性溶液共热,一般认为先发 尘氧化脱氨、脱羧,生成氨和还原型茚三酮,产物再与水合茚二酮进一步反应,生成蓝紫色 物质。这个反应非常灵敏,可用于氨基酸的定性及定量测定。 OH +HN-CH-COOH +R-CHO COz +NHs 还原刚茚三步 +NHs HO HO 蓝紫色 凡是有游离氨基的氨基酸都和水合茚三酮试剂发生显色反应,多耿和蛋白质也有此反 应,脯氨酸和羟脯氨酸与水合茚二酮反应时,生成黄色化合物。 (2)与金属离子形成配合物某些氨基酸与某些金属离子能形成结品型化合物,有时可 以用来沉淀和鉴别某些氨基酸。例如!二分子氨基酸与铜离子能形成深紫色配合物结品: NH. 2R-CH-COOH Cu2* 1-R+2H NH2 同步练习题 1.与出下列反应的主要产物: (1) (C2H5)3N CH3CHCH3 Br (2) CH3CH2COCI HaC- -NHCH3 N(C2Hs)2 (3) HNO2 CH3 (4 HNO3/H2SO4 Fe/HCI (CH3CO)2O HNO3/H2SO4 A B D CH3 H30 NO2 NH2

2.N一甲基苯胺中混有少量苯胺和N,N一二甲苯胺,怎样将N一甲基胺提纯? 3.用化学方法鉴别下列各组化合物: a.邻甲苯胺N一甲基苯胺苯甲酸和邻羟基苯甲酸 b.三甲胺盐酸盐溴化四乙基铵 4.分子式为CHN的A,能溶于稀盐酸。A与亚硝酸在室温下作用放出氮气,并得到几 种有机物,其中一种B能进行碘仿反应。B和浓硫酸共热得到C(CH2),C能使高锰酸御 退色,且反应后的产物是乙酸和2一甲基丙酸。推测A的结构式,并写出推断过程。 5.某化合物分子式为CHON,有旋光性,能分别与NaOH或HC1成盐,并能与醇成 酯,与HNO2作用时放出氮气,与出此化合物的结构式。 6.用简单化学方法鉴别下列各组化合物: a.CH;CHCOOH H2NCH2CH2COOH NH2 NH2 b.苏氨酸丝氨酸 c.乳酸 丙氨酸