
有机化合物的同分异构现象 同分异构是有机物分子之间普遍存在的一种现象,有构造异构和立体异构两种。总结 下: 碳链(碳架)异构 官能团位置异构 构造异构。 官能团异构 互变异构 同分异构 顺反异构 ( 构型异构 立体异构 光学异构(对映异构) 构象异构 本章以立体异构为重点全面讨论一下有机化合物的同分异构现象。 §1构造异构 有机化合物中原子之间的连接方式和次序称为构造,构造异构是指山于有机分子中原子 之间连接次序不同而产生的异构现象。 这甲只简单介绍碳链(碳架)异构的正确书与方法并举例说明几种常见的构造异构现 象。 一、碳链异构(碳胳异构) 以CeH:为例: 1.首先写出最长的直链 CHCH,CH,CH,CH,CH,CH3 2.其次再写出减少一个碳原子的最长碳链 CH.CHCH,CH,CH3 CHCH,CHCH,CH3 CH3 CH3 3.进一步写出减少两个碳原子的最长碳链 CHs CH3 CHCHCHCH3 CH CCH2CH3 CH3 CHa 二、官能团位置异构
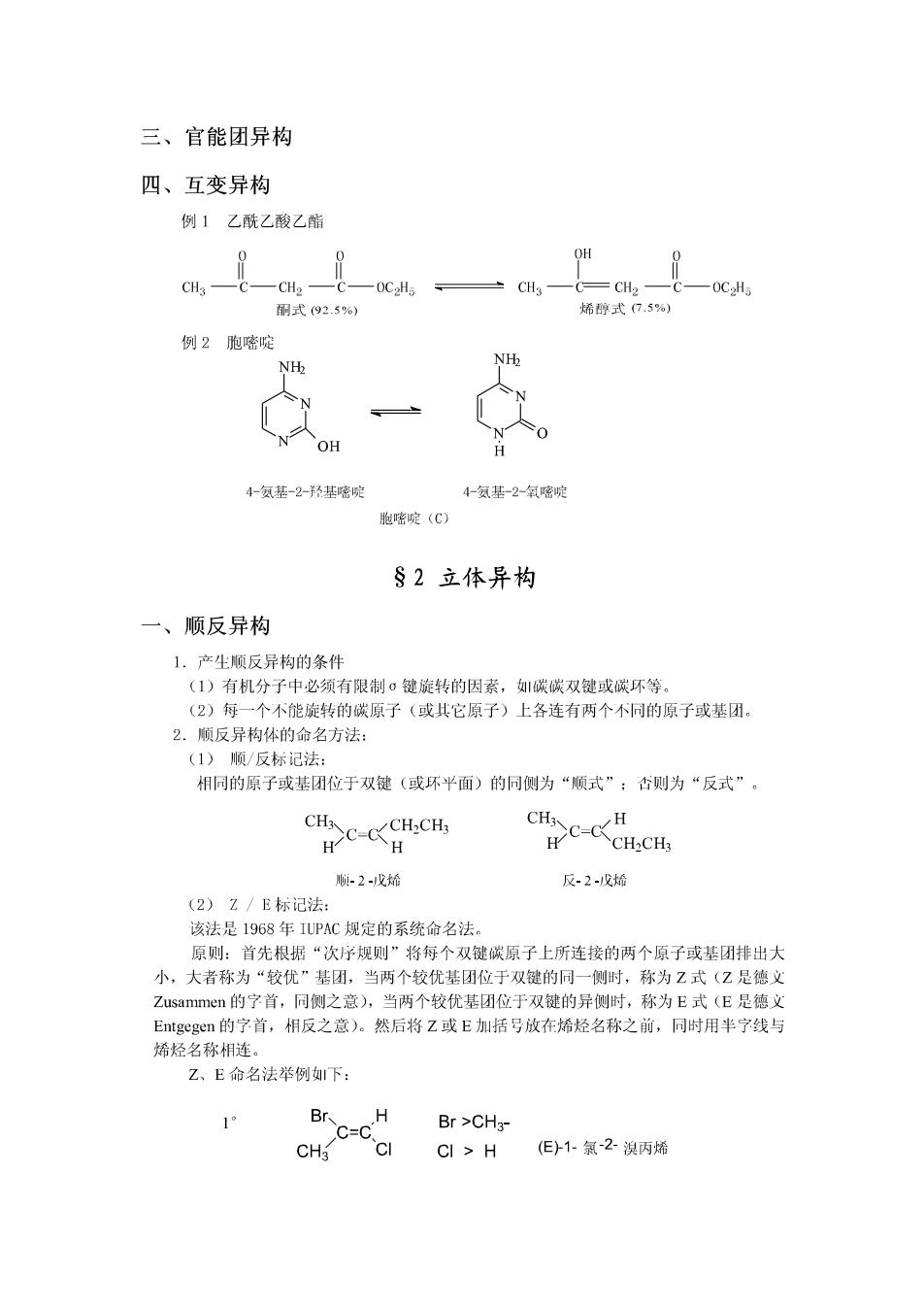
三、官能团异构 四、互变异构 例1乙酰乙酸乙脂 0 0 OH 0 CH3 CH2 -C—0C2H5=CH3—C=CH2— 0C2H5 酮式92.5%) 烯醇式(7.5%) 例2胞嘧啶 NHb NH OH H 4-氨基-2-羟基嘧啶 4-氨基-2-氧嘧啶 胞嘧啶(C) §2立体异构 一、顺反异构 1.产尘顺反异构的条件 (1)有机分子中必须有限制σ键旋转的因素,碳碳双键或碳环等。 (2)每一个不能旋转的碳原子(或共它原子)上各连有两个不同的原子或基团。 2.顺反异构体的命名方法: (1)顺/反标记法: 相同的原子或基团位于双键(或环平面)的同侧为“顺式”:否则为“反式”。 CH3 C-CCH.CH CH、 H H H C-C CH:CHs 顺-2-戊烯 反-2-戊烯 (2)Z/E标记法: 该法是1968年IUPAC规定的系统命名法。 原则:首先根据“次序规则”将每个双键碳原子上所连接的两个原子或基团排出大 小,大者称为“较优”基团,当两个较优基团位于双键的同一侧时,称为Z式(Z是德文 Zusammen的字首,同侧之意),当两个较优基团位于双键的异侧时,称为E式(E是德文 Entgegen的宁首,相反之意)。然后将Z或E加括号放在烯烃名称之前,同时用半宁线与 烯烃名称相连。 Z、E命名法举例下: 1 C-c.c Br >CH3- CHg C>H(E)1-氯-2溴丙烯

CHg。CH2CH2CHs CH3CH2->CH3- 2° C=C CH3CH2 CHCH3 (CH3)2CH->CH3CH2CH2- CH3 (Z)-3-甲基4-异丙基庚烷 3° Br>Cl C=C CI>H (Z)-1,2-二氯-1-溴乙烯 从例3°可以说明,顺反命名和命名Z、E是不能一一对应的。应引起注意。 H CH3 4° H3C、 C=C C=C、 CH2CH3(Z),(Z)2,5-=甲基-2,4快二烯 H 3.环状化合物的顺反异构 环烷烃中山于环的存在限制了C-Co键的自山旋转,果有两个或两个以上的环碳原子 连有不同取代基时,就会得到不同构型,产生顺反异构。例1,2-二甲基环丙烷就有两种 异构体。取代基在环平面同侧的称为顺式,在异侧的称为反式。 顺1-1,2-甲基环丙烷 反-1,2一甲基环丙烷 二、对映异构 1.有机分子的旋光性 当在某一半面上振动的偏振光通过某些物质(如水、乙醇、氯仿)时,其振动平面不 发生改变,而当通过另一些物质(如乳酸、甘油醛、2-氯丁烷)时,其振动平面会发生旋转。 物质的这种能使偏振光的振动平面发尘旋转的性质叫做旋光性,具有旋光性的物质叫做旋光 性物质,也称光学活性物质。因此对映异构也称为旋光异构。 2.对映异构与有机分子结构的关系 (1)手征性与手征性分子 为什么有的物质没有旋光性,而有的物质却有呢?物质的性质是与其结构紧密相关的, 所以,物质的旋光性必定是山于其分子的特殊结构引起的。那么,具有怎样结构的分子才具 有旋光性呢? 实验证明,!果某种分子不能与其镜影完全重叠,这种分子就具有旋光性。分子这种实 物与其镜影不能完全重叠的特殊性质叫做分子的手征性,简称手性,就像人的左右手互为实 物和镜影的关系,但二者不能完全重叠一样。 左右手互为实物和镜影的关系,但二者不能完全重叠

具有手性的分子叫做手征性分子,简称手性分子。要判断一个分子是香具有手性,最直 观和最靠得住的方法,是制作该分子的实物和镜影两个模型,观察它们是否能够完全重叠。 但这种方法不太方便,特别是当分子很大很复杂时史是此。常用的方法是研究分子的对称 性,根据分子的对称性来判断其是杏具有手性。 (2)手性和分子对称性、对称因素 在有机化学中,一般采用对称面和对称中心这两个对称因素来考察分子的对称性。如果 分子中存在对称面或对称中心,这样的分子就没有手性,也不具有旋光性。如!果分子中既无 对称面,又无对称中心,这样的分子就是手性的,也就具有旋光性。 所谓分子的对称面,就是能将分子分成互为实物和镜影关系两部分的一个平面。例如, 在1,1-二溴乙烷分子中,通过H-C一C2三个原子所构成的平面能将分子分成互为实物和镜 影关系的两部分,因此该平面就是它的对称面。又如,E-1-氯-2-溴乙烯分子是一个平面结 构的分子,分子所在的这个平面也能将分子分成互为实物和镜影关系的两“片”,所以该平 面也是它的对称面。 对称而 对称而 C H B Br (a)1,1-二漠乙烷的对称间 (b)E-1-氯-2-溴乙烯的对称前 分子的对称面 山于1,1-二溴乙烷和E-1-氯-2-溴乙烯的分子中都存在对称面,所以它们都是非手性 分子,都没有旋光性。 所谓分子的对称中心,就是假设分子中存在一个点,过该点作任一条直线,若在该点 等距离的两端有相同的原子或基团,则该点就是分子的对称中心。 对称中心 CH COOH COOH CH3 分子的对称中心 山于上述分子中存在对称中心,所以它是非手性分子,没有旋光性。 (3)手性碳原子(不对称性碳原子) 在绝大多数情况下,分子有无手性往往与分子中是否含有手性碳原子有关。所谓手性 碳原子,是指和四个个同的原子或基团连接的碳原子,常用“*”号予以标注,例: CH.CHCH2CH; CH.CHCHCH2CH; ac 一般来说,舍有一个手性碳原子的分子往往是手性的,不含手性碳原子的分子往往是 非手性的。需要指出的是,手性碳原子是引起分子具有手性的普遍因素,但不是唯一的因素。 含有手性碳原子的分子不一定都具有手性,而不含手性碳原子的分子不一定不具有手性。 3.含一个手性碳原子化合物的对映异构 (1)对映体

以乳酸CH:C'HOHCOOH为例来讨论。 乳酸有两种不同构型(空间排列) COOH COOH 透视式 H OH CH3 HaC OH+COOH→CH3 顺时针排列 反时针排列 对映体一互为物体与镜象关系的立体异构体。 含有一个手性碳原子的化合物一定是手性分子,含有两种个同的构型,是互为物体与镜 象关系的立体异构体,称为对映异构体(简称为对映体)。 对映异构体都有旋光性,其中一个是左旋的,一个是右旋的。所以对映异构体又称为 旋光异构体。 (2)对映体之间的异同点 1°物理性质和化学性质一般都相同,比旋光度的数值相等,仪旋光方向相反 2°在手性环境条件下,对映体会表现出某些不同的性质,如反应速度有差异,生理 作用的不同等。 (3)外消旋体 等量的左旋体和右旋体的混合物称为外消旋体,一般用(±)来表示。 外消旋体与对映体的比较(以乳酸为例): 旋光性 物理性质 化学性质 生理作用 外消旋体 不旋光 mp18℃ 基本相同 各自发挥其左右 对映体 旋光 mp53℃ 基本相同 旋体的生理功能 4.构型的表示方法 对映体的构型可用立体结构(楔形式和透视式)和费歇尔(E·Fischer)投影式表示, (1)、立体结构式 COOH COOH COOH H OH ClOH H OH CH3 CH3 CH3 楔形式 透视式 乳酸 优点:形象牛动,·日了然 缺点: 书写不方便 (2)、Fischer投影式 为了便于书写和进行比较,对映体的构型常用费歇尔投影式表示: -COOH COOH COOH- OH Ho H .CH3 CH3 CH3-- 乳酸对映体的费歇尔投影式
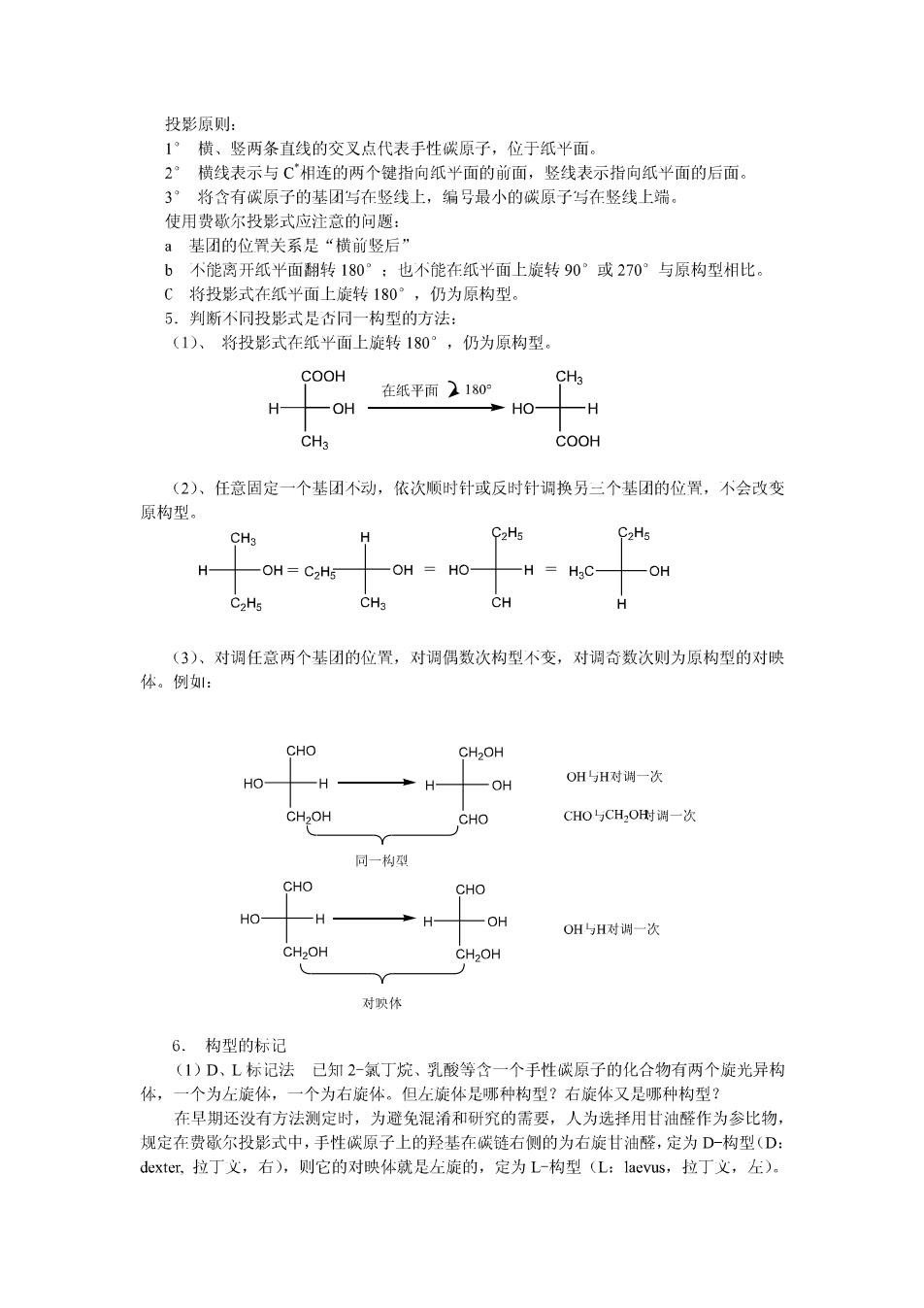
投影原则: 1°横、竖两条直线的交叉点代表手性碳原子,位于纸平面。 2°横线表示与C相连的两个键指向纸半面的前面,竖线表示指向纸平面的后面。 3°将含有碳原子的基团与在竖线上,编号最小的碳原子写在竖线上端。 使用费歇尔投影式应注意的问题: a基团的位置关系是“横前竖后” b不能离开纸平面翻转180°:也不能在纸平面上旋转90°或270°与原构型相比。 C将投影式在纸平面上旋转180°,仍为原构型。 5.判断不同投影式是香同一构型的方法: (1)、将投影式在纸平面上旋转180°,仍为原构型。 COOH CH3 在纸平面)180° H OH HO- H CH3 COOH (2)、任意固定一个基团不动,依次顺时针或反时针调换另三个基团的位置,不会改变 原构型。 CHg H C2H5 C2H5 H OH=C2H5 OH HO OH C2H5 CH3 CH (3)、对调任意两个基团的位置,对调偶数次构型不变,对调奇数次则为原构型的对映 体。例: CHO CH2OH HO H -OH OH与H对调一次 CH>OH CHO CHO与CH2OH时端一次 同一构型 CHO CHO HO -H H -OH OH与H对调一次 CH2OH CH2OH 对映体 6.构型的标记 (1)D、L标记法已知2-氯丁烷、乳酸等含一个手性碳原子的化合物有两个旋光异构 体,一个为左旋体,一个为右旋体。但左旋体是哪种构型?右旋体又是哪种构型? 在早期还没有方法测定时,为避免混淆和研究的需要,人为选择用甘油醛作为参比物, 规定在费歇尔投影式中,手性碳原子上的羟基在碳链右侧的为右旋甘油醛,定为D-构型(D: dexter、拉丁义,右),则它的对映体就是左旋的,定为L-构型(L:laevus,拉丁义,左)

CHO CHO H OH HO H CH2OH CHOH D-(+)一甘油降 1,-(一)一甘汕醛 规定了甘油醛的构型后,其它旋光性物质的构型就可通过一定的化学转变与甘油醛联 系起来。凡可山L-甘油醛转变而成的或是可转变成为L甘油醛的化合物,其构型必定是L 构型的,凡可山D-甘油醛转变而成的或是可转变成为D-甘油醛的化合物,其构型必定是D 构型的。需要注意的是,在转变的过程中不能涉及到手性碳原子上键的断裂,否则就必须知 道转变反应的历程。例,右旋甘油醛通过下列步骤可转变成为左旋甘油酸和左旋乳酸,因 为反应过程中并未涉及手性碳原子上键的断裂,所以生成的左旋甘油酸和左旋乳酸都应是 D-构型的。 CHO COOH COOH [o] CH] OH OH H OH CHOH CH-OH CH3 D一(十)一甘油醛 D一(一)一甘汕骏 D一(一)一乳酸 其它与甘油醛结构类似的化合物可同甘油醛对照,在费歇尔投影式中,手性碳原子上 的两个横键原子或基团中较大的一个在碳链左侧的为L-构型,在右侧的为D-构型。例: CHO CHO COOH COOH H CI HN -H NH2 CH3 CH: CH CH: L一2一氯丙醛 D一2一氯丙醉 1一2一氨基丙酸骏 D一2一氨基丙酸 山于D、L标记法是相对于人为规定的标准物而言的,所以这样标记的构型又叫做相对 构型。1951年毕育特(J.M.Bijvoetetal)等人用X一射线衍射法测定了右旋酒石酸铷御的真 实构型(也称绝对构型),发现其真实构型与其相对构型恰好相同。这意味着人为假定的甘 油醛的相对构型就是其绝对构型,同时也表明用甘油醛作为参比物确定的其它旋光性物质的 相对构型也就是其绝对构型。 D、L标记法一般适用于含一个手性碳原子的化合物,对于含多个手性碳原子的化合物 很不方便,月选择的手性碳原子不同,得到的结果可能不同,容易引起混乱。山于D、L标 记法是以甘油醛作为参比物的,被标记的化合物必须与甘油醛有一定的联系,或者与甘油醛 的结构类似才小行。另外,有时一个化合物可以从两个不同构型的化合物转化而来,此时只好 任意选定D-或L-构型。所以D、L标记法有很大的局限性。鉴于此,IUPAC于1970年建 议采用R、S标记法。但在标记氨基酸和糖类化合物的构型时,仍普遍采用D、L标记法。 如: CHOH CHO CHO CHO 1CH2OH C=0 2C=0 CHO (CHOH)n (CHOH)n HO- H 1半0随 H-4 H CH,OH OH CH.,OH! CH.OH CH.OH 6CH2OH D-(+)-葡萄船 1-(-)-葡萄粘 D-果粘
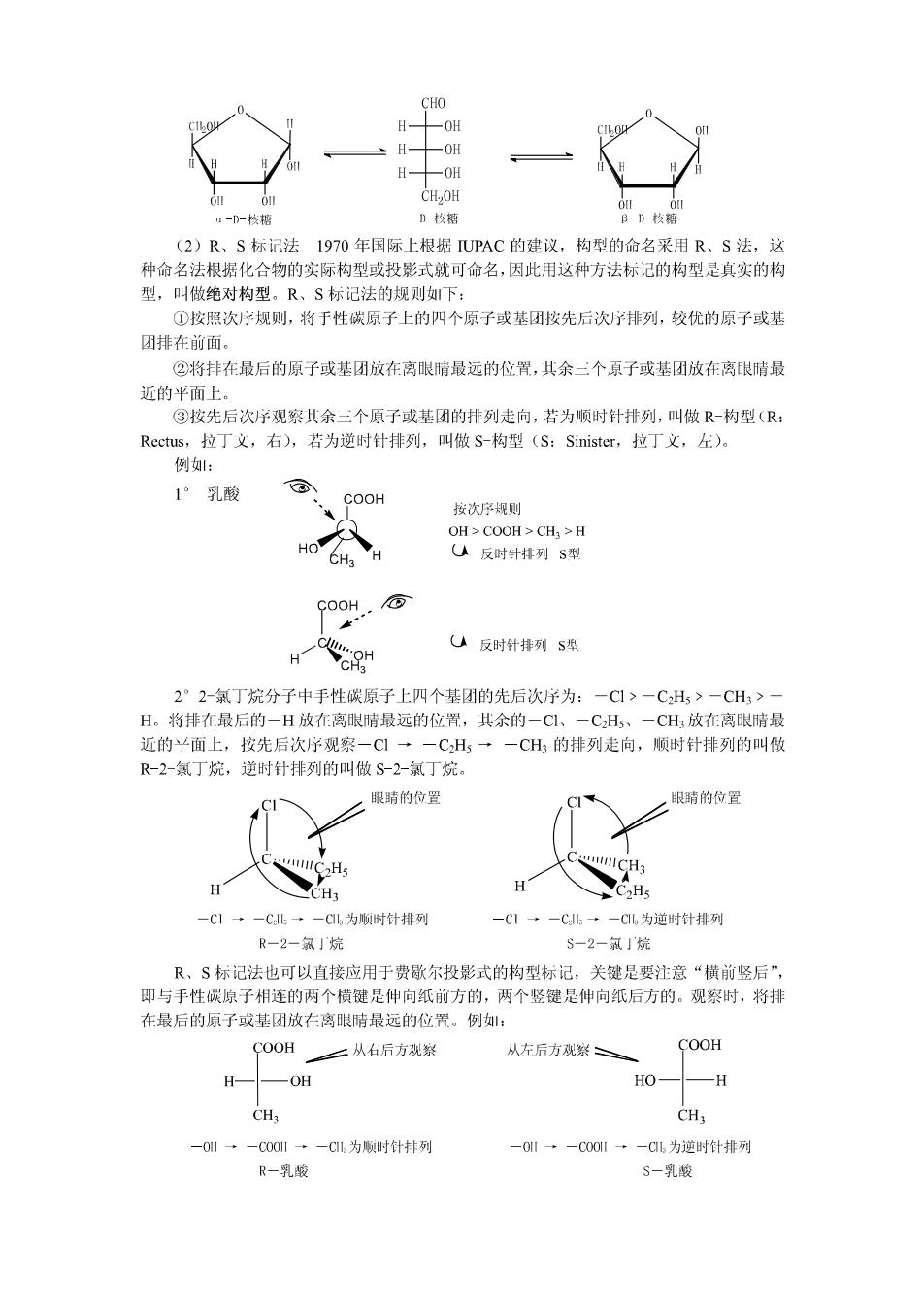
CHO -0H -0H H 0 CH,OH a-D-核糖 D-核糖 B-D-枚糖 (2)R、S标记法1970年国际上根据UPAC的建议,构型的命名采用R、S法,这 种命名法根据化合物的实际构型或投影式就可命名,因此用这种方法标记的构型是真实的构 型,叫做绝对构型。R、S标记法的规则如下: ①按照次序规则,将手性碳原子上的四个原子或基团按先后次序排列,较优的原子或基 团排在前面。 ②将排在最后的原子或基团放在离眼晴最远的位置,其余二个原子或基团放在离眼晴最 近的平面上。 ③按先后次序观察共余三个原子或基团的排列走向,若为顺时针排列,叫做R-构型(: Rectus,拉丁文,右),若为逆时针排列,叫做S-构型(S:Sinister,拉丁文,左)。 例: 1°乳酸 COOH 按次序规则 OH>COOH>CH >H U反时针排列S型 COOH U反时针排列S型 H CH3 2°2-氯丁烷分子中手性碳原子上四个基团的先后次序为:一C1>一CH,>一CH3>一 H。将排在最后的一H放在离眼晴最远的位置,其余的一C1、一CH、一CH3放在离眼晴最 近的平面上,按先后次序观察一C1→一CH一一CH3的排列走向,顺时针排列的叫做 R-2-氯丁烷,逆时针排列的叫做S-2-氯丁烷。 眼睛的位置 眼睛的位置 C Hs CH3 CH +C2H5 C1·一CL→一C为顺时针排列 一C1·一C·一CL为逆时针排列 R一2一氯」烷 S一2一氯」烷 R、S标记法也可以直接应用于费歇尔投影式的构型标记,关键是要注意“横前竖后”, 即与手性碳原子相连的两个横键是仲向纸前方的,两个竖键是伸向纸后方的。观察时,将排 在最后的原子或基团放在离眼晴最远的位置。例: COOH 三从右后方观絮 从东后方观察 COOH H -OH HO- CH CH3 一01·一C00l·一Cl为顺时针排列 一0I·一C0OI→一Cl为逆时针排列 R一乳骏 S一乳酸

因为一对对映体分子中的两个手性碳原子互为镜影,即手性碳原子的构型是相反的, 所以2-氯丁烷或乳酸的一对对映体的构型分别是R-构型和S-构型。 其它实例: ) CH3 基团顺宁 Br- -H Br>C,Hs>CH3>H C2H5 2顺时针排列R型 快速判断Fischer投影式构型的方法: 1°当最小基团位于横线时,若其余三个基团山大→中→小为顺时针方向,则此投影式 的构型为S,反之为R。 2°当最小基团位于竖线时,若其余三个基团山大→中→小为反时针方向,则此投影式 的构型为R,反之为S。 实例: CHO 基团次序OH>CHO>CH,OH Br 基团次序Br>CI>CH>H 最小基团州位丁横线 H 最小基团HD位丁横线 CH3 S构型 CH2OH R-构型 H 米团次序NH2>COOH>CH3>H HaNCOOH 最小基团HD位丁竖线 CH3 R-构型 CI CHs CHa 恭团次序CI>CH2>CH-CH3>CH CI 最小基团(CH)位于竖线 CH(CH3)2 S-构型 值得注意的是,旋光性化合物的构型(R、S或D、L)和其旋光方向(一或十)没有 必然的联系。旋光方向是旋光性化合物固有的性质,是用旋光仪实际测定的结果,而旋光性 化合物的构型是用人为规定的方法确定的。根据化合物的构型能够做出这个化合物的空间模 型,但不经测量不能知道这个化合物的旋光方向。但有一点可以肯定,一对对映体中的一个 是左旋的,另一个必然是右旋的,一个是R-构型,另一个必然是S-构型。 还应强调指出,D、L和R、S是两种不同的构型标记方法,它们之间也没有必然的联 系。R、S标记法是山分子的几何形状按次序规则确定的,它只与分子的手性碳原子上的原 子和基团有关,而D、L标记法则是山分子与参比物相联系而确定的。D一构型或L-构型的 化合物若用R、S标记法来标记,可能是R-构型的,也可能是S-构型的。 另外,R、S标记法有不易出错的优点,但它不能反映出立体异构体之间的构型联系, 尤其是在研究糖类化合物和氨基酸的构型时。 8.含两个手性碳原子化合物的对映异构 从上面的讨论已知,舍一个手性碳原子的化合物有一对对映体,那么含有两个手性碳 原子的化合物有多少个对映异构体呢? (1)含两个不同手性碳原子的化合物 这类化合物中两个手性碳原子所连的四个基团不完全相同。例:

CHs COOH CH3 CH-Br CH-OH CH-OH CH-Br CH-CI CH-C6Hs CH2CH3 COOH CH 2,3-二溴戊烷 2-羟基-3氯丁二酸 3-米基-2-丁醇 (氯代苹果酸) 我们以氯代苹果酸为例来讨论 ①对映异构体的数目 其Fischer投影式如下: COOH COOH COOH COOH H- OH HO -H H -OH HO- H -CI 一H -H COOH COOH COOH COOH (1) 对映体 (2) (3) 对映休 (4) m.p173℃ 173℃ 167℃ 167℃ [a]0 -7.1° +7.1° 9.3、 十9.3 (±) 外消旋体m.p145℃ 外消旋体m.p157℃ 非对映休 含n个不同手性碳原子的化合物,对映体的数目有2·个,外消旋体的数目21个。 ②非对映体 不呈物体与镜象关系的立体异构体叫做非对映体。分子中有两个以上手性中心时,就有 非对映异构现象。 非对映异构体的特征: 1°物理性质不同(熔点、沸点、溶解度等)。 2°比旋光度不同。 3°旋光方向可能相同也可能不同。 4°化学性质相似,但反应速度有差异。 (2)含两个相同手性碳原子的化合物 酒石酸、2,3-二氯丁烷等分子中含有两个相同的手性碳原子。 HOOC-CH-CH-COOH CH3-CH-CH-CH3 OHOH CI CI 同上讨论,酒石酸也可以与出四种对映异构体