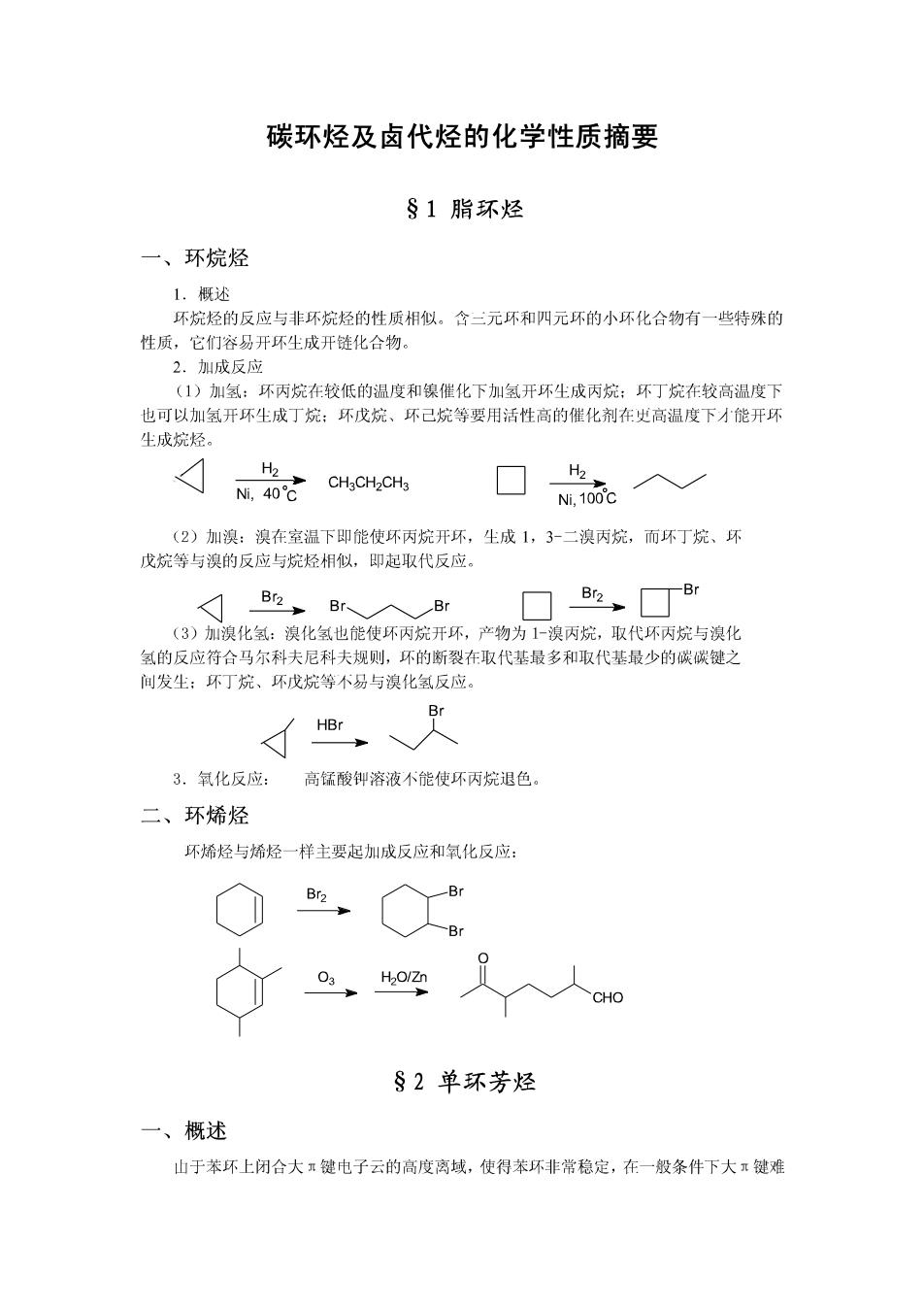
碳环烃及卤代烃的化学性质摘要 §1脂环烃 一、环烷烃 1.概述 环烷烃的反应与非环烷烃的性质相似。含二元环和四元环的小环化合物有一些特殊的 性质,它们容易开环生成开链化合物。 2.则成反应 (1)加氢:环丙烷在较低的温度和镍催化下加氢开环生成丙烷:环丁烷在较高温度下 也可以加氢开环生成丁烷:环戊烷、环己烷等要用活性高的催化剂在史高温度下才能开环 生成烷烃。 H2 H2 Ni,40C CH3CH2CH3 Ni,100'C (2)加溴:溴在室温下即能使环丙烷开环,生成1,3-二溴丙烷,而坏丁烷、环 戊烷等与溴的反应与烷烃相似,即起取代反应。 A B,Br入Br B☐丁Br (3)加溴化氢:溴化氢也能使环丙烷开环,产物为1-溴丙烷,取代环丙烷与溴化 氢的反应符合马尔科夫尼科夫规则,环的断裂在取代基最多和取代基最少的碳碳键之 间发生:环丁烷、环戊烷等不易与溴化氢反应。 Br HBr 3.氧化反应: 高锰酸御溶液不能使环丙烷退色。 二、环烯烃 环烯烃与烯烃一样主要起加成反应和氧化反应: Br2 Br Br 03 H2O/Zn CHO §2单环芳烃 一、概述 山于苯环上闭合大π键电子云的高度离域,使得苯环非常稳定,在一般条件下大π键难

于断裂进行加成和氧化反应:苯环上大π键电子云分布在苯环平面的两侧,流动性大,易引 起亲电试剂的进攻发生取代反应。 苯环虽难于被氧化,但苯环上的烃基侧链山于受苯环上大π键的影响,▣-氢原子变得 很活泼,易发尘氧化反应。同时,ā-氢原子也易发生卤代反应。 苯环上的闭合共轭大π键里然很稳定,但它仍然具有一定的不饱和性。因此,在强烈的 条件下,也可发生某些加成反应。 二、亲电取代反应 苯环上的氢原子可以被多种基团取代,其中以卤代、硝化、磺化和傅氏反应较为重要。 1.取代反应 (1)卤代反应苯与氯、溴在铁或三卤化铁等催化剂存在下,苯环上的氢原子被氯、溴 取代,生成氯苯和溴苯。 Fe或FeBr3 Br255-60C B HBr 溴苯 卤代仪限于氯代和溴代,卤素的反应活性为:Cl2)Br2。 (2)硝化反应 苯与浓硝酸和浓硫酸的混合物共热,苯环上的氢原子被硝基(一NO2) 取代生成硝基苯。 浓H2S04 HNO3 50~60C -NO2 +H2O 硝基苯 硝基苯为浅黄色油状液体,有苦杏仁味,其蒸气有毒。 (3)磺化反应苯与98%的浓硫酸共热,或与发烟硫酸在室温下作用,苯环上的氢原 子被磺酸基(一SOH)取代生成苯磺酸。 H2S04= S03H+H20 苯磺酸 苯磺酸是一种强酸,易溶于水难溶于有机溶剂。有机化合物分子中引入磺酸基后可增加 其水溶性,此性质在合成染料、药物或洗涤剂时经常应用。 磺化反应是可逆反应,苯磺酸通过热的水蒸汽,可以水解脱去磺酸基。 (4)傅瑞德尔-克拉夫茨(Friedel-Crafts)反应(简称傅氏反应) 在无水三氯化铝催化下,苯环上的氢原子被烷基或酰基(RC)取代的反应,叫做傅 氏反应。傅氏反应包括烷基化和酰基化反应 傅氏烷基化反应中,常用的烷基化试剂为卤代烷,有时也用醇、烯等。常用的催化剂 是无水二氯化铝,此外有时还用三氯化铁、三氟化硼等。 无水A1CL3 CHaCH2CI 0~25C产 CH2CH3 HCI 三个碳以上的卤代烷进行烷基化反应时,常伴有异构化(重排)现象发生:
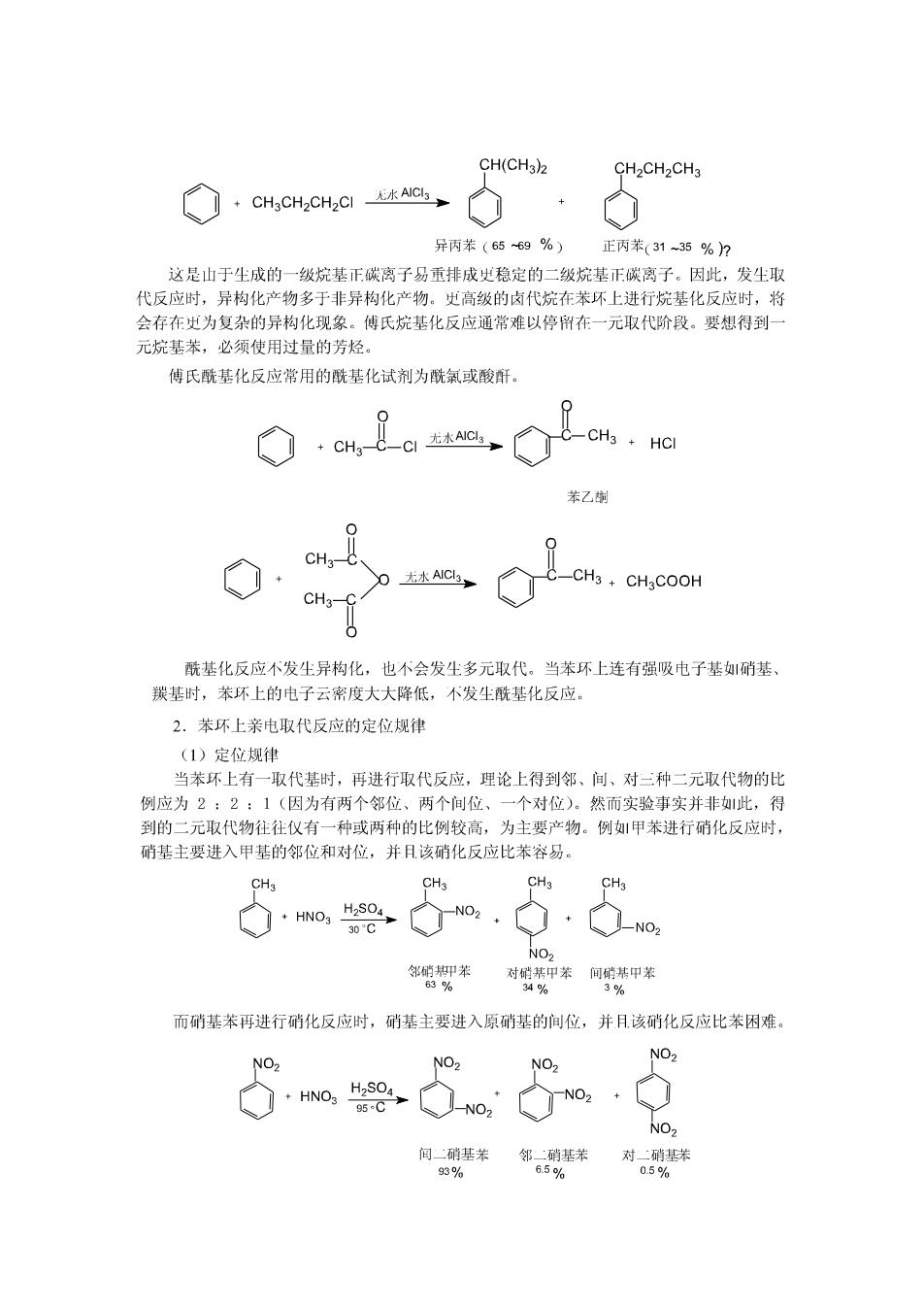
CH(CH3)2 CH2CH2CH3 CH3CH2CH2Cl 无水ANC, 异丙苯(6569%) 正丙苯(31~35% 这是山于生成的一级烷基正碳离子易重排成史稳定的二级烷基正碳离子。因此,发生取 代反应时,异构化产物多于非异构化产物。史高级的卤代烷在苯环上进行烷基化反应时,将 会存在史为复杂的异构化现象。傅氏烷基化反应通常难以停州在一元取代阶段。要想得到一 元烷基苯,必须使用过量的芳烃。 傅氏酰基化反应常用的酰基化试剂为酰氯或酸酐。 无水AIC3 CH3 HCI 苯乙时 CH, 无水AIC CH3 CH3COOH CH 酰基化反应不发生异构化,也不会发生多元取代。当苯环上连有强吸电子基硝基、 羰基时,苯环上的电子云密度大大降低,不发生酰基化反应。 2.苯环上亲电取代反应的定位规律 (1)定位规律 当苯环上有一取代基时,再进行取代反应,理论上得到邻、间、对三种二元取代物的比 例应为2:2:1(因为有两个邻位、两个间位、一个对位)。然而实验事实并非此,得 到的二元取代物往往仪有一种或两种的比例较高,为主要产物。例1甲苯进行硝化反应时, 硝基主要进入甲基的邻位和对位,并且该硝化反应比苯容易。 CH3 CH3 CH HNO3 H2SO4 30C NO2 NO2 邻硝抑苯 对硝基甲苯间硝基甲茶 63% 34% 3% 而硝基苯再进行硝化反应时,硝基主要进入原硝基的间位,并月该硝化反应比苯困难。 NO NO, NO HNO2 H2S04 95C NO 间二硝基苯 邻二硝基苯 对二硝基苯 93% 6.5% 05%

上述实验事实说明,苯环上己有的取代基不仪影响第二个取代基进入苯环的难易,而月 还影响其进入苯环的位置。我们把苯环上原有取代基的这种作用,称为苯环上亲电取代反应 的定位效应,苯环上原有的取代基称为定位基。 (2)两类定位基 根据大量的实验事实,将定位基分为以下两大类: 1°邻、对位定位基这类定位基能使苯环活化,即第二个取代基的进入比苯容易(卤素 除外),第二个取代基主要进入它的邻位和对位。常见的邻、对位定位基(定位能力山强到 弱排列)有: -O、N(CH3)2、NH2、OH、-OCH3、NHCOCH3、-OCOCH3、 -CH3(-R)、一X(Cl、Br、I)等 邻、对位定位基的结构特点是,与苯环直接相连的原子带负电荷,或带有未共用电子对, 或是饱和原子(-CC1,和-CF除外)。 2°间位定位基这类定位基能使苯环钝化,即第二个取代基的进入比苯困难,同时使第 二个取代基主要进入它的间位。常见的间位定位基(定位能力山强到弱排列)有: NH3、N(CH33、NO2、CN、SO3H、CHO、COR、COOH、CONH2等 般讲,间位定位基的结构特点是,与苯环直接相连的原子带正电荷,或以重键与电负 性较强的原子相连接。 3.定位规律的应用 学习定位规律的目的,就在于应用此规律来指导有机合成和生产实践。在尘产实践中, 定位规律的应用主要有以下两个方面: (1)预测反应的主要产物根据定位基的种类,就可以预测出取代基进入的主要位置, 从而得知生成的主要产物是什么。例,应用定位规律,我们就可以判断出下列化合物进行 亲电取代反应时,取代基主要进入箭头所示的位置。 (2)选择合理的合成路线例,以苯为原料合成间硝基氯苯,合理的合成路线应是先 硝化,后氯代。 HNO3 H2SO. Cl2 △ Fe 又例,以甲苯为原料合成间溴苯甲酸, 合理的合成路线应是先氧化,后溴代。 COOH COOH KMnO4 /H Br2 Fe -Br 果苯环上已有两个取代基,再进行亲电取代反应时,第二个取代基进入的主要位置服

从以下定位规则: 果原有的两个取代基定位位置一致,取代基便可按照定位规则进入指定的位置。: CH COOH NO2 NO. 当原有的两个取代基的定位位置发生矛盾时,若原有的两个取代基为同一类(同是邻、 对位定位基,或同是间位定位基),第三个取代基进入的主要位置山定位能力强的来决定 (前面列出的两类定位基,次序排在前的定位能力强)。若原有的两个取代基为不同类, 第二个取代基进入的主要位置山邻、对位定位基来决定。例: OH COOH CH3 CH3 定位能力:OH>CH3 N02>C00H 需要指出的是,用定位规则预测取代基进入的主要位置时,有时还要考虑到空间 位阻的作用。上述间甲基苯磺酸进行亲电取代反应时,山于空间位阻作用,使与甲基和磺 酸基同处于邻位的碳原子上发生亲电取代的几率大大降低。 三、苯同系物侧链的卤代反应 在紫外光照射或高温条件下,苯环侧链上的氢易被卤素(氯或溴)取代。侧链为两个 或两个碳以上的烷基时,卤代反应主要发生在ú-碳原子上。 CH3 CH2CI CHCI2 CCl3 光照 Cl2 Cl2 Cl2 或高温 光照或命温 光烟或高温 氯化等 苯二氯中烷 苯二氯甲烷 CH2CH3 CI-CHCH3 CH2CHCI Cl2 或高温 4-氯代乙苯 B-氯代乙苯 91% 9% 苯环侧链的卤代反应与烷烃的卤代反应一样,属于游离基反应。 若苯的同系物与卤素在铁或三卤化铁存在下作用,则卤代反应发生在苯环上(属于亲 电取代反应),月主要取代侧链邻位和对位上的氢。 CH2CH3 CH2CH3 CH2CH3 Fe Cl2 或FeCl3 C 邻氯乙苯 对氯乙苯
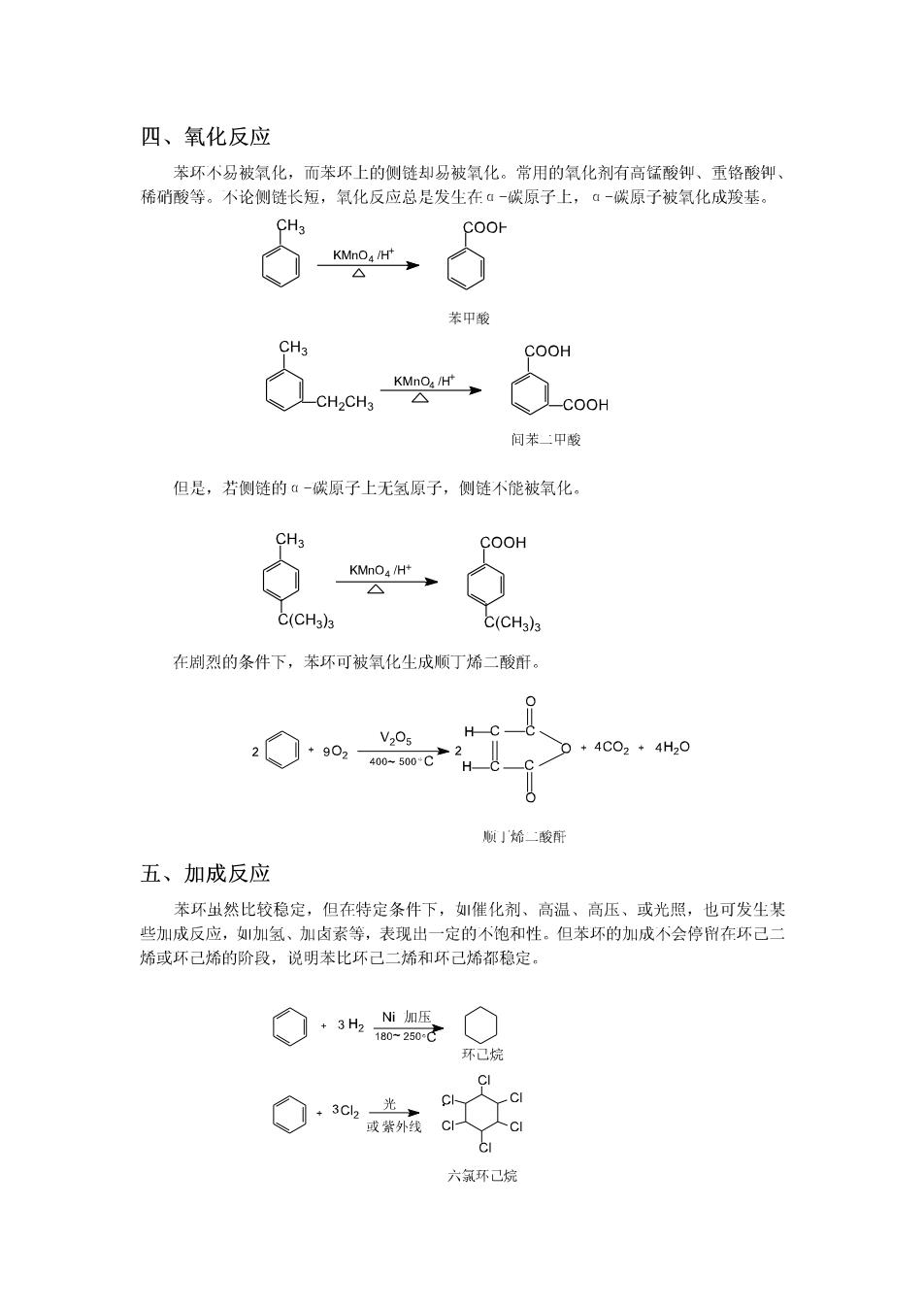
四、氧化反应 苯环不易被氧化,而苯环上的侧链却易被氧化。常用的氧化剂有高锰酸御、重铬酸御、 稀硝酸等。不论侧链长短,氧化反应总是发生在ā-碳原子上,ā一碳原子被氧化成羧基。 CH3 COOH KMnO/H 苯中酸 CH3 COOH KMnO /H CH2CH3 A -COOH 间苯二甲酸 但是,若侧链的a一碳原子上无氢原子,侧链不能被氧化。 CH COOH KMnOa/H+ △ C(CH3)3 C(CH3)3 在制烈的条件下,苯环可被氧化生成顺丁烯二酸酐。 V2Os HC_ 902 400-500C2 +4C02*4H20 顺」烯二酸疵 五、加成反应 苯环虫然比较稳定,但在特定条件下,如催化剂、高温、高压、或光照,也可发尘某 些加成反应,加氢、加卤素等,表现出一定的不饱和性。但苯环的加成不会停在环己二 烯或环己烯的阶段,说明苯比环己二烯和环己烯都稳定。 +3H2 Ni加压 180-250:产 环己烷 3C2 光→ C以 CI 或紫外线 CI 六氯环已烷
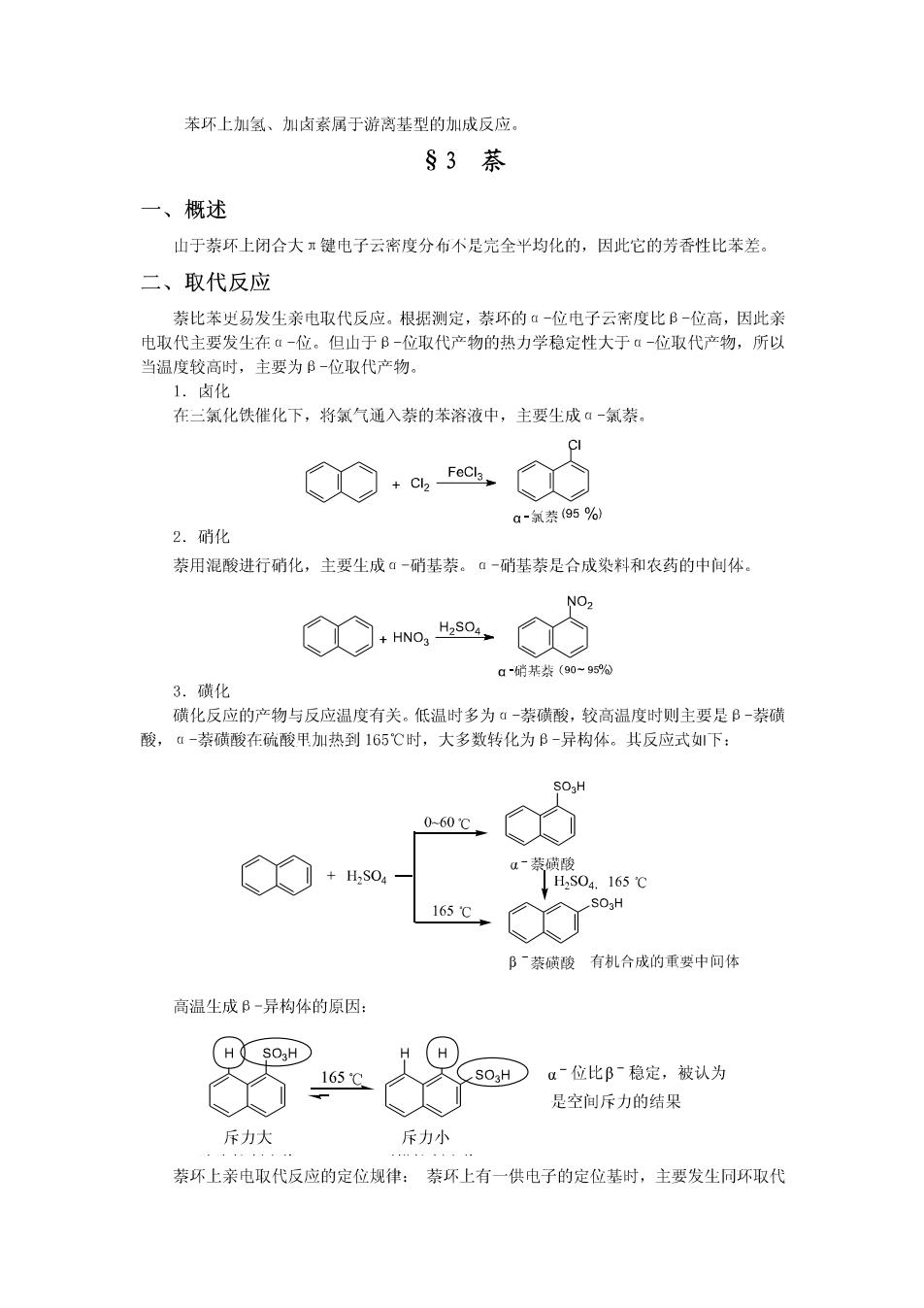
苯环上加氢、加卤素属于游离基型的加成反应。 §3萘 一、概述 山于萘环上闭合大工键电子云密度分布不是完全平均化的,因此它的芳香性比苯差。 二、取代反应 萘比苯史易发生亲电取代反应。根据测定,萘环的α-位电子云密度比B-位高,因此亲 电取代主要发生在α-位。但山于B-位取代产物的热力学稳定性大于α-位取代产物,所以 当温度较高时,主要为B-位取代产物。 1.卤化 在二氯化铁催化下,将氯气通入萘的苯溶液中,主要生成▣-氯萘。 、 FeCl3. a-氯萘(95%) 2.硝化 萘用混酸进行硝化,主要生成α-硝基萘。α-硝基萘是合成染料和农药的中间体。 NO, HNO3 H2S04 a硝某茶(90~956 3.磺化 磺化反应的产物与反应温度有关。低温时多为ú一萘磺酸,较高温度时则主要是B-萘磺 酸,ú-萘磺酸在硫酸甲加热到165℃时,大多数转化为B-异构体。其反应式下: SO2H 0-60℃ a~萘磺酸 +H2SO4 H2S04.165℃ 165℃, B萘磺酸 有机合成的重要中问体 高温生成B一异构体的原因: H SO3H」 H 165℃ SO3H α位比阝稳定,被认为 是空间斥力的结果 斥力大 斥力小 萘环上亲电取代反应的定位规律:萘环上有一供电子的定位基时,主要发生同环取代

(即取代发生在定位基所在的苯环上)。若定位基位于α位,取代基主要进入同环的另一▣ 位。若定位基位于B位,取代基则主要进入定位基相邻的▣位。当萘环上有一吸电子的定位 基时,主要发生异环取代,取代基主要进入异环的两个▣位。 三、氧化反应 萘比苯容易被氧化,在不同的条件下,可分别被氧化生成邻苯二甲酸断和1,4-萘醌。 +O2 450C 邻苯二甲酸杆 CrO3,CHgCOOH 10-15C 1,4-萘醌 一般来说,萘氧化的产物为苯的衍生物,仍保留一个苯环,表明苯比萘稳定。 §4卤代烃 一、概述 卤代烃的化学性质活泼,月主要发生在C一X键上。因: ①分子中C一X键为极性共价键&心,碳带部分正电荷,易受带正电荷或孤电 子对的试剂的进攻。 卤代烷: CH:CH2-CI CH:CH2-Br CH;CH2-I CH:CH; 偶极知μD) 2.05 2.03 1.91 0 ②分子中C一X键的键能(C一F除外)都比C一H键小。 键 C-H C-CI C-Br C-I 键能KJ/mol 414 339 285 218 故C一X键比C一H键容易断裂而发生各种化学反应。 二、取代反应 RX+:Nu→RNu+X Nu=HO、RO、-CN、NH3、ONO2 :Nu一亲核试剂。山亲核试剂进攻引起的取代反应称为亲核取代反应(用S~表示)。 1.水解反应 RCH2-X NaOH RCHOH Nax 2.与氰化钠反应 RCH,X+NaCN醇,RCH,CN+NaX 肪 1°反应后分子中增加了一个碳原子,是有机合成中增长碳链的方法之一。 2°CN可进一步转化为-COOH,-CHNH2,-CONH2等基团。 3.与氨反应

RX+NH(过量)→R-NH,+NHX 4.与醇钠(RONa)反应 R-X RONa →R-OR'+NaX R-X一般为1°RX,(仲、叔卤代烷与醇钠反应时,主要发生消除反应生成烯烃)。 5.与AgNO3一醇溶液反应 R-X+AgNO;R-ONO2 Agx 硝酸酯 此反应可用于鉴别卤化物,因卤原子不同、或烃基不同的卤代烃,其亲核取代反应活性 有差异。 卤代烃的反应活性为: R3C-X R2CH-X RCH2X R-I >R-Br >R-C1 叔卤代烷 > 仲卤代烷>伯卤代烷 R-I 室温下沉淀 加热才能沉淀 三、消除反应 从分子中脱去一个简单分子生成不饱和键的反应称为消除反应,用E表示。 卤代烃与NOH(kOH)的醇溶液作用时,脱去卤素与B碳原子上的氢原子而生成烯烃。 R-CHCH,+NaOH壁、R-CHCH,+NaX+H0 HX R-CH-CH-CH-CH-R KOH-R-CH-CH-CH-CH-R 2NaX 2HO H XX H 1)消除反应的活性: 3°RX>2°RX>1°RX 2)2°、3°RX脱卤化氢时,遵守扎依采夫(Sayzeff)规则一即主要产物是生成 双键碳上连接烃基最多的烯烃。例如: KOH,乙醇 CH,CH2CH2CHCH; CHCH,CH-CHCH;CH:CH2CHCH=CH2 ⊙ 69% 31% CH3 CH;CH2-C-CH; KOH,乙醇 CH.CH-C-M +CH;CH2CH-CH2 Br 71% 29% CH3 KOH,乙醇 CH3 CH3 -CH3 -CHa CHa CH2 次 极少 四、与金属的反应 卤代烃能与某些金属发生反应,生成有机金属化合物一金属原子直接与碳原子相连接 的化合物

1.与金属镁的反应 R-X+Mg 无水乙醚,RMgX X=CI、Br 格林尼亚(Grignard)试剂 简称格氏试剂,1900年发现(29岁) 格氏试剂的结构还不完全清楚,一般认为是山RMg、MgX、(RMgX)m多种成分形成 的平横体系混合物,一般用RMgX表示。 乙醚的作用是与格氏试剂络合成稳定的溶剂化物,既是溶剂,又是稳定化剂。 苯、四氢呋喃(THF)和其他醚类也可作为溶剂。 色一8Mg健是极性很强的键,电负性C为25,Mg为1,2,所以格氏试剂非常活泼,能 起多种化学反应。 1)与含活泼氢的化合物作用 HOH R-H Mg x OH ROH→ R-H Mg RCOOH OCOR RMgX R-H Mg X HX X R-H+Mg R-C三CH R-H MgC=CR. 新的格氏试剂,很有用 在利用RMgX进行合成过程中还必须注意含活泼氢的化合物。 2)与醛、酮、脂、二氧化碳、环氧乙烷等反应 RMgX与醛、酮、酯、二氧化碳、不氧乙烷等反应,生成醇、酸等一系列化合物。所以 RMgX在有机合成上用途极广。例格氏试剂与CO2作用,经水解后可制得羧酸: RMgX+CO,右赤∠套R一OMgX H0 H+ 2.与金属钠的反应(Wutz武兹反应) 2R-X+2Na*R—R+2NaX 此反应可用来从卤代烷制备含偶数碳原子,结构对称的烷烃(只适用于同一伯卤代 烷,不同烷基无实用价值)