
含氧有机化合物化学性质摘要 §1醇 一、概述 醇的化学性质主要山羟基官能团所决定,同时也受到烃基的一定影响,从化学键来看,反应 的部位有COH、O一H、和a位C一H。 二、化学性质 1.与活泼金属的反应 CHCH2OH Na CHCH,ONa 1/2 H, K K 粘稠固体(溶于过量乙醇中) CHCH2O的碱性比OH强,所以醇钠极易水解。 CH3CH2ONa H2O -CH2CH2OH NaOH 较强键 较强酸 较弱酸 较弱减 醇的反应活性: CHOH〉伯醇(乙醇)>仲醇>叔醇 pKa15.09 15.93 >19 醇钠(RONa)是有机合成中常用的碱性试剂。 2.与氢卤酸反应(制卤代烃的重要方法) R-OH HX R-X H,O (1)反应速度与氢卤酸的活性和醇的结构有关。 HX的反应活性: HⅡ>HBr>HCI 例: CH3CH2CH2CH2OH HI (47%)- CHCH2CH2CH2I H2O +HBr(48%) H2SO4 CHCHCH2CH2Br+H2O △ HCI ZnCk-CHCHCH2CH2CI+H2O △ 醇的活性次序: 烯丙式醇>叔醇>仲醇>伯醇>CHOH 例1,醇与卢卡斯(Lucas.)试剂(浓盐酸和无水氯化锌)的反应: CH3 CH3 CH3-C-OH (浓HCl+无水ZnCl2) CH3一C一CI+H0 CH3 室温 CH3 lmin钟混浊,放置分层 CH.CH2CHCH3 卢下斯试剂, CHCH2CHCH3 H2O OH 室温 CI 10min钟混浊,放置分层

CH.CH2CH,CH2OH 卢卡斯试剂 CHCH2CH2CH2CI H2O 室温 放脊一小时也不反应(混浊) 加热才起反应(先混浊,后分层) Lucs试剂可用于区别伯、仲、叔醇,但一般仪适用于3一6个碳原子的醇。 原因:1一2个碳的产物(卤代烷)的沸点低,易挥发。 大于6个碳的醇(华醇除外)不溶于卢卡斯时机,易混淆实验现象。 (2)醇与HX的反应为亲核取代反应,伯醇为SN2历程,叔醇、烯丙醇为SN1历程, 仲醇多为SN1历程。 (3)B位上有支链的伯醇、仲醇与HX的反应常有重排产物生成。 例: CH3 CH3 CHs CH3-C-CH2OH HBr-CHg-C-CH2Br +CH3-C-CH2CHs CHg CH3 Br 重排产物(主要产物) 原因:反应是以S、1历程进行的。 这类重排反应称为瓦格涅尔-麦尔外因(Wagner-.Meerwein)重排,是碳整正离子的重排。 3.与卤化磷和亚硫酰氯反应 3ROH PX(P+X2) →3R-X+P(OH)3 X=Br、I(制备溴代或碘代烃) ROH PCI →R-CI+POCL3+HCI个 制氣代烃 ROH SOCI2 R-C1+S021+HC1↑ 此反应产物纯净 4.与酸反应(成脂反应) 1)与无机酸反应 醇与含氧无机酸硫酸、硝酸、磷酸反应生成无机酸酯。 CHCH,OH +HOSO,OH 大 CHCH,OSO,OH H2O 硫酸氢乙酯(酸性酯) CHCH,OSO,OH 减压裘馏 (CH:CH2O)2SO2 H2SO4 硫酸二乙酯(屮性酯) CHOSO,OCH 有机合成中的烷基化剂,有剧毒 CH:CH2OSO2OCH2CH3 高级醇的硫酸脂是常用的合成洗涤剂之一。1C12H2OSO2ONa(|二烷基磺酸钠)。 CH2-OH CH2-ONO2 三硝酸甘油酯 CH-OH 3HNO: CH-ONO2 +3HO CHzOH CH2-ONO2 可作炸药 2)与有机酸反应 H R-OH CHCOOH CHCOOR H2O 5.脱水反应 醇与催化剂共热即发生脱水反应,随反应条件而异可发生分子内或分子间的脱水反应
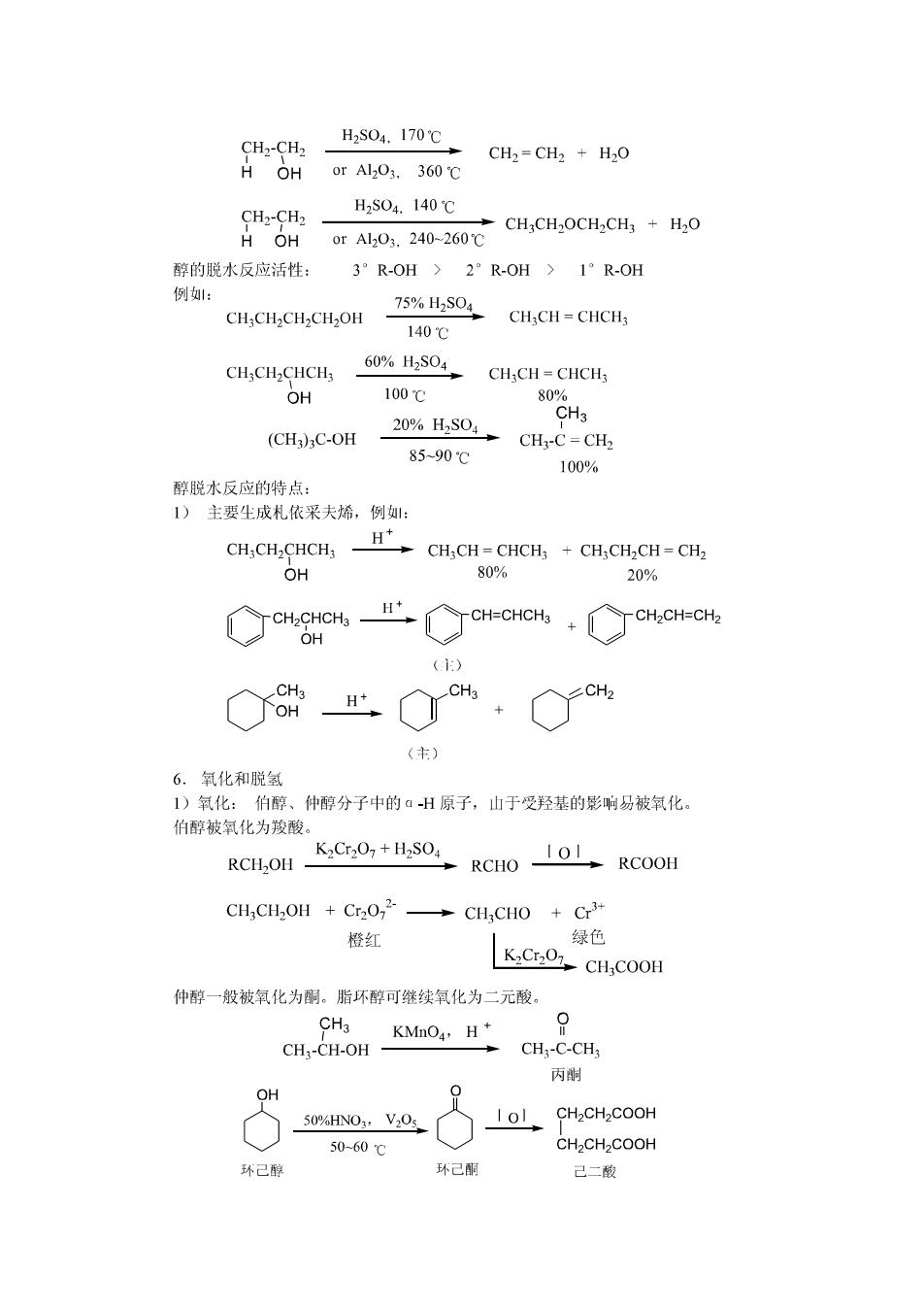
H2S04.170℃ CH2-CH2 CH2=CH2 H2O H OH orAl203.360℃ CH2-CH2 H2S04.140℃ H OH 0rAl203.240-260℃ 醇的脱水反应活性: 3°R-OH>2°R-OH>1°R-OH 例: CH:CH2CH2CH2OH 75%H2S04 CHCH=CHCH3 140℃ CHCH2CHCH3 60%H2S04 CHCH=CHCH3 OH 100℃ 80 20%H2S04→ CH3 (CH3)3C-OH CH3-C=CH2 85-90℃ 100% 醇脱水反应的特点: 1)主要生成札依采夫烯,例如: CH:CH,CHCH H CHCH-CHCHs CHCH,CH-CHa OH 80% 20% CH2CHCH3 H+ CH=CHCH3 CH2CH=CH2 OH () CH3 OH H+ CH3 (主) 6.氧化和脱氢 1)氧化:伯醇、仲醇分子中的āH原子,山于受羟基的影响易被氧化。 伯醇被氧化为羧酸。 K2Cr202+H2S04 RCHOH RCHO RCOOH CH3CH2OH Cr202 CH3CHO Cr3+ 橙红 绿色 K2Cr207 CHCOOH 仲醇一般被氧化为酮。脂环醇可继续氧化为二元酸。 CH3 KMnO4,H+ CH:-CH-OH CH;-C-CH3 丙酮 OH 50%HN03,V20s CH2CH2COOH 50-60℃ CH>CH2COOH 环己醇 环己酮 己二酸

叔醇一般难氧化,在制烈条件下氧化则碳链断裂生成小分子氧化物。 2)脱氢伯、仲醇的蒸气在高温下通过催化活性铜时发生脱氢反应,生成醛和酮。 RCH2OH Cu 325 C RCHO H2 R CHOH Cu325℃ R、 R CHOH H2 CHCH3Cu325℃ C-CH3 OH §2酚 一、概述 酚和醇具有相同的官能团,但酚羟基直接与苯环相连,氧原子的p轨道与芳环的π轨道 形成p一π共轭体系,导致氧原子的电子云密度降低,使得碳氧键的极性减弱而个易断裂, 不能像醇羟基那样发生亲核取代反应或消除反应。同时,酚羟基中氧原子的电子云密度降低 致使氧氢键的极性增加,与醇相比,酚的酸性明显增强。另外,山于酚羟基的给电子效应, 使苯环上的电子云密度增加,芳环上的亲电取代反应史容易进行。 二、与FeC13的显色反应 酚能与FC1;溶液发生显色反应,大多数酚能起此反应,故此反应可用来鉴定酚。 6ArOH FeCl3-Fe(OAr)6 ]3+6H*+3C1 蓝紫色一棕红色 不同的酚与FC1作用产生的颜色不同。除酚以外,凡具有稳定的烯醇式结构的脂肪族 化合物都可发生此反应。例: OH----O CH3C CH-COC2H5 山于分子内形成T-·共轭体系,月分子内以氢键连接成环,该烯醇式结构较为稳定, 可与三氯化铁作用显色。因此,可利用此反应来鉴别酚类化合物和具有稳定烯醇式结构的化 合物。 三、酚醚的生成 酚不能分子间脱水成醚,一般是山酚在碱性溶液中与烃基化剂作用生成。 RCH>Br OCH2R NaBr OH ONa NaOH (CH3)2SO4_ ○>ocH+NaBr 苯叩醚(酋香醚) CH2=CHCH2Br 广OCH2CH=CH+NaBr 苯基烯内基醚 〉-NO2 (除草醚)
在有机合成上常利用尘成酚醚的方法来保护酚羟基。 四、芳环上的亲电取代反应 羟基是强的邻对位定位基,山于羟基与苯环的P共轭,使苯环上的电子云密度增加, 亲电反应容易进行。 (1)卤代反应 苯酚与溴水在常温下可立即反应生成2,4,6三溴苯酚白色沉淀。 OH OH + Br2(H20) 3HBr Br 反应很灵敏,故此反应可用作苯酚的鉴别和定量测定。 1需要制取一溴代苯酚,则要在非极性溶剂(CS2,CC1)和低温下进行。 OH OH OH Br +Br +3HBr 0 (2)硝化 苯酚比苯易硝化,在室温下即可与稀硝酸反应。 OH OH OH 200 稀HNO y02 可用水蒸汽蒸馏分开 邻硝基苯酚易形成分子内氢键而成螯环,这样就削弱了分子内的引力:而对硝基苯酚不 能形成分子内氢键,但能形成分子间氢键而缔合。因此邻硝基苯酚的沸点和在水中的溶解度 比其异构体低得多,故可随水蒸气蒸馏出来。 (3)磺化 OH OH 室温 SO3H H2SO4(浓) OH 1000C SO3H 五、氧化反应 酚易被氧化为醌等氧化物,氧化物的颜色随着氧化程度的深化而逐渐加深,山无色而呈 粉红色、红色以致深褐色。例: OH KMnO4+H2SO 对苯醌(棕黄色)》 多元酚史易被氧化。 OH 2AgBr +2Ag HBr

对苯二酚是常用的显影剂。 酚易被氧化的性质常用来作为抗氧剂和除氧剂。 §3醚 一、概述 除某些环醚外,醚是一类很稳定的化合物,其化学稳定性仪次于烷烃。常温下,醚对于 活泼金属、碱、氧化剂、还原剂等【分稳定。但醚仍可发尘一些特殊的反应。 二、醚键的断裂 在较高温度下,强酸能使醚链断裂,使醚链断裂最有效的试剂是浓的氢碘酸(Ⅲ)。 CHsCH2OCH2CH3+HI-CHaCH2OCH2CHs CH CH2I CHsCH2OH H(过量),2CH,CH,I+H,0 醚键断裂时往往是较小的烃基生成碘代烷,例: CH CHCH2OCH2CHa HI-CHgCHCH2OH CH;CH,I CHa CH3 芳香混醚与浓Ⅲ作用时,总是断裂烷氧键,生成酚和碘代烷。 57%H1 O+-CH3 OH CH1 120-130℃ P~π共轭 键牛固,不易断 三、环氧乙烷与RMgX反应 RCH2CH OMgXH RCHCH.OH 环氧乙烷与RMgX反应,是制备增加两个碳原子的伯醇的重要方法。例: CH2MgBr+ 无水乙醚 CH2CH2CH2OMgBr H CH2CH2CH2OH §4醛和酮 一、概述 醛酮中的羰基山于π键的极化,使得氧原子上带部分负电荷,碳原子上带部分正电荷。 氧原子可以形成比较稳定的氧负离子,它较带正电荷的碳原子要稳定得多,因此反应中心是

羰基中带正电荷的碳。所以羰基易与亲核试剂进行加成反应(亲核加成反应)。 此外,受羰基的影响,与羰基直接相连的α-碳原子上的氢原子(α-H)较活泼,能发 生一系列反应。 亲核加成反应和ā-H的反应是醛、酮的两类主要化学性质。 二、亲核加成反应 1.与氢氰酸的加成反应 C=O±HCN±C一以 CN a羟基情 反应范围:醛、脂肪族甲基酮。ArCOR和ArCOAr难反应。 ā-羟基晴是很有用的中间体,它可转变为多种化合物,例如: -H20 CH3 CHsOH CH3 CH2=C-CN H2O/H H+ →CH2=C-COOCH3 (CH)CCN (CH3)2CCOOH OH (HL OH (CH3)2CCH2NH2 OH 2.与格式试剂的加成反应 >光名+k8MgX无水乙酷 OMgX H2O -R-C-OH HOMgx 个 式中R也可以是Ar。故此反应是制备结构复杂的醇的重要方法。例: CH3 CH3 CH3 CH3 Mg (CHg)2CO CH3 H2O/H CH3 干乙醚 MgBr C-OMgBr C-OH Br CHs CH3 3.与饱和亚硫酸氢钠(40%)的加成反应 醇钠 =0+Na0s-0H→ C-ONa OH SO2H SO2Na 强酸 强酸盐(白十) 产物α-羟基磺酸盐为白色结品,不溶于饱和的亚硫酸氢钠溶液中,容易分离出来:与 酸或碱共热,又可得原来的醛、酮。故此反应可用以提纯醛、酮。 1°反应范围 醛、甲基酮、七元环以下的脂环酮。 2°反应的应用 a鉴别化合物 b分离和提纯醛、酮 稀NaHCO3 R、 NaHSO3R、OH RCHO Na2SO3+CO2+H2O H-C=0 C H (R') (R) SOaNa HCI RCHO+NaCI+SO2+H2O 杂质不反应,分离去掉
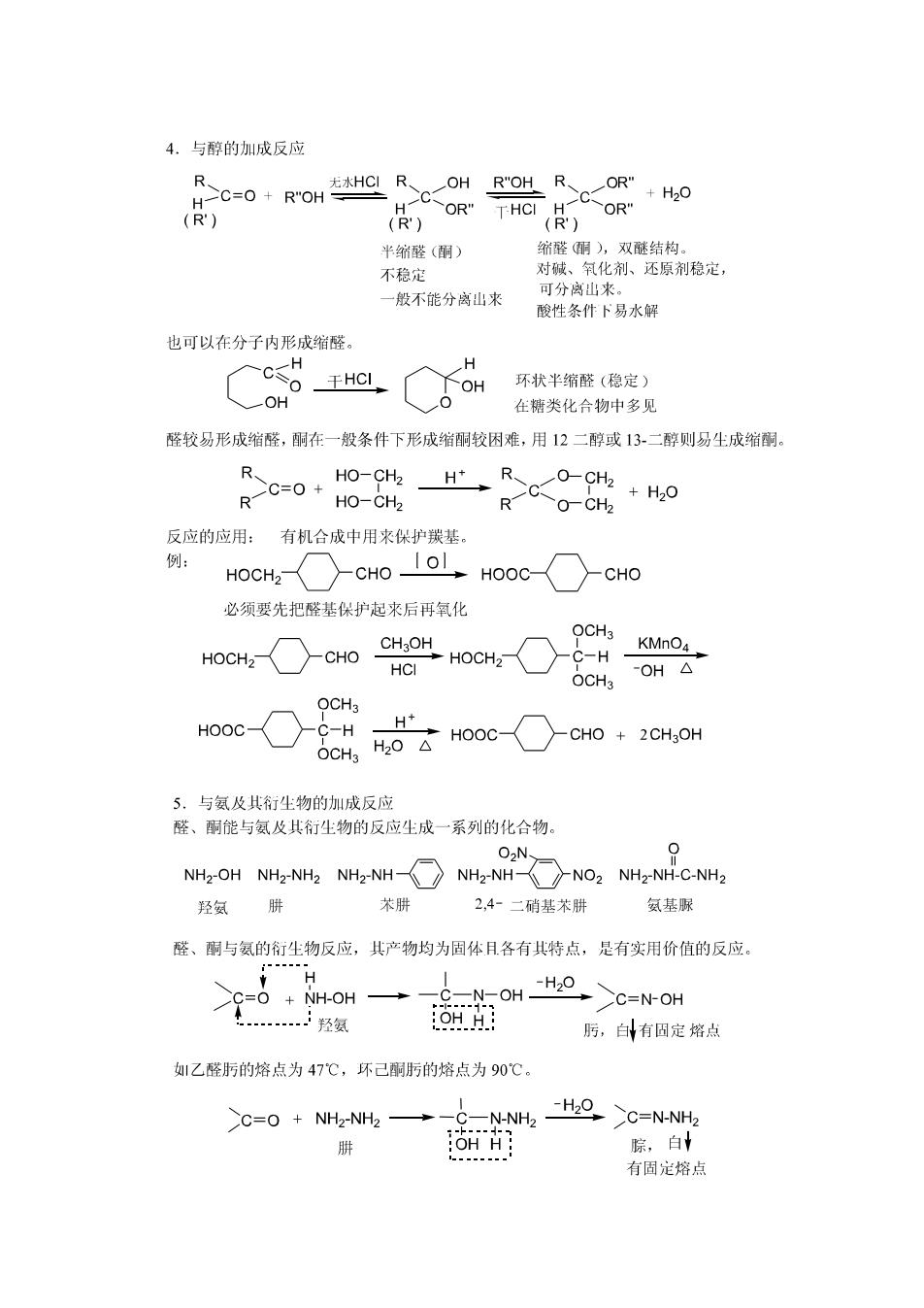
4.与醇的圳成反应 -C=O+R"OH 无水HC R、 OH R"OH R、 OR" C C +H20 H COR" THCI H OR" (R) (R) (R') 半缩醛(酮) 纺醛酮),双醚结构。 不稳定 对碱、氧化剂、还原剂稳定, 一般不能分离山来 可分离山来。 酸性条件卜易水解 也可以在分子内形成缩醛。 H c=0 H 千HCI OH 环状半缩醛(稳定) OH 在糖类化合物中多见 醛较易形成缩醛,酮在一般条件下形成缩酮较因难,用12二醇或13-二醇则易生成缩酮。 R HO-CH2 >C=0+ H→ RC-CHa R HO-CH2 +H20 R O-CH2 反应的应用: 有机合成中用来保护羰基。 例: HOCH2 CHO、 HOOC CHO 必须要先把醛基保护起来后再氧化 OCH3 CH3O HOCH2 CHO →HOCH2 KMnO4 HCI C-H -OH△ OCHa OCH3 HOOC C-H H+ H20△ HOOC CHO 2CH3OH OCH3 5.与氨及其衍尘物的加成反应 醛、酮能与氨及其衍生物的反应生成一系列的化合物。 O2N NH2-OH NH2-NH2 NH2-NH NH2NH(广NO2 NH2-NH-C-NH2 羟氨 肼 苯肼 2,4-二硝基苯肼 氨基脲 醛、酮与氨的衍生物反应,其产物均为固体月各有其特点,是有实用价值的反应。 -H20 +NH-OH -N-OH C=N-OH 羟氨 OH H 肟,白有固定熔点 1乙醛肟的熔点为47℃,环己酮肟的熔点为90℃。 C=0 NH2-NH2->-C-N-NH2 -H20 C=N-NH2 肼 :OH H: 腙,白 有固定熔点

C=0+NH2-NH -H2O C-N-NH 苯册 OH H: 苯腙(黄) 有固定熔点 ON -H20】 02N >C=O+NH2NH{@NO2→ C=N-NHNO2 2,4·二硝基木肼 2,4·二硝基术腙(黄) >C=O+NH2NHC-NH2→ -H20 C=N-NH C-NH2 氨基脲 缩氨脲(白十) 上述反应的特点: 反应现象明显(产物为固体,具有固定的晶形和熔点),常用来分离、提纯和鉴别醛酮。 2,4二硝基苯肼与醛酮加成反应的现象非常明显,故常用来检验羰基,称为羰基试剂。 三、还原反应 利用不同的条件,可将醛、酮还原成醇、烃或胺。 (一)还原成醇(>C=O·二CH-OH) 1.催化氢化(产率高,90-100%) R、 Ni >C=0+H2 R一 H H-CH-OH (R) 热,加压 (R) 例: Ni 0+H2 OH 50℃6.5MPa CH:CH=CHCH CHO 2H2 Ni CH:CH,CH,CH,CH,OH 250℃加压 (C-C,C-O均被还原) 要保州双键而只还原羰基,则应选用金属氢化物为还原剂。 2.用还原剂(金属氢化物)还原 (1)LiA1H4还原 CH:CH=CHCH,CHO ①LiAIH,千乙壁CH,CH-CHCH,CH,OH ②H20+ (只还原C=0) (2)NaBH4还原 CH;CH-CHCH2CHO ①NaBH4, CHCH-CHCH,CH,OH ②H20+ (只还原C0) (二)还原为烃(>C=0→>CH,) 较常用的还原方法有两种。 1.吉尔聂尔-沃尔夫-黄鸣龙还原法(吉尔聂尔为俄国人,沃尔夫为德国人) 此反应是吉尔聂尔和沃尔夫分别于1911、1912年发现的,故此而得名

KOH或 无水NH2-NH2 >C=0 C=N-NH2 C2HsONa-C2HsOH CH2 N2 加成,脱水 200℃加压 回流50-100h 1946年-黄鸣龙改进了这个方法。 改进:a将无水肼改用为水合肼:碱用NaOH:用高沸点的缩乙二醇为溶剂一起加热。 b加热完成后,先蒸去水和过量的肼,再升温分解腙。 例: NH2NH2,H2O C-CH2CH3 NaOH CH2CH2CH3 N2 (HOCH2CH2)2O 200℃3-5h 82% 此反应可简写为,>C=O+NH2NH2 KOH CH2 N2 △ 2.克莱门森(Clemmensen)还原 酸性还原 R H-C=0 Zn-Hg,浓HCl C (R) △ (R) 此法适用于还原芳香酮,是间接在芳环上引入直链烃基的方法。 CHgCH2CH2C =O_AICls CH2CH2CH3 H Zn-Hg/HCI CH2CH2CH2CH3 80% 对酸敏感的底物(醛酮)不能使用此法还原(醇羟基、C=C等)。 四、氧化反应 醛易被氧化,弱的氧化剂即可将醛氧化为羧酸。 ①托伦(Tollens)试剂硝酸银的氨溶液。将醛和托伦试剂共热,醛被氧化为羧酸,银 离子被还原为金属银附着在试管壁上形成明亮的银镜,所以这个反应又称为银镜反应。 RCHO 2[Ag(NH3)2]+20H-2Ag+RCOONH4 NH3 +H2O 土伦试剂 银镜 要想得到银镜,试管壁必须干净,则出现黑色悬浮的金属银。 托伦试剂既可氧化脂肪醛,又可氧化芳香醛。在同样的条件下酮不发生反应。 ②.斐林(Fehling)试剂山A、B两种溶液组成,A为硫酸铜溶液,B为酒石酸御钠和氢 氧化钠溶液,使用时等量混合组成斐林试剂。其中酒石酸御钠的作用是使铜离子形成配合物 而不致在碱性溶液中生成氢氧化铜沉淀。 脂肪醛与斐林试剂反应,尘成氧化亚铜砖红色沉淀。 RCHO+CU2+OH -RCOO +Cu2OY 甲醛可使斐林试剂中的C还原成单质的铜。其它脂肪醛可使斐林试剂中的Cu2还原成 Cu20沉淀。酮及芳香醛不与斐林试剂反应