
第十一章 杂环化合物和生物碱 教学目标: 1.讲授杂环的结构特点(芳香性及环上缺电子或多π电子的情况)。着重介绍含氮杂环 化合物。应该使学生掌屋几种重要的常见杂环化合物的分子结构与性质。要介绍嘧啶、嘌岭的 羟基与氨基一物的互变异构现象。 2.关于杂环的命名应该以音译名称为主。要求学生记住一些重要杂环的名称与结构式。 生物碱的内容可让学生自学。 教学重点、难点: 杂环的结构、命名。 教学方法、手段:讲授、CAI课件辅助教学。 本章学时:3学时

教学内容: 第十一章杂环化合物和生物碱 杂环化合物和生物碱广泛存在于自然界中,在动植物体内起着重要的生理作用。本章介 绍杂环化合物的分类、命名、结构特点、性质及重要的杂环化合物,生物碱的一般性质、提 取方法和重要的生物碱。 第一节杂环化合物 环状有机化合物中,构成环的原子除碳原子外还含有其它原子,月这种环具有芳香结构, 则这种环状化合物叫做杂环化合物。组成杂环的原子,除碳以外的都叫做杂原子。常见的杂 原子有氧、硫、氮等。前面学习过的环醚、内酯、内酐和内酰胺等都含有杂原子,但它们容 易开环,性质上又与开链化合物相似,所以不把它们放在杂环化合物中讨论。 杂环化合物种类繁多,在自然界中分布很广。具有生物活性的天然杂环化合物对生物体 的生长、发育、遗传和衰亡过程都起着关键性的作用。例:在动、植物体内起着重要生理 作用的血红素、叶绿素、核酸的碱基、中草药的有效成分一生物碱等都是含氮杂环化合物。 一部分维生素、抗菌素、植物色素、许多人工合成的药物及合成染料也含有杂环。 杂环化合物的应用范围极其广泛,涉及医药、农药、染料、生物膜材料、超导材料、分子器 件、贮能材料等,尤共在生物界,杂环化合物几乎随处可见。 一、杂环化合物的分类和命名 为了研究方便,根据杂不母体中所含环的数目,将杂环化合物分为单杂环和稠杂环两大 类。最常见的单杂环有五元环和六元环。稠杂环有芳环并杂环和杂环并杂环两种。另外, 可根据单杂环中杂原子的数目不同分为含一个杂原子的单杂环、含两个杂原子的单杂环等。 杂环化合物的命名在我国有两种方法:一种是译音命名法:另一种是系统命名法。 译音法是根据IUPAC推荐的通用名,按外义名称的译音来命名,并用带“口”芳的同 音汉宁来表示环状化合物。例如: 呋喇 咪唑 吡啶 furan imidazole pyridine purine 杂环上有取代基时,以杂环为母体,将环编号以注明取代基的位次,编号一般从杂原子 开始。含有两个或两个以上相同杂原子的单杂环编号时,把连有氢原子的杂原子编为1,并 使其余杂原子的位次尽可能小:1果环上有多个不同杂原子时,按氧、硫、氮的顺序编号。 例: H30 2,5-甲基呋响 4一甲基咪唑 4,5-甲基噻唑 当只有1个杂原子时,也可用希腊字母编号,靠近杂原子的第一个位置是ū-位,其次 为B-位、y-位等。例如:
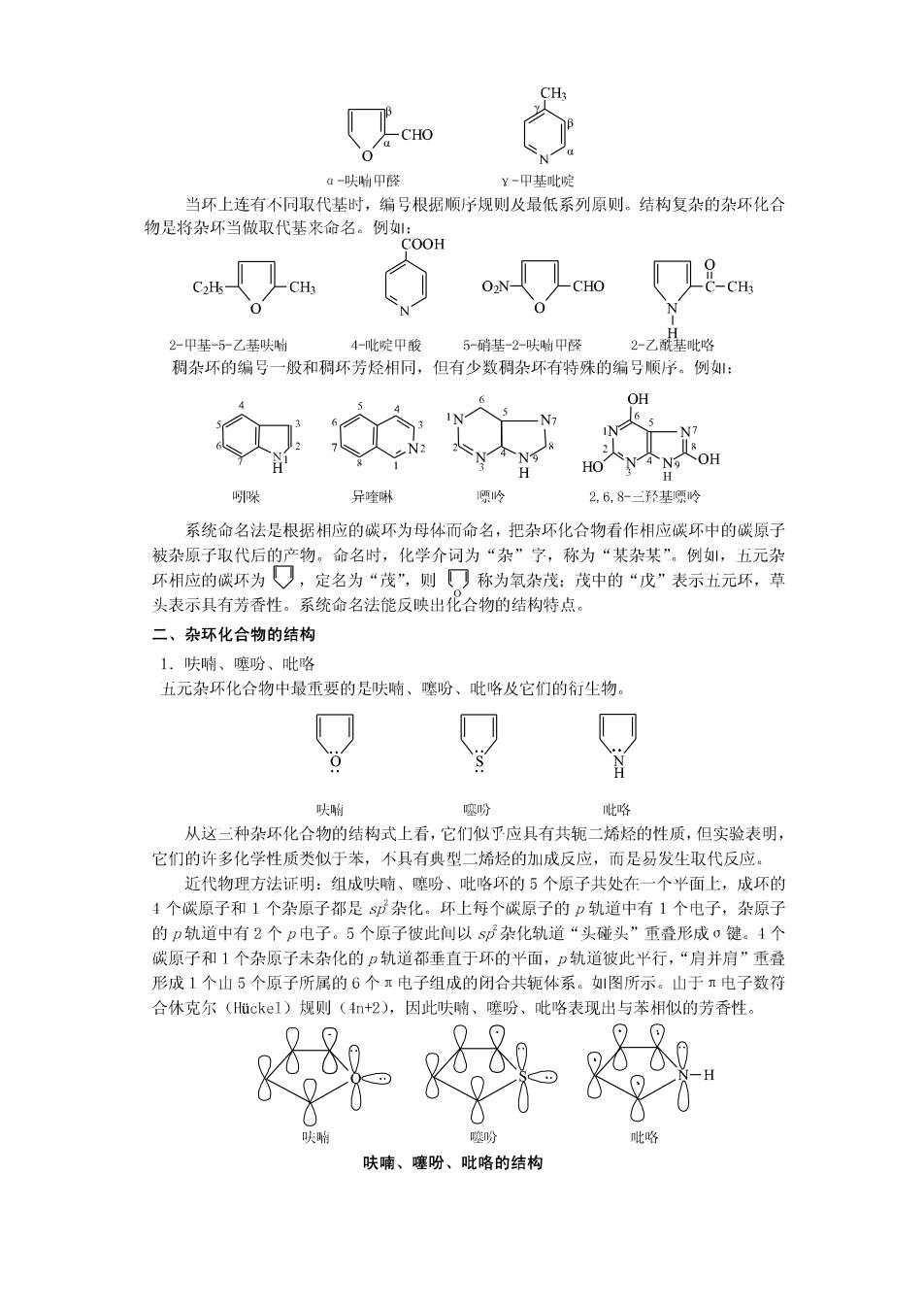
CHO 0 4-呋响甲醛 ¥-甲基吡啶 当环上连有不同取代基时,编号根据顺序规则及最低系列原则。结构复杂的杂环化合 物是将杂环当做取代基来命名。例: COOH CH CHO CH3 2-甲基-5乙基呋时 4-此啶甲酸 5-硝基-2-呋附甲醛 2-乙酰基吡略 稠杂环的编号一般和稠环芳烃相同,但有少数稠杂环有特殊的编号顺序。例: OH N 8 HoN④N9 哚 异喹啉 项岭 2,6,8-三羟基项1岭 系统命名法是根据相应的碳环为母体而命名,把杂环化合物看作相应碳环中的碳原子 被杂原子取代后的产物。命名时,化学介词为“杂”字,称为“某杂某”。例,五元杂 环相应的碳环为,定名为“茂”,则☐称为氧杂茂:茂中的“戊”表示五元环,草 头表示具有芳香性。系统命名法能反映出化合物的结构特点。 二、杂环化合物的结构 1.呋喃、噻吩、吡咯 五元杂环化合物中最重要的是呋喃、噻吩、吡咯及它们的衍生物。 呋啊 噻吩 吡咯 从这三种杂环化合物的结构式上看,它们似乎应具有共轭二烯烃的性质,但实验表明, 它们的许多化学性质类似于苯,不具有典型二烯烃的加成反应,而是易发生取代反应。 近代物理方法证明:组成呋喃、噻吩、吡咯环的5个原子共处在一个平面上,成环的 4个碳原子和1个杂原子都是sp杂化。环上每个碳原子的p轨道中有1个电子,杂原子 的p轨道中有2个p电子。5个原子彼此间以sp杂化轨道“头碰头”重叠形成σ键。4个 碳原子和1个杂原子未杂化的p轨道都垂直于环的平面,p轨道彼此平行,“肩并肩”重叠 形成1个山5个原子所属的6个π电子组成的闭合共轭体系。如图所示。山于π电子数符 合休克尔(Huckel)规则(4n+2),因此呋喃、噻吩、 吡咯表现出与苯相似的芳香性。 努 呋喃、噻吩、吡咯的结构

在呋喃、噻吩、吡略分子中,山于杂原子的未共用电子对参与了共轭体系(6个电 子分布在山5个原子组成的分子轨道中),使环上碳原子的电子云密度增加,因此环中碳 原子的电子云密度相对地大于苯中碳原子的电子云密度,所以此类杂环称为富电子芳杂环 或多电子芳杂环。 杂原子氧、硫、氮的电负性比碳原子大,使环上电子云密度分布不象苯环那样均匀, 所以呋喃、噻吩、吡咯分子中各原子间的键长并不完全相等,因此芳香性比苯差。山于杂 原子的电负性强弱顺序是:氧>氨>硫,所以芳香性强弱顺序下:苯>噻吩>吡咯>呋喃。 2.吡啶 六元杂环化合物中最重要的是吡啶。吡啶的分子结构从形式上看与苯【分相似,可以 看作是苯分子中的一个CH基团被N原子取代后的产物。根据杂化轨道理论,吡啶分子中5 个碳原子和1个氮原子都是经过s杂化而成键的,象苯分子一样,分子中所有原子都处 在同一平面上。与吡咯个同的是,氮原子的二个未成对电子,两个处于sp轨道中,与相 邻碳原子形成σ键,另一个处在p轨道中,与5个碳原子的p轨道半行,侧面重叠形成 个闭合的共轭体系。氮原子尚有一对未共用电子对,处在sD杂化轨道中与环共平面。 图所示。吡啶符合休克尔规则,所以吡啶具有芳香性。 吡啶的结构 在吡啶分子中,山于氮原子的电负性比碳大,表现出吸电子诱导效应,使吡啶环上碳 原子的电子云密度相对降低,因此环中碳原子的电子云密度相对地小于苯中碳原子的电子 云密度,所以此类杂环称为缺电子芳杂环或缺π电子芳杂环。 富电子芳杂环与缺电子芳杂环在化学性质上有较明显的差异。 三、杂环化合物的化学性质 呋喃、噻吩、吡咯都是官电子芳杂环,环上电子云密度分布不象苯那样均匀,因此, 它们的芳香性不苯,有时表现出共轭二烯烃的性质。山于杂原子的电负性不同,它们表 现的芳香性程度也不相同。吡啶是缺电子芳杂环,共芳香性也不苯典型。 1.亲电取代反应 富电子芳杂环和缺电子芳杂环均能发尘亲电取代反应。但是,富电子芳杂环的亲电取 代反应主要发生在电子云密度史为集中的α-位上,而且比苯容易:缺电子芳杂环吡啶 的亲电取代反应主要发生在电子云密度相对较高的B一位上,而且比苯困难。吡啶不易发 生亲电取代,而易发生亲核取代,主要进入α-位,其反应与硝基苯类似。 (1)卤代反应呋喃、噻吩、吡咯比苯活泼,一般不需催化剂就可直接卤代。 +Br2 1,4-氧六环 室温 -Br HBr 。-溴代呋帽 +Br HAC多 +HBr a-溴代噻吩
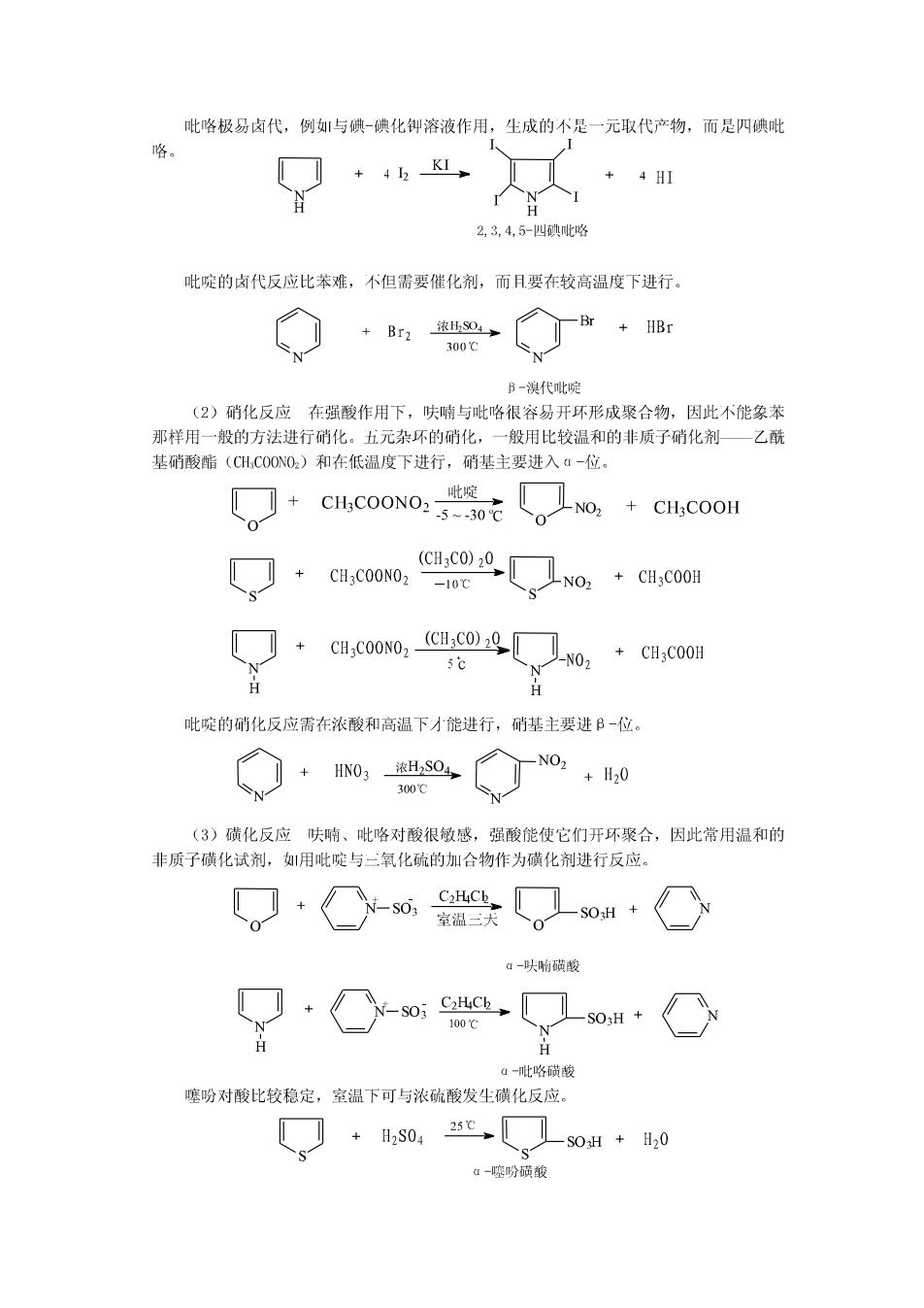
吡咯极易卤代,例与碘-碘化御溶液作用,生成的不是一元取代产物,而是四碘吡 咯 +42K、 + 4HI H 2,3,4,5-四碘吡咯 吡啶的卤代反应比苯难,不但需要催化剂,而.月要在较高温度下进行。 Br Br2 浓HSO4 +HBr 300℃ B-溴代吡啶 (2)硝化反应在强酸作用下,呋喃与吡咯很容易开环形成聚合物,因此不能象苯 那样用一般的方法进行硝化。五元杂环的硝化,一般用比较温和的非质子硝化剂一乙酰 基硝酸脂(CH,COONO2.)和在低温度下进行,硝基主要进入a-位。 CH3COONO2- 啶 5--30℃ no CH:COOH (CH3C0)20 + CH3COONO2 -10℃ CH3COONO2 N0 N 吡啶的硝化反应需在浓酸和高温下才能进行,硝基主要进B-位。 + HN03浓H,SO4, N02 +H20 300℃ (3)磺化反应呋喃、吡咯对酸很敏感,强酸能使它们开环聚合,因此常用温和的 非质子磺化试剂,用吡啶与三氧化硫的加合物作为磺化剂进行反应。 C2HCk_ SO 室温二天 α-呋响磺峻 S03 C2HCh 100℃ H H a-吡咯磺酸 噻吩对酸比较稳定,室温下可与浓硫酸发生磺化反应。 + H2S04 25℃ SOH +H20 a-噻吩磺酸

吡啶在硫酸求催化和加热的条件下才能发生磺化反应。 Hg SO4 SO H H2S04 +H20 >200℃ β-吡啶磺酸 (4)傅-克反应傅氏酰基化反应常采用较温和的催化剂|SC1:、BF,等,对活性较 大的吡咯可不用催化剂,直接用酸酐酰化。吡啶一般不进行傅氏酰基化反应。 +(CH3C0),0 BF3 COCH3 CHCOOH ā-乙酰基呋响 (CH3C0)20 20'c, COCH;CH;COOH H H a-乙酰基吡咯 2.加成反应 呋喃、噻吩、吡咯均可进行催化加氢反应,产物是失去芳香性的饱和杂环化合物。呋 喃、吡咯可用一般催化剂还原。噻吩中的硫能使催化剂中毒,不能用催化氢化的方法还原, 需使用特殊催化剂。吡啶比苯易还原,金属钠和乙醇就可使其氢化。 +2H2 Ni 0 四氢呋啭 +2H2 MoS2 四氢噻吩 2 H2 Pd H 四氢吡咯(吡咯烷) Na+CHsOH 六氢吡啶 喹啉催化圳氢,氢加训在杂环上,说明杂环比苯环易被还原。 +2、 四氢喹啉
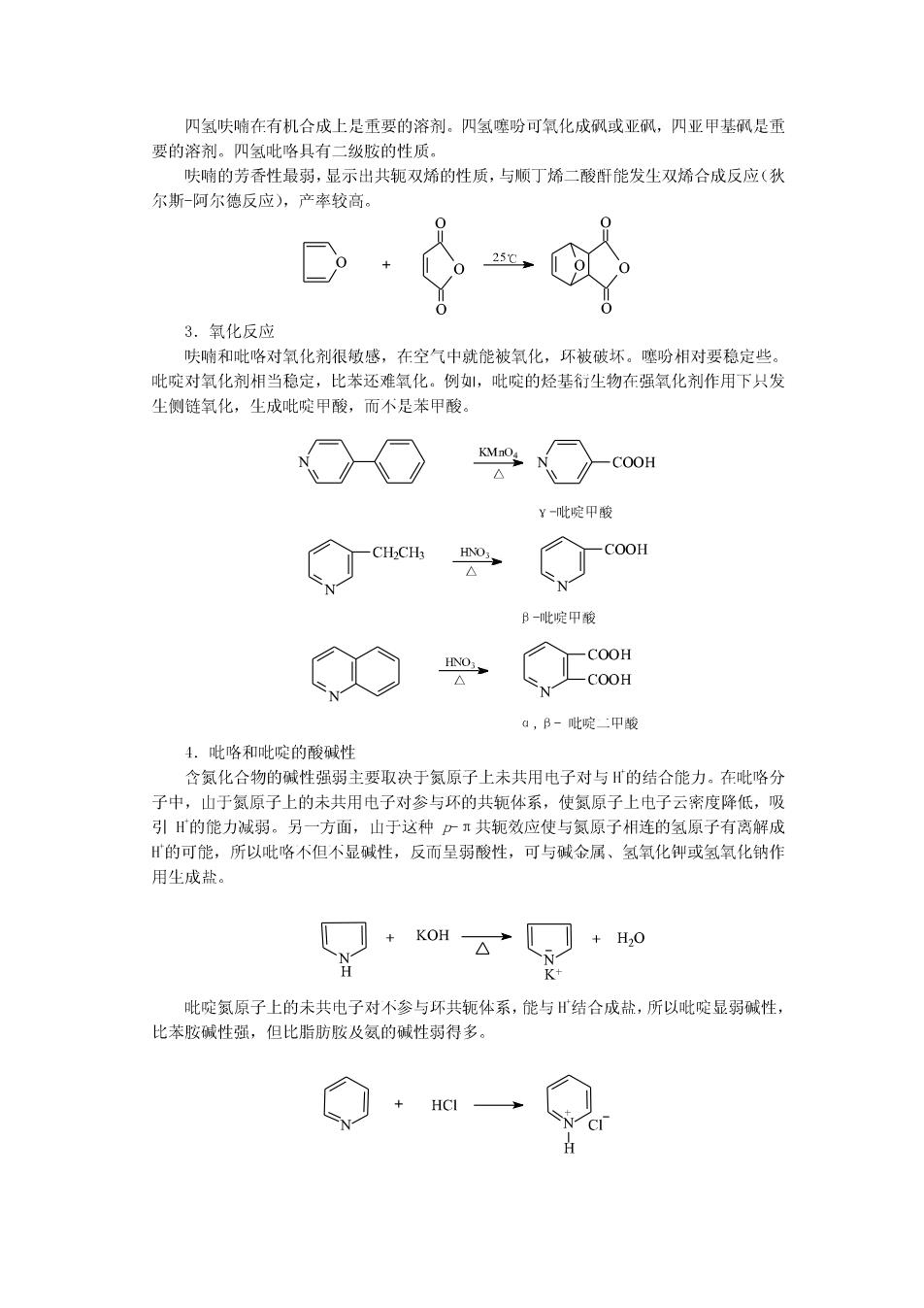
四氢呋喃在有机合成上是重要的溶剂。四氢噻吩可氧化成砜或亚砜,四亚甲基砜是重 要的溶剂。四氢吡咯具有二级胺的性质。 呋喃的芳香性最弱,显示出共轭双烯的性质,与顺丁烯二酸酐能发生双烯合成反应(狄 尔斯-阿尔德反应),产率较高。 25℃ 3.氧化反应 呋喃和吡咯对氧化剂很敏感,在空气中就能被氧化,环被破坏。噻吩相对要稳定些。 吡啶对氧化剂相当稳定,比苯还难氧化。例,吡啶的烃基衍生物在强氧化剂作用下只发 生侧链氧化,生成吡啶甲酸,而不是苯甲酸。 KMnO4 COOH y-吡啶甲酸 CH2CHz HNO COOH △ N β-吡啶甲酸 COOH △ COOH a,B-吡啶二甲酸 4.吡咯和吡啶的酸碱性 含氨化合物的碱性强弱主要取决于氮原子上未共用电子对与H的结合能力。在吡咯分 子中,山于氮原子上的未共用电子对参与环的共轭体系,使氮原子上电子云密度降低,吸 引H的能力减弱。另一方面,山于这种口π共轭效应使与氮原子相连的氢原子有离解成 H的可能,所以吡咯不但个显碱性,反而呈弱酸性,可与碱金属、氢氧化御或氢氧化钠作 用生成盐。 + KOH H,O 吡啶氮原子上的未共电子对不参与环共轭体系,能与川结合成盐,所以吡啶显弱碱性, 比苯胺碱性强,但比脂肪胺及氨的碱性弱得多。 HCI

四、与生物有关的杂环化合物及其衍生物 1·呋喃及其衍尘物 糠醛是不含ā-氢的醛,其化学性质与苯甲醛相似,能发生康尼查罗反应及一些芳香 醛的缩合反应,生成许多有用的化合物。因此,糠醛是有机合成的重要原料,它可以代替 甲醛与苯酚缩合成酚醛树酯,也可用来合成药物、农药等。 2.吡咯及其衍生物 3.吡啶及其衍尘物定。 COOH CONH B-吡啶甲酸(烟梭或尼克酸) B-吡啶甲酰胺(烟酰胺或尼克酰胺) 1.吲哚及其衍生物 CH: CH-COOH H 吲哚 β-甲基吲哚 B-哚乙酸 4.苯并吡喃及其衍生物 苯并吡喃 2-苯基苯并吡咐 5.嘧啶及其衍生物 嘧啶是含两个氮原子的六元杂环。它是无色品体,熔点20~22℃,沸点123~124℃, 易溶于水,具有弱碱性,可与强酸成盐,其碱性比吡啶弱。这是山于嘧啶分子中氨原子相 当于一个硝基的吸电子效应,能使另一个氮原子上的电子云密度降低,结合质子的能力减 弱,所以碱性降低。 嘧啶很少存在于自然界中,其衍尘物在自然界中普遍存在。例核酸和维尘素B中都 含有嘧啶环。组成核酸的重要碱基:胞嘧啶(Cytsine,简与C)、尿嘧啶(Uracil,简写 U)、胸腺嘧啶(Thymine,简与T)都是嘧啶的衍尘物,它们都存在烯醇式和酮式的互变 异构体。 NH2 NH OH H 4氨基-2-羟基嘧啶 4-氨基-2氧嘧啶 胞嘧啶(C) OH OH 2,4-二羟基嘧啶 2,4-二氧嘧啶 尿嘧啶(U)
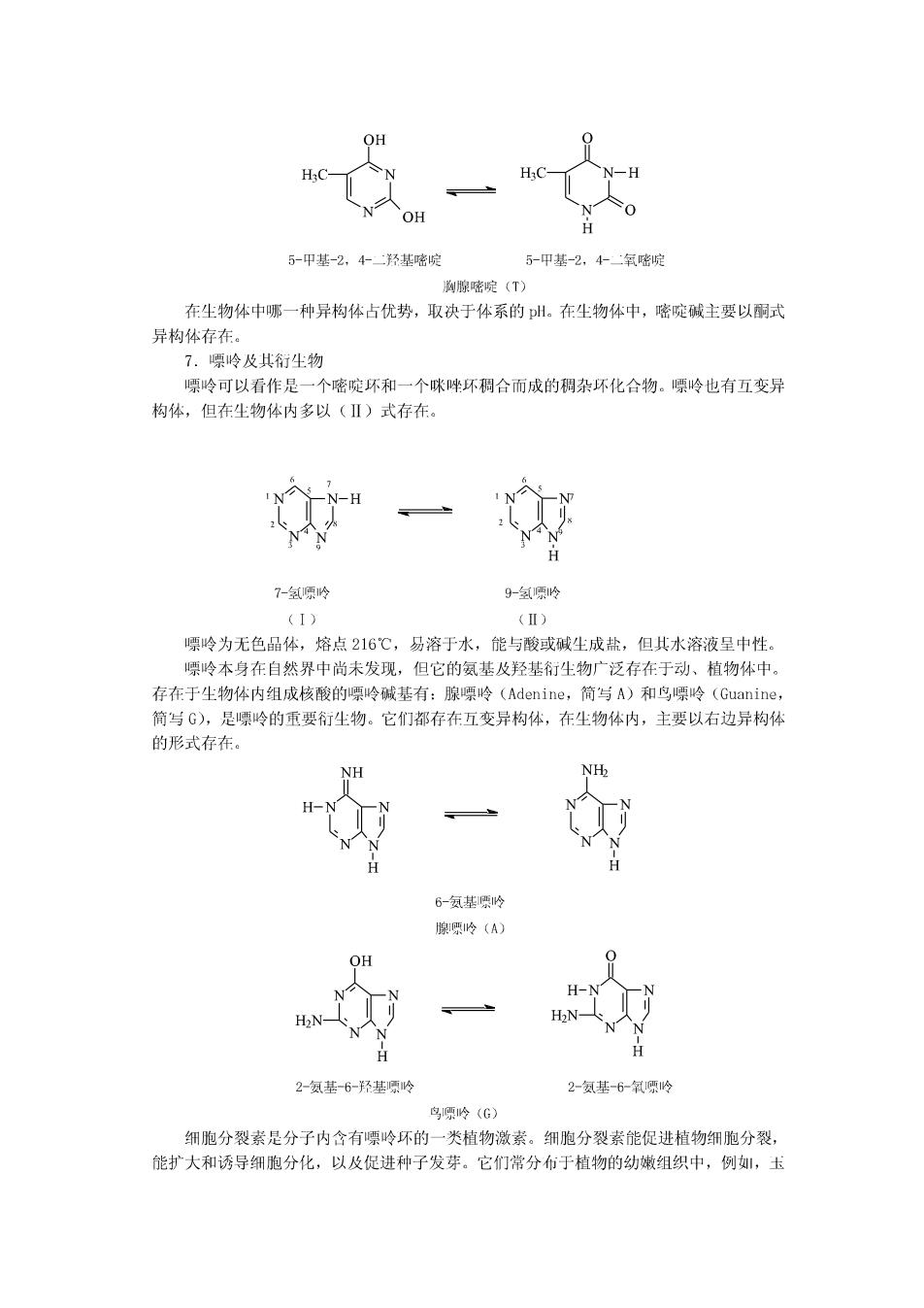
OH H:C H OH 5-甲基-2,4羟基嘧啶 5-甲基-2,4-二氧嘧啶 胸腺嘧啶(T) 在生物体中哪一种异构体占优势,取决于体系的pH。在尘物体中,嘧啶碱主要以丽式 异构体存在。 7.嘌岭及其衍生物 嘌呤可以看作是一个嘧啶环和一个咪哗环稠合而成的稠杂环化合物。嘌岭也有互变异 构体,但在生物体内多以(Ⅱ)式存在。 7-氢嘌吟 9-氢原怜 (I) (Ⅱ) 嘌呤为无色品体,熔点216℃,易溶于水,能与酸或碱生成盐,但其水溶液呈中性。 嘌岭本身在自然界中尚未发现,但它的氨基及羟基衍生物广泛存在于动、植物体中。 存在于生物体内组成核酸的嘌岭碱基有:腺嘌岭(Adenine,简与A)和鸟嘌岭(Guanine, 简与G),是嘌岭的重要衍尘物。它们都存在互变异构体,在生物体内,主要以右边异构体 的形式存在。 H 6-氨基嘌怜 腺嘌岭(A) OH H-N N H2N H2N- 2-氨基-6-羟基嘌呤 2-氨基-6-氧项岭 鸟项岭(G) 细胞分裂素是分子内含有嘌呤环的一类植物激素。细胞分裂素能促进植物细胞分裂, 能扩大和诱导细胞分化,以及促进种子发芽。它们常分布于植物的幼嫩组织中,例,玉

米素最早是从未成熟的玉米中得到的。人们常用细胞分裂素来促进植物发芽、生长和防哀 保绿,以及延长蔬菜的贮藏时间和防止果树生理性落果等。 8.喋岭及其衍生物 第二节生物碱 生物碱是一类存在于植物体内(偶尔在动物体内发现),对人和动物有强烈尘理作用 的含氮碱性有机化合物。 生物碱的发现始于19世纪叶,最早发现的是吗啡(1803年),随后不断报道了各种 生物碱的发现,例1喹咛(1820年)、颠茄碱(1831年)、古柯碱(1860年)、麻黄碱(1887 年)。19世纪兴起了对生物碱的研究和结构测定,它对杂环化学、立体化学和合成新药物 提供了大量的资料和新的研究方法。 一、生物碱的存在及提取方法 1.尘物碱的存在 2.生物碱的提取方法 (1)稀酸提取法 (2)有机溶剂提取法 二、生物碱的一般性质 生物碱在中性或酸性溶液中能与许多试剂生成沉淀或发生颜色反应,这些试剂叫做生 物碱试剂,用于检验、分离生物碱。生物碱试剂可分两类: 1.沉淀试剂 它们大多是复盐、杂多酸和某些有机酸,例,碘-碘化御、碘化求御、磷钼酸、硅 钨酸、氯化求、苦味酸和鞣酸等。不同生物碱能与不同的沉淀试剂作用呈不同颜色的沉淀, 某些生物碱与碘-碘化御溶液生成棕红色沉淀:与磷钼酸试剂尘成黄褐色或蓝色沉淀: 与硅钨酸试剂或鞣酸作用生成白色沉淀:与苦味酸试剂或碘化求御试剂作用生成黄色沉淀 等。 2.显色试剂 它们大多是氧化剂或脱水剂,例,高锰酸御、重铬酸御、浓硝酸、浓硫酸、钒酸铵 或甲醛的浓硫酸溶液等。它们能与不同的尘物碱反应产生不同的颜色,重铬酸御的浓硫 酸溶液使吗啡显绿色:浓硫酸使秋水仙碱显黄色:钒酸铵的浓硫酸溶液使莨岩碱显红色, 使吗啡显棕色,而使奎宁显淡橙色。 这些显色剂在色谱分析上常作为生物碱的鉴定试剂。 三、重要的生物碱举例 目前已知的生物碱有数千种,按照它们分子结构的不同,一般将生物碱分为若干类, 川有机胺类、吡咯类、吡啶类、颠茄类、喹啉类、吲哚类、嘌岭类、类和甾体类等。这甲 仪选几个有代表性的生物碱作简单介绍。 1.烟碱 又称尼古丁,是烟草中所含二种生物碱中最多的一种。它山一个吡啶环与一个 四氢吡咯环组成,属于吡啶类生物碱,常以苹果酸盐及柠檬酸盐的形式存在于烟草中。 其结构式为: