
第四章 芳香烃 教学目标: 1,苯的分子结构可着重于分子轨道法的处理结果。 2.用电子效应解释苯环上亲电取代反应的定位规律。 3.讲清芳香结构和芳香性的概念。 4.类化合物的讲解应使学生了解类化合物的异戊二烯规律。甾体化合物的讲授应着重 使学生了解环戊烷多氢菲的基本骨架。 教学重点、难点: 苯分子的结构。苯环上的亲电取代反应及其反应历程。亲电取代反应的定位规律及其应用。 教学方法、手段:讲授、CAI课件辅助教学。 本章学时:4学时

教学内容: 第一节 单环芳烃 一、 苯的结构 苯的分子式为CH6,碳氢数目比为1:1,应具有高度个饱和性。事实则不然,在一般条件 下,苯个能被高锰酸御等氧化剂氧化,也个能与卤素、卤化氢等进行加成反应,但它却容易发 生取代发应。并且苯环具有较高的热稳定性,加热到900℃也不分解。象苯环表现出的对热较稳 定,在化学反应中不易发生加成、氧化反应,而易进行取代反应的特性,被称之为芳香性。 苯具有的特殊性质一芳香性,必然是山于它存在一个特殊的结构所决定的。 1865年,凯库勒(Kekule')提出了苯的环状对称结构式: 简写式 此式称为苯的凯库勒式,碳环是山二个C-C和三个C一C交替排列而成。它可以说明苯分 子的组成及原子相互连接次序,并表明碳原子是四价的,六个氢原子的位臀等同,因而可以解 释苯的一元取代产物只有一种的实验事实。但是凯库勒式个能解释苯环在一般条件下不能发生 类似烯烃的加成、氧化反应:也不能解释苯的邻位二元取代产物只有一种的实验事实。按凯库 勒式推测苯的邻位二元取代产物,应有以下两种: 显然,凯库勒式不能表明苯的真实结构。 近代物理方法测定证明,苯分子中的六个碳原子和六个氢原子都在同一平面上,碳-碳键长 均相等(0.1396m),六个碳原子组成一个正六边形,所有键角均为120°。 H 120} 1200 H 1200 0.1396nm H H 苯分子的结构 现代价键理论认为,苯分子中的碳原子均为sp杂化,每个碳原子的三个p杂化轨道分别 与相邻的两个碳原子的sp杂化轨道和氢原子的轨道重叠形成三个σ键。山于三个sp杂化轨 道都处在同一平面内,所以苯分子中的所有碳原子和氢原子必然都在同一平面内,六个碳原子 形成一个正六边形,所有键角均为120°。另外,每个碳原子上还有一个未参州杂化的p轨道, 这些p轨道的对称轴互相平行,月垂直于苯环所在的平面。p轨道之间彼此重叠形成一个闭合共 轭大π键,闭合共轭大π键电子云呈轮胎状,对称分布在苯环平面的上方和下方。因此J.Thiele 建议用 来表示苯的结构

(a) (b) 苯分子中的p轨道及p轨道重叠形成的闭合共轭大π键示意图 山于六个碳原子完全等同,所以大π键电子云在六个碳原子之间均匀分布,即电子云分布 完全平均化,因此碳-碳键长完全相等,不存在单双键之分。山于苯环共轭大π键的高度离域, 使分子能量大大降低,因此苯环具有高度的稳定性。 苯分子的稳定性可用热化学常数一氢化热来证明。例如,环己烯的氢化热为119.5kJ小·mo H2 119.5 kJ.mol-I 果把苯的结构看成是凯库勒式所表示的环己二烯,它的氢化热应是环己烯的二倍,即为 358.5 kJ*mol",而实际测得苯的氢化热仪为208 kJmol,比358.5 kJmol低150.5kJmo。 这充分说明苯分子不是环己二烯的结构,即分子中不存在二个典型的碳-碳双键。我们把苯和环 己三烯氢化热的差值150.5kJ·mo称为苯的离域能或共轭能。正是山于苯具有离域能,使苯比 环己三烯稳定得多。事实上,环己三烯的结构是根本不可能稳定存在的。 分子轨道理论认为,苯分子中碳原子上未参与杂化的六个P轨道线性组合成六个π分子轨 道,分别以Ψ1、Ψ、平、Ψ、Ψs、Ψ:表示。其中Ψ1、Ψ2、Ψ为成键轨道,Ψ、Ψs、Ψ。 为反键轨道。根据电子填充原则,基态时,苯分子中的六个P电子都填充在二个成键轨道上。 三个成键轨道叠加在一起,其形状似两个轮胎对称的分布在苯环平面的两侧。成键分子轨道的 π电子云高度离域,使分子能量最低,因此苯的结构非常稳定。 反键轨道 原子轨道 ↓2 了成键轨道 图3-3苯的Ⅱ分子轨道和能级 二、单环芳烃的异构和命名 苯是最简单的单环芳烃。单环芳烃包括苯、苯的同系物和苯基取代的不饱和烃。 1.一元烷基苯 一元烷基苯中,当烷基碳链含有三个或二个以上碳原子时,山于碳链的不同会产生同分异 构体。烷基苯的命名,一般是以苯作母体,烷基作取代基,称为“某基苯”,基字可省略。例
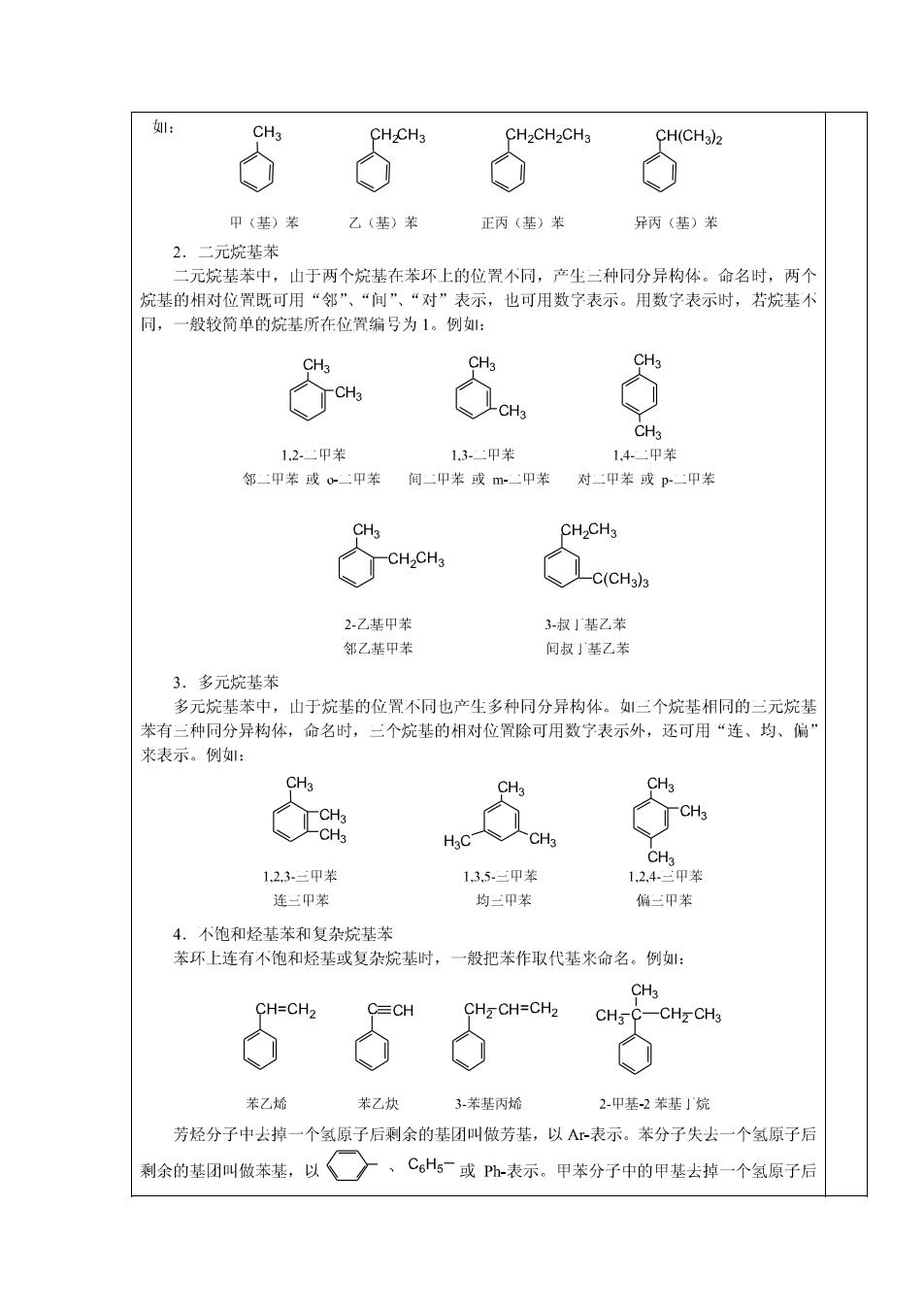
: CH3 CHCH3 CH2CH2CH3 CH(CH3)2 甲(基)苯 乙(基)苯 正丙(基)苯 异丙(基)苯 2.二元烷基苯 二元烷基苯中,山于两个烷基在苯环上的位置不同,产生二种同分异构体。命名时,两个 烷基的相对位置既可用“邻”、“间”、“对”表示,也可用数字表示。用数字表示时,若烷基不 同,一般较简单的烷基所在位置编号为1。例: CH3 CH3 CH3 CH3 CH3 CH3 1.2.甲苯 13-甲苯 1.4-甲苯 邻二甲苯或0二甲苯 间二甲苯或m-二甲苯 对二甲苯或p二甲苯 CH3 CH2CH3 CH2CH3 C(CH3)3 2-乙基甲苯 3-叔」基乙苯 邻乙基甲苯 间叔」基乙苯 3.多元烷基苯 多元烷基苯中,山于烷基的位置不同也产生多种同分异构体。三个烷基相同的三元烷基 苯有二种同分异构体,命名时,二个烷基的相对位置除可用数宁表示外,还可用“连、均、偏” 来表示。例: CH3 CH3 CH3 CH3 -CH3 CH3 CH3 1,23-三甲苯 13,5.甲苯 1.2.4三甲苯 连三甲苯 均三甲苯 偏二甲苯 4.不饱和烃基苯和复杂烷基苯 苯环上连有不饱和烃基或复杂烷基时,一般把苯作取代基来命名。例: CH3 CH=CH2 CHzCH=CH2 CHs C-CHzCH3 苯乙烯 苯乙炔 3苯基丙烯 2甲基-2苯基」烷 芳烃分子中去掉一个氢原子后剩余的基团叫做芳基,以A表示。苯分子失去一个氢原子后 剩余的基团叫做苯基,以 一、C。H或P-表示。甲苯分子中的甲基去掉一个氢原子后

剩余的基团叫卡基或苯甲基,以 CH2或C6H5CH2表示。 三、单环芳烃的物理性质 单环芳烃大多为无色液体,具有特殊气味,相对密度在0.86-0.93之间,不溶于水,易溶于 乙醚、石油醚、乙醇等多种有机溶剂。同时它们本身也是良好的有机溶剂。液体单环芳烃与皮 肤长期接触,会因脱水或脱脂而引起皮炎,使用时要避免与皮肤接触。单环芳烃具有一定的毒 性,长期吸入其蒸气,能损坏造血器官及神经系统,大量使用时应注意防毒。 四、单环芳烃的化学性质 山于苯环上闭合大π键电子云的高度离域,使得苯环非常稳定,在一般条件下大π键难于 断裂进行加成和氧化反应:苯环上大π键电子云分布在苯环平面的两侧,流动性大,易引起亲 电试剂的进攻发尘取代反应。 苯环虫难于被氧化,但苯环上的烃基侧链山于受苯环上大π键的影响,α-氢原子变得很活 泼,易发生氧化反应。同时,α氢原子也易发生卤代反应。 苯环上的闭合共轭大π键虫然很稳定,但它仍然具有一定的不饱和性。因此,在强烈的条 件下,也可发生某些加成反应。 1.取代反应 苯环上的氢原子可以被多种基团取代,其中以卤代、硝化、磺化和傅氏反应较为重要。 (1)卤代反应苯与氯、溴在铁或三卤化铁等催化剂存在下,苯环上的氢原子被氯、溴取 代,生成氯苯和溴苯。 Fe或FeBr3 Br2 55~600C Br HBr 溴苯 卤代仪限于氯代和溴代,卤素的反应活性为:C12>Br2 卤代反应历程大致可分为二步,现以溴代反应为例说明。 ①首先溴分子和三溴化铁作用,生成溴正离子和四溴化铁配离子: Fe Br2 FeBr3 Br-Br FeBr3 Br++FeBr4 ②溴正离子是一个亲电试剂,其进攻富电子的苯环,生成一个不稳定的芳基正离子中间体 (或σ-配合物): 慢 Br ⊙Br 0配合物 这步反应很慢,是决定整个取代反应速度的步骤。在芳基正离子中间体中,原来苯环上的 两个π电子与B生成了C一Br键,余下的四个π电子分布在五个碳原子组成的缺电子共轭体 系中。 ③芳基正离子非常不稳定,在四溴化铁配离子的作用下,迅速脱去一个质子生成溴苯,恢 复到稳定的苯环结构。 Br FeBr3 HBr

上述反应是山亲电试剂(B)进攻神电子的苯环发生的,因此苯环上的取代反应属于亲电 取代反应。 R-C- (2)硝化反应苯与浓硝酸和浓硫酸的混合物共热,苯环上的氢原子被硝基(一NO2)取代 生成硝基苯。 HNO3 浓H2S04 50~600C NO2 H2O 硝基苯 硝基苯为浅黄色油状液体,有苦杏仁味,其蒸气有毒。 在硝化反应中,浓硫酸不仪是脱水剂,而月它与硝酸作用产尘硝基正离子(NO,)。硝基正 离子是一个亲电试剂,进攻苯环发生亲电取代反应。硝化反应历程下: ① HONO2 2H2S04 NO2 H30*+2HSO4 ② 快 ③ NO,+HSO2 NO2 H2SO4 (3)磺化反应 苯与98%的浓硫酸共热,或与发烟硫酸在室温下作用,苯环上的氢原子被 磺酸基(一SOH)取代生成苯磺酸。 H2SO4 S03H+H20 苯磺酸 苯磺酸是一种强酸,易溶于水难溶于有机溶剂。有机化合物分子中引入磺酸基后可增加其 水溶性,此性质在合成染料、药物或洗涤剂时经常应用。 磺化反应是可逆反应,苯磺酸通过热的水蒸汽,可以水解脱去磺酸基。 磺化反应历程一般认为是山三氧化硫中带部分正电荷的硫原子进攻苯环而发生的亲电取代 反应。反应历程下: ① 2H2S04±H3Ot+HS04 S03 ② +S03 慢 S03 SO3+H2SO4 ④ S03+H30*。≥ S03H+H20 (4)傅瑞德尔-克拉夫茨(Friedel-Crafts)反应(简称傅氏反应) 在无水二氯化铝催化 下,苯环上的氢原子被烷基或酰基( )取代的反应,叫做傅氏反应。傅氏反应包括烷基 化和酰基化反应

傅氏烷基化反应中,常用的烷基化试剂为卤代烷,有时也用醇、烯等。常用的催化剂是无 水二氯化铝,此外有时还用三氯化铁、三氟化硼等。 无水A1C3 CH3CH>CI CH2CH3.HCI 0-25°C 傅氏烷基化反应的历程,是无水三氣化铝等路易斯酸与卤代烷作用生成烷基正离子,然后烷 基正离子作为亲电试剂进攻苯环发生亲电取代反应。 R-CI AICl3>R+[AICl4] R .AICla +HCI 三个碳以上的卤代烷进行烷基化反应时,常伴有异构化(重排)现象发生: CH(CH3)2 CH2CH2CH3 CH3CH2CH2Cl 无水AC, 异丙苯(6569%) 正丙苯(31-35%? 这是山于尘成的一级烷基正碳离子易重排成史稳定的二级烷基正碳离子。因此,发生取代反 应时,异构化产物多于非异构化产物。史高级的卤代烷在苯环上进行烷基化反应时,将会存在史 为复杂的异构化现象。傅氏烷基化反应通常难以停州在一元取代阶段。要想得到一元烷基苯,必 须使用过量的芳烃。傅氏酰基化反应常用的酰基化试剂为酰氯或酸惭。 CH3 HCI 苯乙制 无水ANC CH3 CH3COOH CH3- 傅氏酰基化反应的历程: ① e是。Ae一ar2.Re 0·c&=[Ow] H ③ CHa+AICls+HCI
酰基化反应不发生异构化,也不会发生多元取代。当苯环上连有强吸电子基硝基、羰基 时,苯环上的电子云密度大大降低,不发生酰基化反应。 2.苯同系物侧链的卤代反应 在紫外光照射或高温条件下,苯环侧链上的氢易被卤素(氯或溴)取代。侧链为两个或两 个碳以上的烷基时,卤代反应主要发生在α-碳原子上。 CH3 CH2CI CHCl2 光照 Cl2 Cl2 Cl2 或高温 光照或高温 光照或扁温 氯化卡 苯氯甲烷 苯二氯甲烷 CH2CH3 CH-CHCH3 CH2CHCI + Cl2 光 或高温 4-氯代乙苯 B-氯代乙苯 91% 9% 苯环侧链的卤代反应与烷烃的卤代反应一样,属于游离基反应。 若苯的同系物与卤素在铁或二卤化铁存在下作用,则卤代反应发生在苯环上(属于亲电取 代反应),日主要取代侧链邻位和对位上的氢。 CH2CH3 CH2CH3 CH2CH3 Cl2 Fe CI 或FeCl3 CI 邻氯乙苯 对氯乙苯 3.氧化反应 苯环不易被氧化,而苯环上的侧链却易被氧化。常用的氧化剂有高锰酸御、重铬酸御、稀 硝酸等。不论侧链长短,氧化反应总是发生在α一碳原子上,α-碳原子被氧化成羧基。 CH3 COOH KMnO/H △ 苯甲酸 CH3 COOH KMnO/H CH2CH3 △ COOH 间苯二甲酸 但是,若侧链的ā-碳原子上无氢原子,侧链不能被氧化

CH3 COOH KMnO/H+ △ C(CH3)3 C(CH3)3 在制烈的条件下,苯环可被氧化生成顺丁烯二酸酐。 V205 H-C 902 400~50产2 + 4C02+4H20 顺」烯酸酐 4.加成反应 苯环虫然比较稳定,但在特定条件下,如催化剂、高温、高压、或光照,也可发生某些加 成反应,加氢、加卤素等,表现出一定的不饱和性。但苯环的加成不会停在环己二烯或环 己烯的阶段,说明苯比环己二烯和环己烯都稳定。 3H2 Ni加压 环已烷 180-250-己 光 C 3Cl2 或紫外线 六氯环己烷 苯环上加氢、州卤素属于游离基型的加成反应。 五、苯环上亲电取代反应的定位规律 1.定位规律 当苯环上有一取代基时,再进行取代反应,理论上得到邻、间、对二种二元取代物的比例 应为2:2:1(因为有两个邻位、两个间位、一个对位)。然而实验事实并非如此,得到的二 元取代物往往仪有一种或两种的比例较高,为主要产物。例如甲苯进行硝化反应时,硝基主要 进入甲基的邻位和对位,并且该硝化反应比苯容易。 CH3 CH3 CH3 CH HNO3 H2S04 NO 30C NO NO2 邻硝钾苯 对硝某甲苯间硝基甲恭 63% 34% 3% 而硝基苯再进行硝化反应时, NO2 硝基主要进入原硝基的间位,并该硝化反应比苯困难。 NO2 NO2 HNO3 H2S04 95C NO NO2 间硝基苯 邻二硝基苯 对二硝基苯 93% 6.5% 0.5%

上述实验事实说明,苯环上已有的取代基不仪影响第二个取代基进入苯环的难易,而月还 影响共进入苯环的位置。我们把苯环上原有取代基的这种作用,称为苯环上亲电取代反应的定 位效应,苯环上原有的取代基称为定位基。 根据大量的实验事实,将定位基分为以下两大类: (1)邻、对位定位基这类定位基能使苯环活化,即第二个取代基的进入比苯容勿(卤素 除外),第二个取代基主要进入它的邻位和对位。常见的邻、对位定位基(定位能力山强到弱排 列)有: O°、N(CH3)2、NH2、OH、OCH3、NHCOCH3、-OCOCH3、 -CH3-R)、一X(Cl、Br、I)等 邻、对位定位基的结构特点是,与苯环直接相连的原子带负电荷,或带有未共用电子对, 或是饱和原子(-CC1,和-CF除外)。 (2)间位定位基这类定位基能使苯环钝化,即第二个取代基的进入比苯困难,同时使第 二个取代基主要进入它的间位。常见的间位定位基(定位能力山强到弱排列)有: H3、N(CH33、NO2、C=N、SO3H、CHO、-COR、COOH、CONH2等 般讲,间位定位基的结构特点是,与苯环直接相连的原子带正电荷,或以重键与电负性 较强的原子相连接。 2.对定位规律的解释 在苯分子中,苯环闭合大π键电子云是均匀分布的,即六个碳原子上电子云密度等同。当 苯环上有一取代基后,取代基可以通过诱导效应或共轭效应使苯环上电子云密度升高或降低, 同时影响到苯环上电子云密度的分布,使各碳原子上电子云密度发生变化。因此,进行亲电取 代反应的难易以及取代基进入苯环的主要位置,会随原有取代基的不同而不同。下面以几个典 型的定位基为例作简要解释。 (1)邻、对位位定位基一般来说它们是供电子基(卤素除外),为致活基团,可以通过 Ⅱ共轭效应或+1效应向苯环提供电子,使苯环上电子云密度增加,尤其在邻、对位上增加较多。 因此取代基主要进入邻、对位。 ①甲基甲苯中的甲基碳原子为sp杂化,苯环中碳原子为s杂化,sp杂化的碳原子的 电负性弱于sp杂化的碳原子,因此甲基可通过+I效应向苯环提供电子。同时甲基的三个CH 0键与苯环的π键有很小程度的重叠,形成0-π共轭体系(也称超共轭体系),0-π共轭体系 产生的超共轭效应使C一H键。电子云向苯环转移。显然,甲基的+效应和。-π超共轭效应均 使苯环上电子云密度增加,山于电子共轭传递的结果,使甲基的邻、对位上增加的较多。所以, 甲苯的亲电取代反应不仪比苯容易,而月主要发生在甲基的邻位和对位。 诱导效应(+I) 超共轭效应 ②羟基羟基是一个较强的邻、对位定位基。山于羟基中氧的电负性比碳的电负性强,对 苯环表现出吸电子诱导效应(-I),使苯环电子云密度降低。但又山于羟基氧原子上ρ轨道上的 未共用电子对可以与苯环上的π电子云形成Dπ共轭体系,使氧原子上的电子云向苯环转移