
基础无机化学实验 化学化工学院 实验中心
1 基础无机化学实验 化 学 化 工 学 院 实 验 中 心

目录 1化学反应速度、反应级数和活化能的测定 2弱电解质电离常数的测定 ..5 3氧化还原与电化学. 8 4银氨配离子配位数的测定.13 5磺基水杨酸合铜配合物的组成及其稳定常数的测定 17 6硫酸亚铁铵的制备和性质 .21 7三草酸合铁酸钾的制备和性质 25 8硫代硫酸钠的制备.… .30 9水溶液中Na+、K+、NH4+、Mg2+、Ca2+、Ba2+等离子的分离和检出31 10P区元素重要化合物的性质 .….35 11DS区重要元素化合物的性质 43 12水溶液中Ag、Pb2+、Hg2+、C2+、B+、Z2+等离子的分离和检出.47 13D区元素重要化合物的性质… 54 14水溶液中Fe3+、C02+、N2+、M+、A1+、Cr3+、Zn2+等离子的分离和检出59 15阴离子定性分析 .63
2 目 录 1 化学反应速度、反应级数和活化能的测定............................................................1 2 弱电解质电离常数的测定........................................................................................5 3 氧化还原与电化学....................................................................................................8 4 银氨配离子配位数的测定......................................................................................13 5 磺基水杨酸合铜配合物的组成及其稳定常数的测定..........................................17 6 硫酸亚铁铵的制备和性质......................................................................................21 7 三草酸合铁酸钾的制备和性质...............................................................................25 8 硫代硫酸钠的制备..................................................................................................30 9 水溶液中 Na +、K+、NH4 +、Mg 2+、Ca 2+、Ba 2+等离子的分离和检出..............31 10 P 区元素重要化合物的性质 .................................................................................35 11 DS 区重要元素化合物的性质...............................................................................43 12 水溶液中 Ag +、Pb 2+、Hg 2+、Cu 2+、Bi 3+、Zn 2+等离子的分离和检出............47 13 D 区元素重要化合物的性质..............................................................................54 14 水溶液中 Fe 3+、Co 2+、Ni 2+、Mn 2+、Al 3+、Cr 3+、Zn 2+等离子的分离和检出59 15 阴离子定性分析....................................................................................................63

1化学反应速度、反应级数和活化能的测定 1.1教学目的及要求 1、了解浓度、温度和催化剂对反应速度的影响: 2、测定过二硫酸铵与碘化钾反应的平均反应速度、反应级数、速度常数和 活化能: 3、练习依据实验数据作图,计算反应级数,反应速度常数。 1.2预习与思考 1.预习化学反应速度理论以及浓度、温度和催化剂对反应速度的影响等有 关内容。 2.思考下列问题: 1)在向KI、淀粉和Na2S2O3混合溶液中加入NH42S2Os时,为什么必须越 快越好? 2)在加入NH4)2S2Og时,先计时后搅拌或者先搅拌后计时,对结果各有何 影响? 1.3实验提要 测反应速率 在水溶液中,NH42S2O8与KI发生如下反应: (NH4)2 S2O8+3KI==(NH4)2S04 +K2S04+KI3 离子反应方程式为: S20g2+3==2S042-+13 (1) y=AIS2O1=k [S2Os- 式中,△S20g2]为S2O82在△t时间内物质的量浓度的改变值,[S2O82-]、 分别为两种离子初始浓度(mol·Ll),k为反应速度常数,m和n为反应级数。 为了能够测定N2S2O3溶液和作为指示剂的淀粉溶液,这样在反应(1)进行 的同时,也进行着如下的反应: 2S2032-+I3==S4062.+3I (2) 反应(2)进行得非常快,几乎瞬间完成,而反应(1)却慢的多,所以由反
1 1 化学反应速度、反应级数和活化能的测定 1.1 教学目的及要求 1、了解浓度、温度和催化剂对反应速度的影响; 2、测定过二硫酸铵与碘化钾反应的平均反应速度、反应级数、速度常数和 活化能; 3、练习依据实验数据作图,计算反应级数,反应速度常数。 1.2 预习与思考 1. 预习化学反应速度理论以及浓度、温度和催化剂对反应速度的影响等有 关内容。 2. 思考下列问题: 1)在向 KI、淀粉和 Na2S2O3 混合溶液中加入(NH4)2S2O8 时,为什么必须越 快越好? 2)在加入(NH4)2S2O8 时,先计时后搅拌或者先搅拌后计时,对结果各有何 影响? 1.3 实验提要 测反应速率 在水溶液中,(NH4)2S2O8与 KI 发生如下反应: (NH4)2 S2O8 + 3KI === (NH4)2SO4 + K2SO4 + KI3 离子反应方程式为: S2O8 2- + 3I - === 2 SO4 2- + I3 - (1) ν =- 2 2 8 [S O ] t − = k [S2O8 2- ] m [I- ] n 式中,Δ[S2O8 2- ] 为 S2O8 2-在 Δt 时间内物质的量浓度的改变值,[S2O8 2- ]、[I- ] 分别为两种离子初始浓度(mol·L -1),k 为反应速度常数,m 和 n 为反应级数。 为了能够测定 Na2S2O3 溶液和作为指示剂的淀粉溶液,这样在反应(1)进行 的同时,也进行着如下的反应: 2S2O3 2- + I3 - === S4O6 2- + 3I- (2) 反应(2)进行得非常快,几乎瞬间完成,而反应(1)却慢的多,所以由反

应(1)生成的立刻与S2O2作用生成无色的S4O62和,因此在反应开始阶段, 看不到碘与淀粉作用显示出来的特有蓝色。但是一旦N2S2O3耗尽,反应(1) 继续生成的微量I:立即使淀粉溶液呈现特有的蓝色。所以蓝色的出现就标志着 反应(2)的完成。 从反应方程式(1)和(2)的计量关系可以看出,S2O82浓度减少的量等于 S2032-减少量的一半,即 4S,0=4S,0 2 由于S2O32在溶液显示蓝色时己全部耗尽,所以△S2O32]实际上就是反应开 始时N2S2O,的初始浓度。因此,只要记下从反应开始到溶液出现蓝色所需要的 时间△,就可以就算反应(1)的平均反应速度.AS,0] △ 在固定[S2O2],改变S2Og2]和的条件下进行一系列实验,测得不同条件 下的反应速度,就能根据v=k[S2Og2]m]”的关系推出反应的反应级数。 再由下式可进一步求出反应速度常数k k= [S202[UW 根据阿雷尼乌斯公式,反应速度常数k与反应温度有如下关系: Lgk=-Ea/2.303RT+IgA 式中,E为反应的活化能,R为气体常数,T为绝对温度。因此,只要测 得不同温度时的k,以gk对1/T作图可得一直线,由直线的斜率可求得反应的 活化能Ea: 斜率=-Ea2.303R 1.4实验用品 仪器:烧杯、大试管、量筒、秒表、温度计。 液体试剂:NH42S2Os(0.20mol·Ll)、KI(0.20mol·L-l)、Na2S2O3 (0.010mol·L1)、KN03(0.20mol·L)、NH4)2S04(0.20mol·Ll)、 CuNO32(0.02mol·Ll)、淀粉溶液0.2%(m)。 1.5实验内容
2 应(1)生成的 - 3 I 立刻与 S2O3 2-作用生成无色的 S4O6 2-和 I -,因此在反应开始阶段, 看不到碘与淀粉作用显示出来的特有蓝色。但是一旦 Na2S2O3 耗尽,反应(1) 继续生成的微量 - 3 I 立即使淀粉溶液呈现特有的蓝色。所以蓝色的出现就标志着 反应(2)的完成。 从反应方程式(1)和(2)的计量关系可以看出,S2O8 2-浓度减少的量等于 S2O3 2-减少量的一半,即 2- 2- 2 3 2 8 [S O ] [S O ]= 2 由于 S2O3 2-在溶液显示蓝色时已全部耗尽,所以 Δ[S2O3 2- ]实际上就是反应开 始时 Na2S2O3 的初始浓度。因此,只要记下从反应开始到溶液出现蓝色所需要的 时间 Δt,就可以就算反应(1)的平均反应速度- 2 2 8 [S O ] t − 。 在固定[S2O3 2- ],改变[S2O8 2- ]和[I- ]的条件下进行一系列实验,测得不同条件 下的反应速度,就能根据 ν = k [S2O8 2- ] m [I - ] n 的关系推出反应的反应级数。 再由下式可进一步求出反应速度常数 k 2 2 8 [ ] [ ] m n k S O I v − − = 根据阿雷尼乌斯公式,反应速度常数 k 与反应温度有如下关系: Lgk=-Ea/2.303RT + lgA 式中,Ea 为反应的活化能,R 为气体常数,T 为绝对温度。因此,只要测 得不同温度时的 k,以 lgk 对 1/T 作图可得一直线,由直线的斜率可求得反应的 活化能 Ea: 斜率 = -Ea/2.303R 1.4 实验用品 仪器:烧杯、大试管、量筒、秒表、温度计。 液 体 试 剂 : (NH4)2S2O8(0.20mol·L -1 ) 、 KI ( 0.20mol·L -1 )、 Na2S2O3 ( 0.010mol·L -1 ) 、 KNO3(0.20mol·L -1 ) 、 (NH4)2SO4(0.20mol·L -1 ) 、 Cu(NO3)2(0.02mol·L -1 )、淀粉溶液 0.2%(m)。 1.5 实验内容

1浓度对化学反应速度的影响。 室温下按下表各溶液用量进行实验。先分别量取KI、淀粉、Na2S2O3溶液于 150mL烧杯中,用玻璃棒搅拌均匀。再量取NH42S2O8溶液,迅速加到烧杯中, 同时按动秒表,立刻用玻璃棒将溶液搅拌均匀。观察溶液,刚一出现蓝色,立即 停止计时。记录反应时间。 室温 实验编号 I IV 0.20mol/L (NH4)2S208 20 10 5.0 20 20 0.20 mol/L KI 20 20 20 10 5.0 试剂用量 0.010mol/L Na2S203 8.0 8.0 8.0 8.0 8.0 mL 0.2g/dm3淀粉溶液 4.0 4.0 4.0 4.0 4.0 0.20 mol/L KNO3 0 0 0 10 15 0.20mol/L (NH4)2SO4 0 10 15 0 0 混合液中 (NH4)2S2Os 反应的起 KI 始始浓度 Na2S203 mol/L 反应时间△s S2Og2-的浓度变化△Cs2og2mol/L 反应速率v 为了使溶液的离子强度和总体积保持不变,在实验编号2~5中所减少的KI 或NH4)2S2Og的量分别用KNO3和NH4)2SO4溶液补充。 2温度对化学反应速度的影响: 按上表实验V的药品用量分别加入KI、淀粉、Na2S2O3和KNO3溶液于150 mL烧杯中,用玻璃棒搅拌均匀。在一个大试管中加入NH42S2Os溶液,将烧杯 和试管中的溶液控制温度在283K的条件下,把试管中的NH42S2Og迅速倒入烧 杯中,搅拌,记录反应时间和温度。 分别在293K、303K和313K的条件重复上述实验,记录反应时间和温度。 在(1)高于室温:(2)高于室温10℃:(3)低于室温10℃的条件下进行实验
3 1 浓度对化学反应速度的影响。 室温下按下表各溶液用量进行实验。先分别量取 KI、淀粉、Na2S2O3 溶液于 150 mL 烧杯中,用玻璃棒搅拌均匀。再量取(NH4)2S2O8 溶液,迅速加到烧杯中, 同时按动秒表,立刻用玻璃棒将溶液搅拌均匀。观察溶液,刚一出现蓝色,立即 停止计时。记录反应时间。 室温 ℃ 实验编号 Ⅰ Ⅱ Ⅲ Ⅳ Ⅴ 试剂用量 mL 0.20mol/L (NH4)2S2O8 20 10 5.0 20 20 0.20 mol/L KI 20 20 20 10 5.0 0.010mol/L Na2S2O3 8.0 8.0 8.0 8.0 8.0 0.2g/dm3 淀粉溶液 4.0 4.0 4.0 4.0 4.0 0.20 mol/L KNO3 0 0 0 10 15 0.20mol/L (NH4)2SO4 0 10 15 0 0 混合液中 反应的起 始始浓度 mol/L (NH4)2S2O8 KI Na2S2O3 反应时间△t/s S2O8 2-的浓度变化△C S2O8 2- /mol/L 反应速率 v 为了使溶液的离子强度和总体积保持不变,在实验编号 2~5 中所减少的 KI 或(NH4)2S2O8的量分别用 KNO3和(NH4)2SO4溶液补充。 2 温度对化学反应速度的影响: 按上表实验Ⅳ的药品用量分别加入 KI、淀粉、Na2S2O3 和 KNO3 溶液于 150 mL 烧杯中,用玻璃棒搅拌均匀。在一个大试管中加入(NH4)2S2O8 溶液,将烧杯 和试管中的溶液控制温度在 283K 的条件下,把试管中的(NH4)2S2O8 迅速倒入烧 杯中,搅拌,记录反应时间和温度。 分别在 293K、303K 和 313K 的条件重复上述实验,记录反应时间和温度。 在⑴高于室温;⑵高于室温 10℃;⑶低于室温 10℃的条件下进行实验

实验编号 I IV Ⅶ 反应温度/℃ 反应时间△s 反应速率v 3催化剂对反应速度的影响。 按实验V药品用量进行实验,在NH4)2S2Og溶液加入KI混合液之前,先在 KI混合液中加入2滴CuNO32(0.02mol/L)溶液,搅匀,迅速加入NH42S2Os溶 液,搅拌,记录反应时间。 记录和结果 一、列表记录实验数据。 二、分别计算编号1~5号各个实验的平均反应速度,然后求反应级数和速度 常数k。 三、分别计算四个不同温度实验的平均反应速度以及速度常数k,然后以gk 为纵坐标,1T为横坐标作图,求活化能。 四、根据实验结果讨论浓度、温度、催化剂对反应速度及速度常数的影响。 1.6思考题 1.实验中为什么可以由反应溶液出现蓝色时间的长短来计算反应速度?反应 溶液出现蓝色后,S2O82与的反应是否就终止了? 2.若不用S2Og2而用的浓度变化来表示反应速度,则反应速度常数是否一 致?具体说明。 3.下述情况对实验有何影响? (1)移液管混用。 (2)先加NH4)2S2Os溶液,最后加KI溶液。 (3)往KI等混合液中加NH4)2S2Os溶液时,不是迅速而是慢慢加入。 (4)做温度对反应速度的影响实验时,加入NH42S2Os后将盛有反应溶液的 容器移出恒温水浴反应
4 实验编号 Ⅵ Ⅳ Ⅶ 反应温度 t/℃ 反应时间△t/s 反应速率 v 3 催化剂对反应速度的影响。 按实验Ⅳ药品用量进行实验,在(NH4)2S2O8 溶液加入 KI 混合液之前,先在 KI 混合液中加入 2 滴 Cu(NO3)2 (0.02mol/L)溶液,搅匀,迅速加入(NH4)2S2O8 溶 液,搅拌,记录反应时间。 记录和结果 一、列表记录实验数据。 二、分别计算编号 1~5 号各个实验的平均反应速度,然后求反应级数和速度 常数 k。 三、分别计算四个不同温度实验的平均反应速度以及速度常数 k,然后以 lgk 为纵坐标,1/T 为横坐标作图,求活化能。 四、根据实验结果讨论浓度、温度、催化剂对反应速度及速度常数的影响。 1.6 思考题 1.实验中为什么可以由反应溶液出现蓝色时间的长短来计算反应速度?反应 溶液出现蓝色后,S2O8 2-与 I -的反应是否就终止了? 2. 若不用 S2O8 2-而用 I -的浓度变化来表示反应速度,则反应速度常数是否一 致?具体说明。 3. 下述情况对实验有何影响? (1)移液管混用。 (2)先加(NH4)2S2O8溶液,最后加 KI 溶液。 (3)往 KI 等混合液中加(NH4)2S2O8溶液时,不是迅速而是慢慢加入。 (4)做温度对反应速度的影响实验时,加入(NH4)2S2O8 后将盛有反应溶液的 容器移出恒温水浴反应

2弱电解质电离常数的测定 2.1实验目的 1.测定醋酸的电离常数,加深对电离度和电离常数的理解: 2.学会酸度计的使用方法。 2.2预习与思考 1.查阅资料预习雷磁25型酸度计的使用说明 2.思考下列问题: 1)在醋酸溶液的平衡体系中,未电离的醋酸、醋酸根离子和氢离子的浓度 是如何获得的? 2)在测定同一种电解质溶液的不同pH值时,测定的顺序为什么要由稀到 浓? 3)用pH计测定溶液的pH值时,怎样正确使用玻璃电极? 2.3预备知识 在水溶液中仅能部分电离的电解质称为弱电解质。弱电解质的电离平衡时可 逆过程,当正逆两过程速度相等,分子和离子之间就达到动态平衡,这种平衡称 为电离平衡。一般只有设法测定平衡时各物质的浓度(或分压)便可求得平衡常 数。通常测定平衡常数的方法有目测法,pH值法,电导率法,电化学法和分光 光度法等,本实验通过pH值测定醋酸的电离电离常数和电离度。 2.4基本原理 醋酸(HAc)是弱电解质,在水溶液中存在下列离解平衡: HAc产H+Ac 起始时 0 0 平衡时 c-ca ca ca 根据化学平衡原理,生成物浓度乘积与反应物浓度乘积之比为一常数,即 Ki=C(H)C(Ac-) C(HAc) 式中K即为醋酸的离解常数
5 2 弱电解质电离常数的测定 2.1 实验目的 1.测定醋酸的电离常数,加深对电离度和电离常数的理解; 2.学会酸度计的使用方法。 2.2 预习与思考 1.查阅资料预习雷磁 25 型酸度计的使用说明 2.思考下列问题: 1)在醋酸溶液的平衡体系中,未电离的醋酸、醋酸根离子和氢离子的浓度 是如何获得的? 2) 在测定同一种电解质溶液的不同 pH 值时,测定的顺序为什么要由稀到 浓? 3) 用 pH 计测定溶液的 pH 值时,怎样正确使用玻璃电极? 2.3 预备知识 在水溶液中仅能部分电离的电解质称为弱电解质。弱电解质的电离平衡时可 逆过程,当正逆两过程速度相等,分子和离子之间就达到动态平衡,这种平衡称 为电离平衡。一般只有设法测定平衡时各物质的浓度(或分压)便可求得平衡常 数。通常测定平衡常数的方法有目测法,pH 值法,电导率法,电化学法和分光 光度法等,本实验通过 pH 值测定醋酸的电离电离常数和电离度。 2.4 基本原理 醋酸(HAc)是弱电解质,在水溶液中存在下列离解平衡: 起始时 c 0 0 平衡时 c-cα cα cα 根据化学平衡原理,生成物浓度乘积与反应物浓度乘积之比为一常数,即 + _ C(H )C(Ac ) Ki = C(HAc) 式中 Ki 即为醋酸的离解常数

将平衡时各物质的浓度代入上式,得 K=Ca/(1-a) 式中 c为HAc的起始浓度; α为醋酸的电离度。 根据离解度的定义,平衡时已离解的分子数占原有分子总数的百分数称作离 解度a,即=H]/c。因此,如果由实验测出醋酸溶液的pH值,即可求出H] 一一pH=gH],再由上式求出a,并由实验测出醋酸的离解常数Ki。 2.5仪器和药品 容量瓶(50mL),移液管(25mL,10mL),碱式滴定管(50mL),锥形 瓶(250mL),雷磁25型酸度计 NaOH0.2000mo1·L),HAc(0.2mol·L) 2.6实验步骤 1.不同浓度的醋酸溶液配制 用滴定管分别准确量取25.00mL、5.00mL、2.50mL已标定过的HAc溶液 于50mL容量瓶中,用蒸馏水稀释至刻度,摇匀,并分别计算出各溶液的准确浓 度。 2.不同浓度的醋酸溶液的pH值测定 取四个干燥的小烧杯(50mL),分别取约30mL上述三种浓度的HAc溶液 及未经稀释的HAc溶液,由稀到浓分别用酸度计测其pH值。 记录和结果 1.以表格形式列出实验数据,并计算电离常数Ki及电离度α。 2.根据实验结果讨论HAc电离度与其浓度的关系。 实验时的温度℃ 6
6 将平衡时各物质的浓度代入上式,得 K i=Cα 2 /(1-α) 式中 c 为 HAc 的起始浓度; α 为醋酸的电离度。 根据离解度的定义,平衡时已离解的分子数占原有分子总数的百分数称作离 解度 α,即 α= [H+ ]/c 。因此,如果由实验测出醋酸溶液的 pH 值,即可求出[H+ ] ——pH=-lg[H+ ],再由上式求出 α,并由实验测出醋酸的离解常数 Ki。 2.5 仪器和药品 容量瓶(50 mL),移液管(25mL,10mL),碱式滴定管(50mL),锥形 瓶(250mL),雷磁 25 型酸度计 NaOH(0.2000 mol·L -1 ),HAc(0.2 mol·L -1 ) 2.6 实验步骤 1.不同浓度的醋酸溶液配制 用滴定管分别准确量取 25.00 mL、5.00 mL、2.50 mL 已标定过的 HAc 溶液 于 50mL 容量瓶中,用蒸馏水稀释至刻度,摇匀,并分别计算出各溶液的准确浓 度。 2. 不同浓度的醋酸溶液的 pH 值测定 取四个干燥的小烧杯(50 mL),分别取约 30mL 上述三种浓度的 HAc 溶液 及未经稀释的 HAc 溶液,由稀到浓分别用酸度计测其 pH 值。 记录和结果 1. 以表格形式列出实验数据,并计算电离常数 Ki 及电离度 α。 2. 根据实验结果讨论 HAc 电离度与其浓度的关系。 实验时的温度_____℃
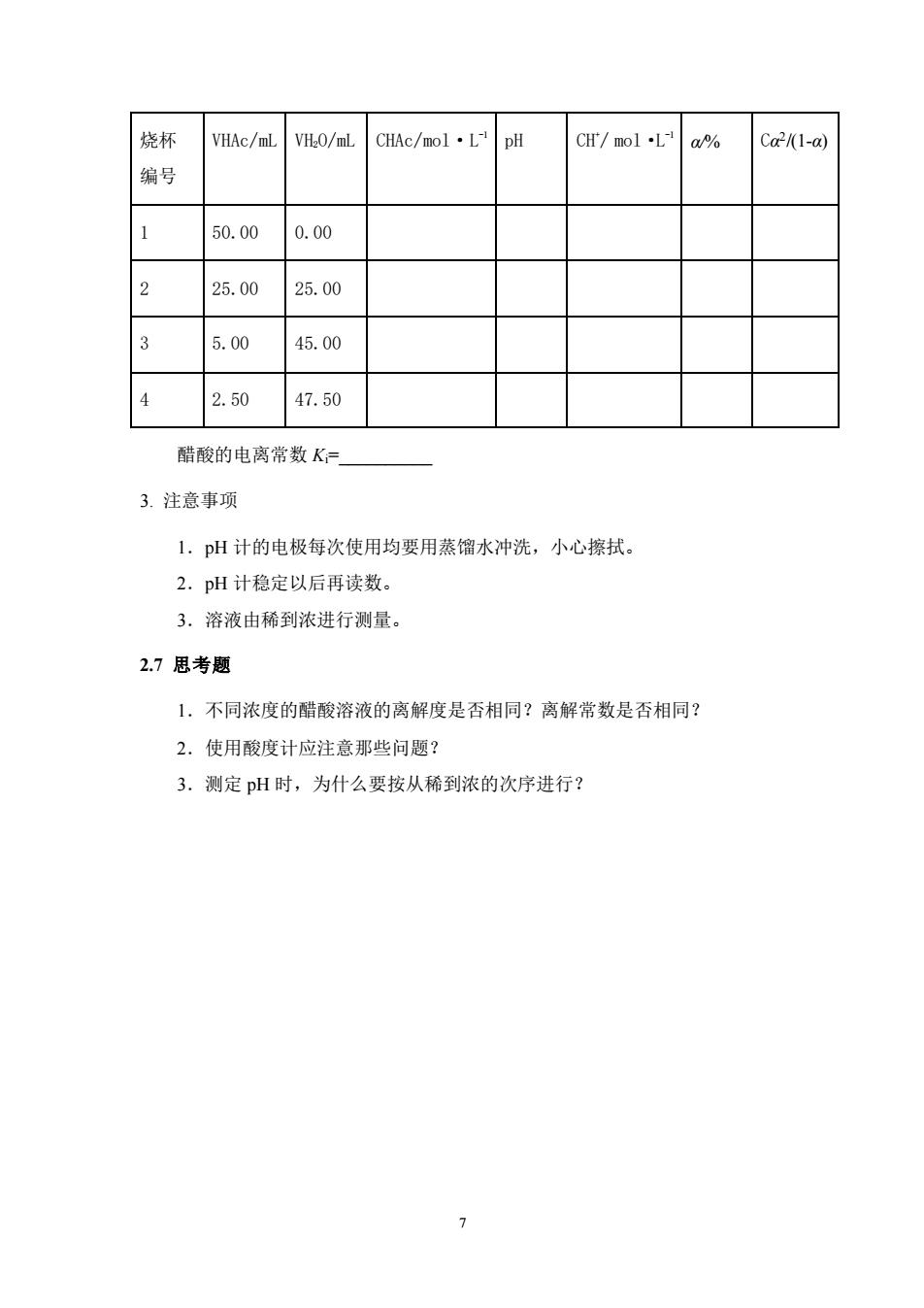
烧杯 VHAc/mL VH2O/mL CHAc/mol·L pH CH'/mol L a/% Ca/(1-a) 编号 1 50.00 0.00 2 25.00 25.00 3 5.00 45.00 4 2.50 47.50 醋酸的电离常数K= 3.注意事项 1.pH计的电极每次使用均要用蒸馏水冲洗,小心擦拭。 2.pH计稳定以后再读数。 3.溶液由稀到浓进行测量。 2.7思考题 1.不同浓度的醋酸溶液的离解度是否相同?离解常数是否相同? 2.使用酸度计应注意那些问题? 3.测定pH时,为什么要按从稀到浓的次序进行? >
7 烧杯 编号 VHAc/mL VH2O/mL CHAc/mol·L -1 pH CH+ / mol·L -1 α/% Cα 2 /(1-α) 1 50.00 0.00 2 25.00 25.00 3 5.00 45.00 4 2.50 47.50 醋酸的电离常数 Ki=__________ 3. 注意事项 1.pH 计的电极每次使用均要用蒸馏水冲洗,小心擦拭。 2.pH 计稳定以后再读数。 3.溶液由稀到浓进行测量。 2.7 思考题 1.不同浓度的醋酸溶液的离解度是否相同?离解常数是否相同? 2.使用酸度计应注意那些问题? 3.测定 pH 时,为什么要按从稀到浓的次序进行?

3氧化还原与电化学 3.1实验目的 1.了解原电池的组成及其电动势的粗略测定: 2.认识浓度、介质的酸碱性对氧化还原的影响: 3.认识一些中间价态物质的氧化还原性; 4.了解电化学腐蚀的基本原理及其防止的方法。 3.2实验原理 1.原电池组成和电动势 利用氧化还原反应产生电流的装置叫做原电池。 原电池负极Zn-2e=Zn2 氧化反应 正极Cu2++2e=Cu 还原反应 正负极间必须用盐桥连接。 原电池电动势E应为 E=p正-p负 2.浓度、介质对电极电势和氧化还原反应的影响 (1)浓度对电极电势的影响 例如:Zn-2e=Zn oZn/ZnZnn+059 gc(Zn) 2 (2)介质的酸碱性对电极电势的影响 例如: (aC10;+6H+6efC+3H,0 0°=1.45V Rwom+2g”saC02e1cHy [c(C1-)/c] (b)Mn0,+8H+5efMn2++4H,0 0.059 1g lc(MnO )/ec() 5 [c(Mn2+)/c] (c)MnO +2H,O+3ef MnO(s)+40H- 0059 glc(MnD 3[c(OH)1c] (dMnO+e隧命MnO
8 3 氧化还原与电化学 3.1 实验目的 1. 了解原电池的组成及其电动势的粗略测定; 2. 认识浓度、介质的酸碱性对氧化还原的影响; 3.认识一些中间价态物质的氧化还原性; 4. 了解电化学腐蚀的基本原理及其防止的方法。 3.2 实验原理 1. 原电池组成和电动势 利用氧化还原反应产生电流的装置叫做原电池。 原电池负极 Zn – 2e = Zn2+ 氧化反应 正极 Cu2+ + 2e = Cu 还原反应 正负极间必须用盐桥连接。 原电池电动势 E 应为 E = 正 - 负 2. 浓度、介质对电极电势和氧化还原反应的影响 (1)浓度对电极电势的影响 例如:Zn – 2e = Zn2+ 2 2 2 0.059 Zn / Zn Zn / Zn lgc(Zn ) 2 + + + = + (2)介质的酸碱性对电极电势的影响 例如: (a) C1O 6H 6e C1 3H O 3 2 − + − + + + ƒ 1.45V = 3 3 θ θ 6 θ 3 C1O / C1 C1O / C1 θ 0.059 [c(C1O ) / c ][c(H ) / c ] 1g 6 [c(C1 ) / c ] − − − − − + − = + (b) 2 MnO 8H 5e Mn 4H O 4 2 − + + + + + ƒ 2 2 4 4 8 4 MnO / Mn MnO / Mn 2 0.059 [c(MnO ) / c ][c(H ) / c ] 1g 5 [c(Mn ) / c ] − + − + − + + = + (c) MnO 2H O 3e MnO (s) 4OH 4 2 2 − − + + + ƒ 4 2 MnO / MnO 4 2 4 MnO / MnO 4 0.059 [c(MnO ) / c ] 1g 3 [c(OH ) / c ] − − − − = + (d) ( ) 2 MnO MnO 4 4 e − − + ⎯⎯⎯⎯ ⎯⎯⎯⎯→ 强碱介质