
第八章 醛酮醌 教学目标: 1,讲解羰基的结构和亲核加成及其历程,并结合各个反应的实际意义,说明在分析、鉴 定、合成及生物化学反应中的应用。 2.α-碳上的取代涉及在酸碱催化下,碳负离子及烯醇中间体的形成.应该讲解通过共轭酸 或共轭碱中间体的酮式烯醇式互变平衡。 3.羟醛缩合反应及其在生化反应过程中的重要意义,可重点加以说明。 教学重点、难点: 羰基的结构和亲核加成及其历程。 教学方法、手段:讲授、CAI课件辅助教学。 本章学时:3学时
教学内容: 醛、酮、醌分子中含有官能团羰基 ,故称为羰基化合物。 羰基和两个烃基相连的化合物叫做酮,全少和一个氢原子相连的化合物叫做醛,可用通 式表示为: (HDR一CHAr一C—H 惊 酮分子中的羰基称为酮基。醛分子中的 &-H 称为醛基,醛基可以简与为一CHO,但不能 与成-C0州。还有另一类特殊的不饱和环状二酮,称为醌,例如: 醌 羰基化合物广泛存在于自然界,它们既是参与生物代谢过程的重要物质,甘油醛 (HOCH-CHOHCHO)和丙丽酸(HOOCCOCH)是细胞代谢作用的基本成分,又是有机合成的重要原料 和中间体。 第一节醛、酮 醛、酮的分类和命名 1.醛、酮的分类 根据羰基所连烃基的结构,可把醛、酮分为脂肪族、脂环族和芳香族醛、酮等几类。例: CHCCH3 CHO CH3CHO -C-CH3 0 O 脂肪醛 脂肪制 脂环制 芳香醛 芳香铜 根据羰基所连烃基的饱和程度,可把醛、 酮分为饱和与不饱和醛、酮。例: CH2=CHCCH3 CHCH,CHO CH2=CHCHO O 饱和醛 不饱和醛 不饱和铜 不饱和铜 根据分子中羰基的数目,可把醛、酮分为一元、二元和多元醛、酮等。例: 0 0 CH.CCH.CCH OHC一CHO 二心醛 二元村 多元心衬 碳原子数相同的饱和一元醛、酮互为位置异构体,具有相同的通式:C0

2.醛、酮的命名 少数结构简单的醛、酮,可以采用普通命名法命名,即在与羰基相连的烃基名称后面加上 “醛”或“酮”字。例: CHCHCHO CH.CCH CH.CCH,CH: CCH CHs 异」醛 二甲(基)的甲(基)乙(基)酮 甲基苯基铜 结构复杂的醛、酮通常采用系统命名法命名。选择含有羰基的最长碳链为主链,从距羰基 最近的一端编号,根据主链的碳原子数称为“某醛”或“某酮”。因为醛基处在分子的一端, 命名醛时可不用标明醛基的位次,但酮基的位次必须标明。主链上有取代基时,将取代基的位 次和名称放在母体名称前。主链编号也可用希腊字母、B、y、…表示。命名不饱和醛、 酮时,需标出不饱和键的位置。例如: CH3-CHCHO 0 CH3 CH3 CHCCHbCHCH 2-甲基丙醛或a-甲基丙醛 4-甲基-2-戊的 0 CH3CHCCHCH Br Br CHCH-CHCHO 2,4-二溴-3-戊狗或a,a’-二溴-3-戊时 2-」烯醛 羰基在环内的脂环酮,称为“环某酮”,羰基在环外, 则将环作为取代基。例: CHO CH: CH3 3-甲基环己崩 4-甲基环己基甲醛 1,4-环己二刚 命名芳香醛、酮时,把芳香烃基作为取代基。例如: -CH: CHCH: CH.CCH 苯乙雨 1-苯基-1-丙的 1-苯基-2-丙酮 某些醛常用俗名。例: CHO CHO OH CH=CHCHC 苫个仁油(苯甲醛) 水杨醛(2-羟基苯甲醛) 肉桂醛(3-苯基丙烯醛) 二 醛、酮的物理性质 室温下,除甲醛是气体外,「二个碳原子以下的脂肪醛、酮为液体,高级脂肪醛、酮和 芳香酮多为固体。酮和芳香醛具有愉快的气味,低级醛具有强烈的刺激气味,中级醛具有果 香味,所以含有C。-C个碳原子的醛可用于配制香料

醛、酮是极性化合物,但醛、酮分子间不能形成氢键,所以醛、酮的沸点较分子量相近 的烷烃和醚高,但比分子量相近的醇低。例: 」烷 丙醛 丙铜 丙醇 分了量 58 58 58 60 沸点/℃ -0.5 48.8 56.1 97.2 醛、酮的羰基能与水分子形成氢键,所以四个碳原子以下的低级醛、酮易溶于水,如甲醛、 乙醛、丙醛和丙酮可与水五溶,其它醛、酮在水中的溶解度随分子量的增加而减小。高级醛、 酮微溶或不溶于水,勿溶于一般的有机溶剂。 三. 醛、酮的化学性质 羰基碳原子是s杂化的,三个sp杂化轨道分别与氧原子和另外两个原子形成三个σ键, 它们在同一平面上,键角接近120°。碳原子未杂化的p轨道与氧原子的一个p轨道从侧面重 叠形成π键。山于羰基氧原子的电负性大于碳原子,因此双键电子云不是均匀地分布在碳和氧 之间,而是偏向于氧原子,形成一个极性双键,所以醛、酮是极性较强的分子。羰基的结构如 图所示。 羰基的结构示意图 山于羰基的极性,碳氧双键加成反应的历程与烯烃碳碳双键加成反应的历程有显著的差 异。碳碳双键上的加成是山亲电试剂进攻而引起的亲电加成,羰基上的训成是山亲核试剂向电 子云密度较低的羰基碳进攻而引起的亲核加成。醛酮的加成反应大多是可逆的,而烯烃的亲电 加成反应一般是不可逆的。含有ā-H原子的醛、酮也存在超共轭效应,山于氧的电负性比碳 大得多,因此醛、酮的超共轭效应比烯烃强得多,有促使α-H原子变为质子的趋势。一些涉 及“-H的反应是醛、酮化学性质的主要部分。此外,醛、酮处于氧化-还原反应的中间价念, 它们既可被氧化,又可被还原,所以氧化-还原反应也是醛、酮的一类重要反应。 综上所述,醛、酮的化学反应可归纳下: R(H) 醛的氧化反应 炭基的还原反应 羰基的亲核加成反应 a-Ⅱ的反应 1.羰基的亲核加成反应 (1)与氢氰酸州成醛、酮与氢氰酸作用,生成ā-羟基晴。反应是可逆的,少量碱存在 可加速反应进行

OH OH C=0+HCN H20 R2(H) CN COOH R2(H) R2(H) α-羟基晴可进一步水解成ā-羟基酸。山于产物比反应物增加了一个碳原子,所以该反 应是有机合成中增长碳链的方法。 羰基的碳氧双键山一个σ-键和一个·-键组成,氧原子的电负性强,电子云偏向氧原子 使其带部分负电荷,碳原子带部分正电荷。果试剂的负性部分(亲核试剂)首先进攻羰基碳 原子,则形成氧负离子中间体;果试剂的正性部分(亲电试剂)首先进攻羰基氧原子,则形 成碳正离子中间体。 OH 快 亲核加成 OH OH H-CN C CN-C-CN 亲电加成 两种加成方式哪种占优,主要取决于各自中间体的相对稳定性。碳正离子中,碳原子外 层只有六个电子,又与电负性较强的氧原子相连,所以它是不稳定的中间体。氧负离子中, 氧原子外层有八个电子,是比较稳定的八隅体结构,而月氧原子的电负性大,具有较强的容 纳负电荷的能力,所以是较稳定的中间体。因此从理论上看,羰基与氢氰酸的加成反应是亲 核加成,而不是亲电加成。反应的第一步是C加到羰基碳上,速度较慢,反应速度只与CN 的浓度有关:第二步是带正电荷的基团加到羰基氧上,速度较快。整个反应的速度决定于第 一步的速度。碱的作用,是将弱亲核试剂HCN转变成为亲核性较强的CN。 实验事实也证明羰基与氢氰酸的加成反应是亲核加成。例如丙酮和氢氰酸反应3-4小时, 仪有一半原料起作用:若在反应体系中加入一滴氢氧化御溶液,则反应可在几分钟内完成:若 加入大量酸,则放置几周也不起反应。这种少量碱加速反应,酸抑制反应的事实,说明反应中 首先进攻羰基的试剂一定是CN,而不是H。因为氢氰酸是弱酸,在水溶液中存在!下电离 平衡: HCN±H+CN 加碱有利于氢氰酸离解,提高C的浓度:加酸使平衡向生成氢氰酸的方向移动,降低C、的浓 度。 个同结构的醛、酮对氢氰酸反应的活性有明显差异,这种活性受电子效应和空间效应两 种因素的影响。从电子效应考虑,羰基碳原子上的电子云密度愈低,愈有利于亲核试剂的进攻, 所以羰基碳原子上连接的给电子基团(烃基)愈多,反应愈慢。从空间效应考虑,羰基碳原 子上的空间位阻愈小,愈有利于亲核试剂的进攻,所以羰基碳原子上连接的基团愈多、体积愈 大,反应愈慢。山此可见,电子效应和空间效应对醛、丽的反应活性影响是一致的,不同结构 的醛、丽对氢氰酸的加成反应活性次序大致下:

c-o-Cm-8 0 8m888d 实际上,只有醛、脂肪族甲基酮、八个碳原子以下的环酮才能与氢氰酸反应。 (2)与亚硫酸氢钠加成醛、酮与饱和亚硫酸氢钠溶液作用,亚硫酸氢钠分子中带未共 用电子对的硫原子作为亲核中心进攻羰基碳原子,生成á-羟基磺酸钠。反应是可逆的,必须 加入过量的饱和亚硫酸氢钠溶液,以促使平衡向右移动。 R -0Na OH 岛 R SONa 与加氢氰酸相同,只有醛、脂肪族甲基酮、八个碳原子以下的环酮才能与饱和亚硫酸氢 钠溶液反应。 山于ā-羟基磺酸钠不溶于饱和亚硫酸氢钠溶液,以白色沉淀析出,所以此反应可用来 鉴别醛、酮。另外,α-羟基磺酸钠溶于水而不溶于有机溶剂,与稀酸或稀碱共热可分解析出 原来的羰基化合物,所以此反应也可用于分离提纯某些醛、酮。 RCHSO3Na- HCLRCHO+NaCI+02+Ho H30 NazCO3 OH RCHO Na2SO3+NaHCO3 H20 (3)与格氏试剂加成格氏试剂是较强的亲核试剂,非常容易与醛、酮进行加成反应,加 成的产物不必分离便可直接水解生成相应的醇,是制备醇的最重要的方法之一。 R-MgX cò C-OMEX Mg(OH)X 格氏试剂与甲醛作用,可得到比格氏试剂多一个碳原子的伯醇:与其它醛作用,可得到 仲醇:与酮作用,可得到叔醇。 RMgX+HCHO燥乙梦RCH,OMgXH,O,RCH,OH RMgX+R,CHOt操乙壁R-CHOMgX H,OR-CH-OH H¥ R R R RMX+c=OT绿乙琴R-C-OMgXH,O C-OH R H R2 山于产物比反应物增加了碳原子,所以该反应在有机合成中是增长碳链的方法。 (4)与醇加成在干燥氯化氢的催化下,醛与醇发生加成反应,生成半缩醛。半缩醛又 能继续与过量的醇作用,脱水尘成缩醛。反应是可逆的,必须加入过量的醇以促使平衡向右移
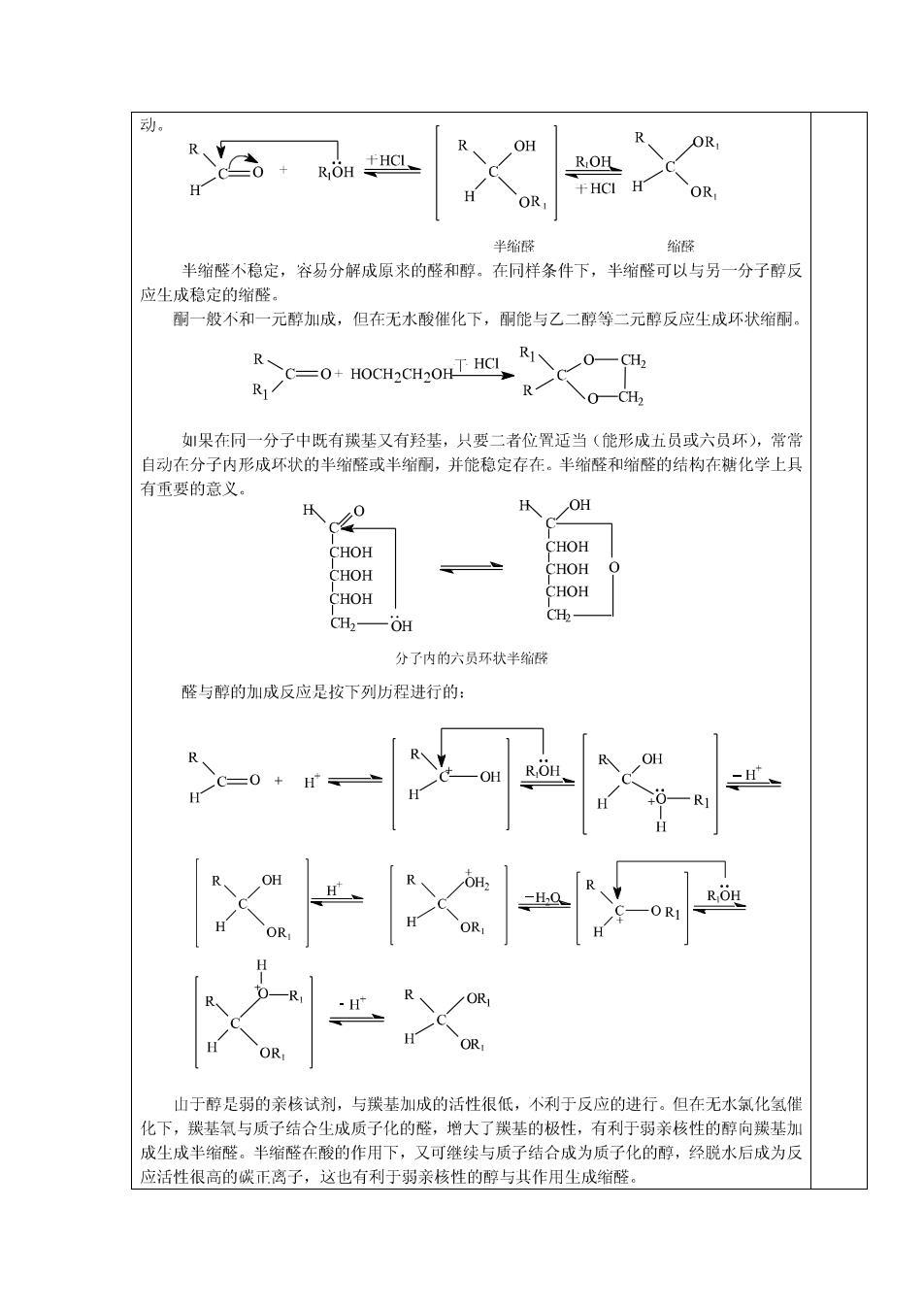
动。 OH OR ROH +HCI H H OR OR 半缩碎 缩醛 半缩醛不稳定,容易分解成原来的醛和醇。在同样条件下,半缩醛可以与另一分子醇反 应生成稳定的缩醛。 酮一般不和一元醇加成,但在无水酸催化下,酮能与乙二醇等二元醇反应生成环状缩酮。 R C-0+HOCH2CH20HT HCI 0一CH2 R 如果在同一分子中既有羰基又有羟基,只要二者位置适当(能形成五员或六员环),常常 自动在分子内形成环状的半缩醛或半缩酮,并能稳定存在。半缩醛和缩醛的结构在糖化学上具 有重要的意义。 OH CHOH CHOH CHOH CHOH CHOH CHOH CH2- CH OH 分了内的六员环状半缩醛 醛与醇的加成反应是按下列历程进行的: OH H H ROH -OR OR OR OR 山于醇是弱的亲核试剂,与羰基加成的活性很低,不利于反应的进行。但在无水氯化氢催 化下,羰基氧与质子结合生成质子化的醛,增大了羰基的极性,有利于弱亲核性的醇向羰基加 成生成半缩醛。半缩醛在酸的作用下,又可继续与质子结合成为质子化的醇,经脱水后成为反 应活性很高的碳正离子,这也有利于弱亲核性的醇与其作用尘成缩醛

缩醛对碱、氧化剂、还原剂等都比较稳定,但在酸性溶液中易水解为原来的醛和醇,因此, 在羰基化合物与醇的加成反应中要使用干燥的HC1为催化剂。 R ORI +H20 HRCHO+RJOH H 在有机合成中,常利用生成缩醛的方法来保护醛基,使活泼的醛基在反应中个被破坏, 旦反应完成后,再用酸水解释放出原来的醛基。例,要将丙烯醛转化为丙醛或2,3-二羟基 丙醛,如果直接用催化氢化的方法或氧化的方法,醛基都将被破坏。果先把醛转化为缩醛, 然后再进行催化氢化或氧化,待反应完成后用酸水解,就能达到保护醛基的目的: OR CH-CHCHO-ROH CH-CHCH +HCI OR HCHCHCH< OR H20 H+之CHCH,CHO OR OR CH2=CHCH< OR 稀、 冷KMrO CH一CHCH< OR HO CHa-CHCHO OH- OR H OH OH OHOH (5)与水加州成水也可以和羰基化合物进行加成反应,但山于水是比醇史弱的亲核试剂, 所以只有极少数活泼的羰基化合物才能与水加成生成相应的水合物。例: HCHO HOH H 、OH H C-OH 甲醛溶液中有99.9%都是水合物,乙醛水合物仪占58%,丙醛水合物含量很低,而丁醛的 水合物可忽略不计。 在三氯乙醛分子中,山于三个氯原子的吸电子诱导效应,它的羰基有较大的反应活性,容 易与水加成生成水合二氣乙醛: OH .H-OHC1 OH C 水合二氯乙醛简称水合氣醛,为白色品体,可作为安眠药和麻醉药。 茚三丽分子中,山于羰基的吸电子诱导效应,它也容易和水分子形成稳定的水合茚二丽: 0 OH +HOH OH 水合茚三酮在·一氨基酸的色谱分析中常用作显色剂。 2.与氨的衍生物的训成-消除反应 醛、酮可与氨的衍生物发生亲核加成反应,最初生成的加成产物容易脱水,生成含碳氮 双键的化合物,所以此反应称为加圳成-消除反应

-H0 C-NY- C=N-Y OH Hi 常用的氨的衍尘物有: NHNH2 NHNH? NO2 NH2OH NH2NH2 H,N-C-NHNH2 NO2 羟胺 肼 苯肼 2,4.硝基苯肼 氨基脲 它们与羰基化合物进行加成-消除反应的产物如下: HN—R(Ar) C-N-R 希大(Schiff)碱 HN—OH C=N-OH 肟 HN-NH2 C=NNH> 腙 HN一NH C=NNH- 苯腙 HN一NH C=NNH- 2,4二硝基苯踪 NO NO2 NO2 NO2 珍N-NH一-NH C=NNHC-NHz 缩氨脲 羰基化合物与羟胺、苯肼、2,4-二硝基苯肼及氨基脲的加成-消除产物大多是黄色品体, 有固定的熔点,收率高,易于提纯,在稀酸的作用下能水解为原来的醛、酮。这些性质可用来 分离、提纯、鉴别羰基化合物。上述试剂也被称为羰基试剂,其中2,4一二硝基苯肼与醛、 酮反应所得到的黄色品体具有不同的熔点,常把它作为鉴定醛、酮的灵敏试剂。 该反应一般在酸催化下进行,羰基氧与质子结合,可以提高羰基的活性: 66 6=0°+H+±>c=OH 但反应的酸性不能太强,因为在强酸下,氨的衍生物能与质子结合形成盐,这将丧失它们的亲 核性: HN-Y+H→H3Y 所以反应一般控制在弱酸性溶液(醋酸)中进行。 3.a-H的反应 醛、丽分子中,与羰基直接相连的碳原子上的氢原子称为H原子。山于羰基的π电子 云与α-碳氢键之间的o电子云相互交叠产尘0-π超共轭效应,削弱了a-碳氢键,使āH史 加活泼,酸性有所增强。例1乙烷中C一H键的pKa约为0,而丙丽或乙醛中C一H键的pKa

约为19-20。因此醛、酮分子中的a-H表现出特别的活性。 对于脂肪醛、酮来说,α-H的活性主要表现在以H的形式离解出来,并转移到羰基氧上, 形成所谓的烯醇式异构体,但平衡主要偏向酮式一边。例: OH CH-C-CH±CH-C=CH 丽式(99.9%) 烯醇式(0.1%) 简单醛、酮中烯醇式含量虫然很少,但在很多情况下,醛、酮都是以烯醇式参与反应。当 烯醇式与试剂作用时,半衡右移,酮式不断转变为烯醇式,直全酮式作用完为止。 碱可以夺取α-H产生碳负离子,继而形成烯醇负离子: 0 B:+CH-c CH3 >HB+CHzC-CH3 CH:=6-CHs 烯醇负离子中存在-π共轭效应,负电荷得到分散,因而烯醇负离子比较稳定。醛、丽 有许多反应是通过碳负离子进行的。 酸也可以促进羰基化合物的烯醇化。这是山于「与氧结合后史增加了羰基的诱导效应,从 而使a-氢容易离解。 OH CH3一C=CH2+H (1)卤代及碘仿反应醛、酮分子中的ā-H原子在酸性或中性条件下容易被卤素取代, 生成a-卤代醛或a-卤代酮。例1: CH3+Br2微壁ANCL 乙酵】 -CH2Br+HBt ā-卤代酮是一类催泪性很强的化合物。 反应是通过烯醇式进行的。和简单烯一样,烯醇是依靠它们的电子具有亲核性来反应 的,但是烯醇比简单烯活泼得多,因为在反应中,羟基作为一个电子给予体参与反应。 CH,Br+HB 酸催化可控制反应在一卤代阶段。山于引入卤原子的吸电子效应,使羰基氧原子上的电子 云密度降低,再质子化形成烯醇要比未卤代时困难。 卤代反应也可被碱催化,碱催化的卤代反应很难停留在一卤代阶段。果-C为甲基, 例1乙醛或甲基酮(CH,C0一),则二个氢都可被卤素取代。这是山于ā-H被卤素取代后,卤原 子的吸电子诱导效应使还没有取代的ā-氢史活泼,史容易被取代。例: CH-C-CHs +X2 NaOH-CH-C-CX3 0 尘成的1,1,1一三卤代丙酮山于羰基氧和三个卤原子的吸电子作用,使碳-碳键不牢固