
第七章 醇酚醚 教学目标: 1. 运用前面讲过的消除反应的历程和反应规律(查依采夫规律)分析醇的消除反应进 行的情况。 个别化合物可以通过分类和物理性质的讲解结合进行。 教学重点、难点: 醇的化学性质。包括醇似水性,脂化反应,亲核取代、消除及氧化反应。酚和醚重点讲 授分子结构与性质的关系。 教学方法、手段:讲授、CAI课件辅助教学。 本章学时:5学时

教学内容: 醇、酚、醚 醇、酚、醚是烃的含氧衍生物之一。醇和酚的分子中均含有羟基(一OH)官能团。羟基 直接与脂肪烃基相连的是醇类化合物,直接与芳基相连的是酚类化合物。例如: OH CH2OH CH3CH2OH 醇 酚 醚是氧原子直接与两个烃基相连的化合物(RO一R、ArO一Ar或R一O一Ar),通常 是山醇或酚制得,是醇或酚的官能团异构体。 第一节醇 醇是脂肪烃分子中的氢原子被羟基(OH)取代的衍尘物,也可看作是水中的氢原子被 脂肪烃基取代的产物。 一,醇的分类和命名 1.醇的分类 根据羟基所连烃基的结构,可把醇分为脂肪醇、脂环醇、芳香醇(羟基连在芳烃侧链上的 醇)等。例如: CH2CH20H CH3CH20H OH 脂肪醇 脂环醇 芳香醇 根据羟基所连烃基的饱和程度,可把醇分为饱和醇和不饱和醇。例: CH3CHCH3 CH2=CH-CH2OH OH 饱和醇 不饱和醇 根据分子中羟基的数目,可把醇分为一元醇、二元醇和多元醇。饱和一元醇的通式为 CH2m+20。在二元醇中,两个羟基连在相邻碳原子上的称为邻二醇,两个羟基连在同一碳原子 上的称为胞二醇(不稳定)。例如: CH2CH2CH2 CH2一CH2 CH:CH2CH2OH OH OH OH OH 一心醇 元醇 元醇(邻二醇) 根据羟基所连碳原子的类型,可把醇分为伯醇(一级醇)、仲醇(二级醇)和叔醇(三 级醇)。例: R' 1 RCH,OH RCH2- CH-R' R-C-R OH OH 伯醇(一级醇) 仲醇(级醇) 叔醇(三级醇
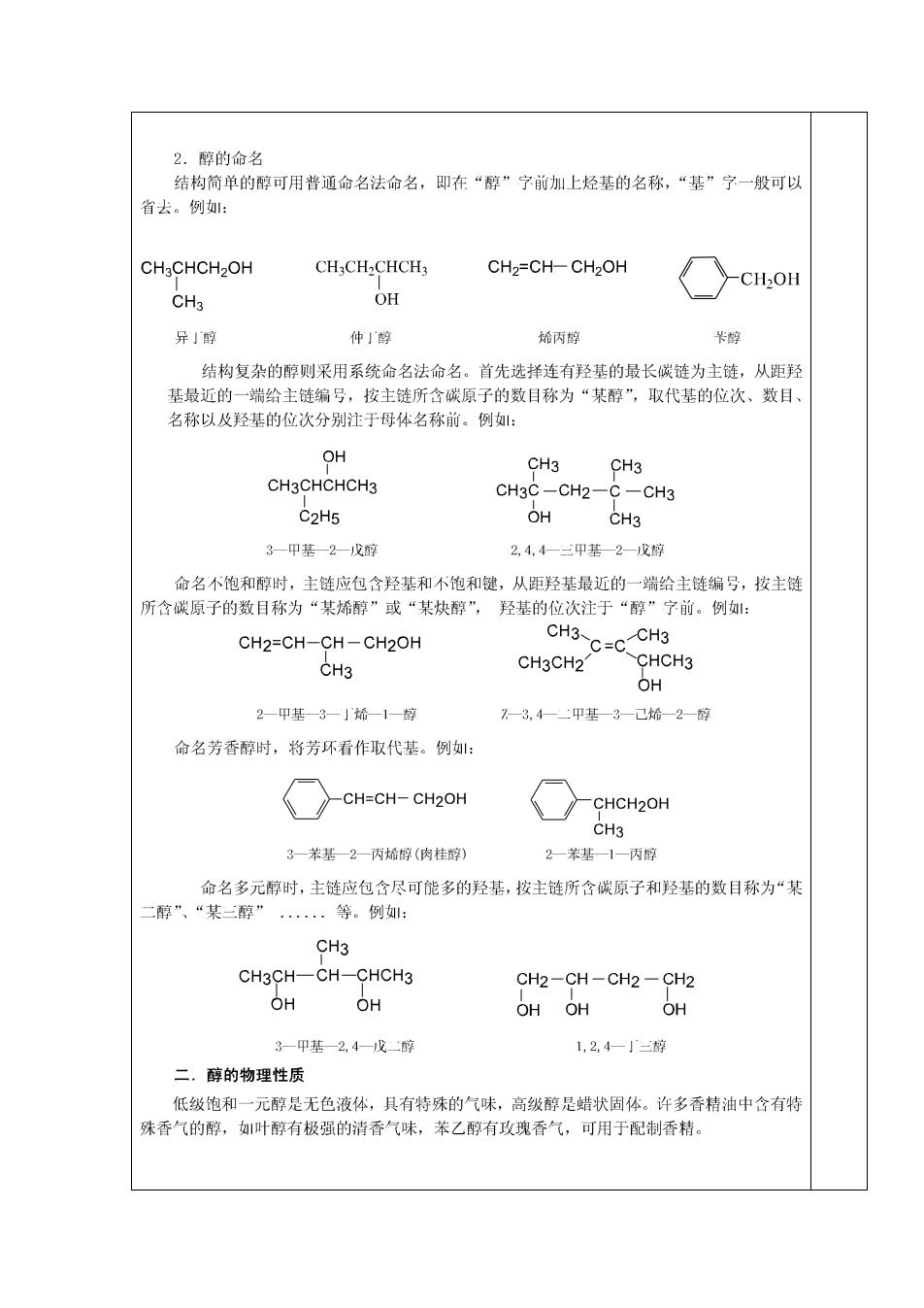
2.醇的命名 结构简单的醇可用普通命名法命名,即在“醇”宁前加上烃基的名称,“基”宁一般可以 省去。例: CH3CHCH2OH CH3CH2CHCH3 CH2=CH-CH2OH CH2OH CH3 OH 异」醇 仲」醇 烯丙醇 卡醇 结构复杂的醇则采用系统命名法命名。首先选择连有羟基的最长碳链为主链,从距羟 基最近的一端给主链编号,按主链所含碳原子的数目称为“某醇”,取代基的位次、数目、 名称以及羟基的位次分别注于母体名称前。例: OH CH3 CH3 CH3CHCHCH3 CH3C-CH2-C-CH3 C2H5 OH CH3 3一甲基一2戊醇 2,4,4一三甲基—2一戊醇 命名不饱和醇时,主链应包含羟基和不饱和键,从距羟基最近的一端给主链编号,按主链 所含碳原子的数目称为“某烯醇”或“某炔醇”,羟基的位次注于“醇”宁前。例如: CH2=CH-CH-CH2OH C=CCH3 CH3 CH3 CH3CH2 CHCH3 OH 2一甲基3一」烯一1醇 7一3,4一甲基—3一已烯一2一醇 命名芳香醇时,将芳环看作取代基。例: CH=CH-CH2OH CHCH20H CH3 3一苯基一2一丙烯醇(肉桂醇) 2一苯基一1—丙醇 命名多元醇时,主链应包含尽可能多的羟基,按主链所含碳原子和羟基的数目称为“某 二醇”、“某三醇” 等。例: CH3 CH3CH-CH-CHCH3 CH2-CH-CH2-CH2 OH OH OHOH OH 3-甲基一2,4一戊二醇 1,2,4一三醇 二。醇的物理性质 低级饱和一元醇是无色液体,具有特殊的气味,高级醇是蜡状固体。许多香精油中含有特 殊香气的醇,叶醇有极强的清香气味,苯乙醇有政瑰香气,可用于配制香精

H一H CH2CH20H C=C CH3CH2 CH2CH20H 叶醇 2一苯乙醇 山于含有羟基,醇分子间可以形成氢键,所以醇的沸点不但高于分子量相近的烃,也高于 分子量相近的卤代烃。随着分子量的增加,醇的沸点有规律地升高,每增加一个CH2,沸点升 高约18~20℃。碳原子数相同的醇,支链越多沸点越低。醇分子中羟基数目增多,分子间能 形成史多的氢键,沸点也就史高。 羟基能与水形成健,是亲水基团,而烃基是不溶于水的疏水基团,所以在分子中引入羟基能 增加化合物的水溶性。C,~C;的一元醇,山于羟基在分子中所占的比例较大,可与水任意混 溶。C4~C,的一元醇,山于疏水基团所占比例越来越大,在水中的溶解度迅速降低。C1o以上的 元醇则难溶于水。一些常见醇的物理常数见表6-1。 一些低级醇1甲醇、乙醇等,能和某些无机盐(MgCl2、CaCl2、CuSO4等)形成结品状的 化合物,称为结品醇,1MgC12·6CHOH、CaCl2·4CHOH、CaCl2·4CH,OH等。结品醇 溶于水而不溶于有机溶剂,所以不能用无水CC12来除去甲醇、乙醇等中的水分。但利用这一 性质,可将醇与其他有机物分离开来。 三.醇的化学性质 化合物的性质主要是山其分子的结构决定的。羟基是醇类化合物的官能团,羟基中的氧原 子为不等性p杂化,其中两个p杂化轨道被两对未共用电子对占据,余下的两个p杂化轨 道分别与碳原子和氢原子形成C一O键和C一H键。 R H 醇分子中氧的价健及未共用电子对分布示意图 山于氧原子的电负性比碳原子和氢原子大,因此氧原子上的电子云密度偏高,易于接受质 子,或作为亲核试剂发生某些化学反应。醇分子中的碳氧键和氧氢键均为较强的极性键,在 定条件下易发生键的断裂,碳氧键断裂能发生亲核取代反应或消除反应,氧氢键断裂能发生脂 化反应。山于羟基吸电子诱导效应的影响,增强了·H原子和BH原子的活性,易于发生a H的氧化和BH的消除反应。综上所述,可归纳出醇的主要化学性质下: (H)R a-H的氧化 R、 CH- 取代反应 H 醇的弱酸性 酯化反应 消除反应(分子内脱水) 在反应中,反应的部位取决于所用的试剂和反应的条件,反应活性则取决于烃基的结构。 1.与活泼金属的反应 与水相似,醇羟基上的氢与活泼金属1N、K、Mg、A1等反应放出氢气,表现出一定的 酸性,但比水要缓和得多

2H20+2Na一一2OH+H2↑(反应激烈) 2CH3CH2OH+2Na一→2C2H,ONa+H2↑(反应缓和) 乙醇钠 6(CH3)2CHOH+2A1-一2[(CH3)2CHO]3A1+3H2↑ 异丙醇侣 2CH3CH2CH2OH+Mg一一(CH,CH2CH2O2Mg+H2t 丙醇镁 这主要是山于醇分子中的烃基具有斥电子诱导效应(+),使氧氢键的极性比水弱所 致。羟基ā-碳上的烷基增多,氧氢键的极性相应地域弱,所以不同烃基结构的醇与活泼金属 反应的活性次序为: 水>甲醇>伯醇>仲醇>叔醇 山于醇的酸性比水弱,其共轭碱烷氧基(RO)的碱性就比OH强,所以醇盐遇水会分 解为醇和金属氢氧化物: RCH2ONa +H2O-RCH2OH+NaOH 在有机反应中,烷氧基既可作为碱性催化剂,也可作为亲核试剂进行亲核加成反应或 亲核取代反应。 2.与氢卤酸的反应 醇与氢卤酸反应,分子中的碳氧键断裂,羟基被卤素取代生成卤代烃和水。 ROH+HX一→RX+H2O 这是卤代烃水解的逆反应。不同的氢卤酸与相同的醇反应,其活性次序为:HⅡ>HB> HC1。不同的醇与相同的氢卤酸反应,其活性次序为:烯丙型醇>叔醇>仲醇>伯醇。 实验室常用卢卡斯(HJ.Lucas)试剂(浓盐酸与无水氯化锌配成的溶液)来鉴别六个碳 原子以下的一元醇的结构。 山于六个碳原子以下的一元醇可溶于卢卡斯试剂,生成的卤代烃不溶而出现浑浊或分层 现象,根据出现浑浊或分层现象的快慢便可鉴别出该醇的结构。烯丙型醇或叔醇立即出现浑 浊,仲醇要数分钟后才出现浑浊,而伯醇须加热小出现浑浊。六个碳以上的一元醇山于不溶 于卢卡斯试剂,因此无法进行鉴别。 个, 无水ZnC2 个, R一R-OH+HC(浓) >R-C-CI+H2O 立即出现汗浊 Ru 20℃ R R一CHOH+HCI(浓) 无水ZnC2 >R-CH-CI+H2O 数分钟后出现深浊 R 20℃ R 无水ZnC2 RCH2OH+HCI(浓) >RCH2CI H2O 室温下不汗浊 △

3.与无机酰卤的反应 醇与二卤化磷、五卤化磷或亚硫酰氯(氯化亚砜)反应生成相应的卤代烃。与二卤化磷的 反应常用于制备溴代烃或碘代烃,与五氯化磷或亚硫酰氣的反应常用于制备氯代烃。这些反应 具有速度快,条件温和,不易发生重排,产率较高的特点,与亚硫酰氯的反应还具有易于分离 纯化的优点。 CH3CH2CH2OH+PI3->CH3CH2CH2I+H3PO3 CH3CH-CH-CH3 PBr3-CH3CH -CHCH3+H3PO3 CH3 OH CH3 Br CH3CH2OH+CI CI→CH3CH2C1+SO2↑+HCI个 4.脱水反应 醇在酸性催化剂作用下,加热容易脱水,分子间脱水生成醚,分子内脱水则生成烯烃。 (1)分子间脱水醇在较低温度下加热,常发生分子间的脱水反应,产物为醚。例: CH,CH2Oi王日OCH,CH, HO..10~10CH,CH,-O-CHCHa 或A103260℃ 当用不同的醇进行分子间的脱水反应时,则得到三种醚的混合物: ROH+R'OHR-OR+R-OR'+R-O-R 所以,用分子间的脱水反应制备醚时,只能使用单一的醇制备对称醚。 (2)分子内脱水醇在较高温度下加热,发生分子内的脱水反应,产物是烯烃。不同结构 的醇的反应活性大小为:叔醇>仲醇>伯醇。 醇的分子内脱水属于消除反应,与卤代烃脱卤化氢的反应相同,产物遵循查依采夫 (Saytzeff)规律,主要生成较稳定的烯烃。例l: CH,CH,OHH0 160~180 CH,-CH,+H2O 或A1203,360℃ CH,CH:CH:CHCH,- XHSO..CH.CH.CH-CHCH,+CH.CH-CH.CH-CH.+HO 87℃ OH 80% 20% CHs CHa CH, 46%HzS04, CH,CH:-C -CH; CH,CH=C +CH,CH:C=CH:+H:O 81℃ OH 84%CH 16% 对于某些醇,分子内脱水主要生成稳定的共轭烯烃。例: CH3 浓H2S04 CH3 CH2-CH-CHCH3- △ CH=CH-CH-CH3 OH CH3 CH3 CH3-CH-CH-CH2CH- 沫H2sO4CH3CH-CH=CH-CH △ OH

醇的消除反应一般按E历程进行。山于中间体是碳正离子,所以某些醇会发尘重排,主 要得到重排的烯烃。例: CH CH OH H CHCHOH2HCHCH2HCH2=CH2 CH3H CH3 CH3 CH3 CH3- -C-CH3H,cHg-C-CHCH3重排,CH-£-CH-cH CH3 OH CH3 -H -H CH3 CH3CH3 CHg C-CH=CH2 CHa C =C-CH3 CH3 (30%) (70%) 为避免醇脱水生成烯烃时发尘重排,通常先将醇制成卤代烃,再消除HX来制备烯烃。 5.脂化反应 醇与羧酸或无机含氧酸生成酯的反应,称为脂化反应。 (1)与羧酸的酯化反应醇和有机酸在酸性条件下,分子间脱去水生成脂。 H+ RCOOH R'OH RCOOR'+H20 此反应是可逆的,为提高脂的产率,可以减少某一产物的浓度,或增加某一种反应物的 浓度,以促使平衡向生成脂方向移动。 (2)与无机金氧酸的酯化反应常见的无机含氧酸有硫酸、硝酸、磷酸,反应生成无机酸 酯。例: CH3OH HO-SO2OH 0C CH:OSO2OH 硫酸氢甲酯 减压蒸馏 2CHOSO2OH >CH;OSO2OCH3 H2SO4 硫酸二甲酯 磷酸的酸性较硫酸、硝酸弱,一般不易直接与醇酯化。 酯的存在和应用都非常广泛,动植物体的组织和器官内广泛存在卵磷脂、脑磷脂、油脂等。 某些磷酸酯,如葡萄糖、果糖等的磷酸脂是生物体内代谢过程中的重要中间产物,有的磷酸脂 则是优良的杀虫剂、除草剂。 硝酸酯大多因受热猛烈分解而爆炸,常用作炸药。有些硝酸酯,亚硝酸异戊酯可作心脑 血管扩张剂。 硫酸二甲酯在有机合成中是非常重要的甲基化试剂。 6.氧化反应
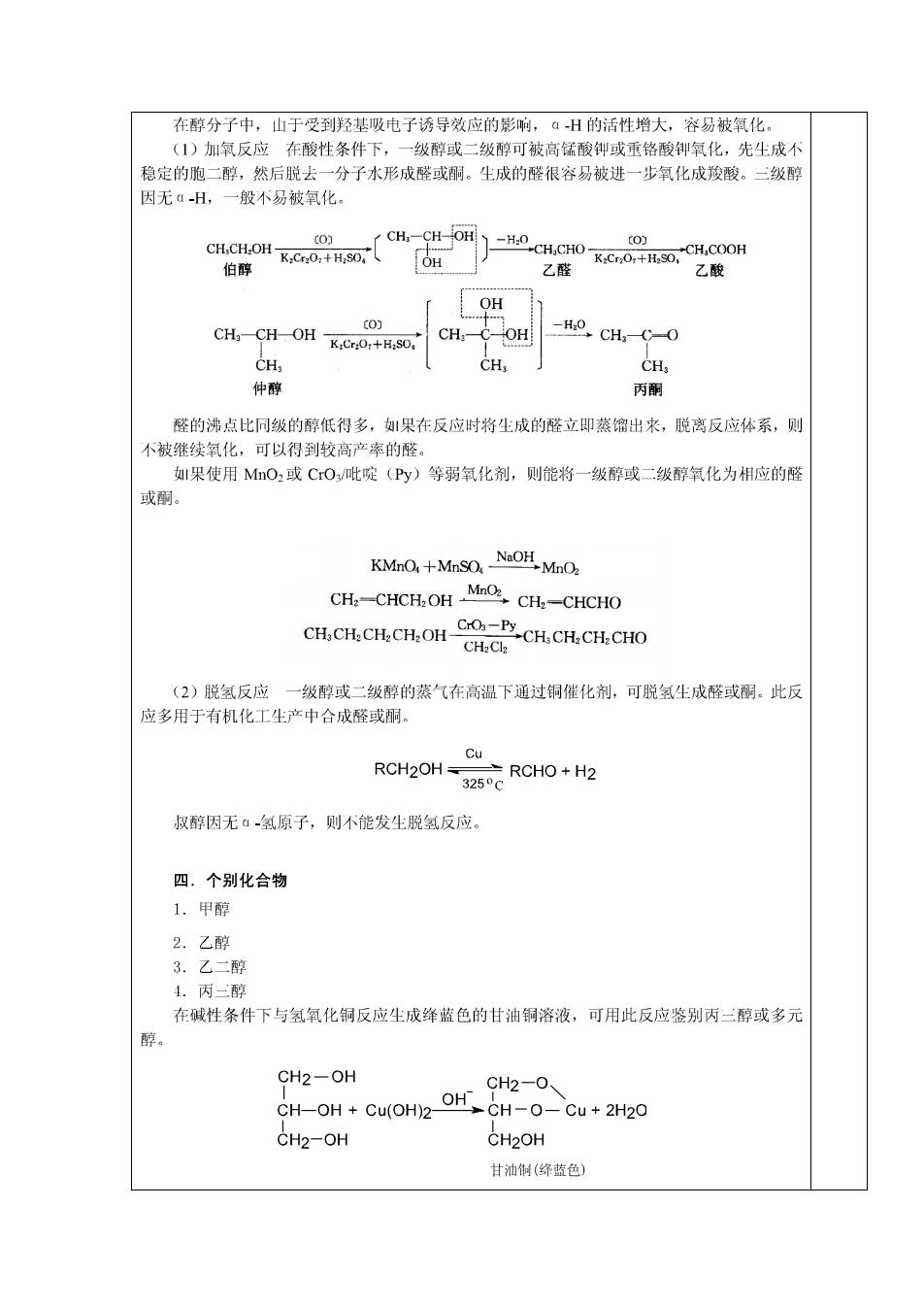
在醇分子中,山于受到羟基吸电子诱导效应的影响,ā-H的活性增大,容易被氧化。 (1)加氧反应在酸性条件下,一级醇或二级醇可被高锰酸钟或重铬酸御氧化,先生成不 稳定的胞二醇,然后脱去一分子水形成醛或酮。生成的醛很容易被进一步氧化成羧酸。三级醇 因无H,一般不易被氧化。 〔0) CH3一CHOH -H.0 〔0) CH CHOH -CH CHO K:Cr2O:+H2SO 伯醇 OH 乙醛 K.Cr,0,+H.SO,"CH,COOH 乙酸 OH c0) H2o CH-CH-OH CH OH →CHCO K:Cr2O:+H:SO CH CH3 CH 仲醇 丙酮 醛的沸点比同级的醇低得多,果在反应时将生成的醛立即蒸馏出来,脱离反应体系,则 不被继续氧化,可以得到较高产率的醛。 果使用MO2或CO/吡啶(Py)等弱氧化剂,则能将一级醇或二级醇氧化为相应的醛 或酮。 KMnO,+MnSO.NaOHMnO CH.-CHCH.OH MnoCH.-CHCHO CH:CH2 CH2CH2 OH- CrO-Py.CH.CH.CH.CHO CH2Cl2 (2)脱氢反应一级醇或二级醇的蒸气在高温下通过铜催化剂,可脱氢尘成醛或酮。此反 应多用于有机化工生产中合成醛或丽。 Cu RCH2OH=±RCHO+H2 3250C 叔醇因无α氢原子,则不能发生脱氢反应。 四.个别化合物 1.甲醇 2.乙醇 3.乙二醇 4.丙二醇 在碱性条件下与氢氧化铜反应生成绛蓝色的甘油铜溶液,可用此反应鉴别丙二醇或多元 醇。 CH2-OH CH2-O、 CH-OH Cu(OH)2- OH CH-O-Cu+2H20 CH2-OH CH2OH 甘油铜(绦蓝色)

5.肌醇和植酸 OH OPO3H2 HO -OH H203PO OPO3H2 HO OH H203PO OPO3H2 OH OPO3H2 肌醇 植酸 6.三|烷醇 第二节 酚 一.酚的分类和命名 根据羟基所连芳环的不同,酚类可分为苯酚、萘酚、蒽酚等。根据羟基的数目,酚类又可 分为一元酚、二元酚和多元酚等。 粉的命名是根据羟基所连芳环的名称叫做“某酚”,芳环上的烷基、烷氧基、卤原子、 氨基、硝基等作为取代基,若芳环上连有羧基、磺酸基、羰基、氰基等,则酚羟基作为取代 基。例: OH B C2H5 1-萘酚或4-萘酚 苯酚(石炭酸) 4-乙基苯酚 5-甲氧基-2-溴苯酚 OH SO3H OH OH O2N NO2 OH CH OH NO2 OH 2,4,6-二硝基苯酚 3-甲基-4-羟基苯磺酸 1,3,5-苯二酚 1,2,3-苯二酚 (苦味酸) (均苯一酚) (连苯二酚) 二.酚的物理性质 常温下,除了少数烷基酚为液体外,大多数酚为固体。山于分子间可以形成氢键,因此 酚的沸点都很高。邻位上有氟、羟基或硝基的酚,分子内可形成氢键,但分子间不能发生缔 合,它们的沸点低于其间位和对位异构体。 纯净的酚是无色固体,但因容易被空气中的氧氧化,常含有有色杂质。酚在常温下微溶于 水,加热则溶解度增加。随着羟基数目增多,酚在水中的溶解度增大。酚能溶于乙醇、乙醚、 苯等有机溶剂。 三,酚的化学性质 酚和醇具有相同的官能团,但酚羟基直接与苯环相连,氧原子的ρ轨道与芳环的工轨道形 成P一π共轭体系,导致氧原子的电子云密度降低,使得碳氧键的极性减弱而不易断裂,不能 像醇羟基那样发生亲核取代反应或消除反应。同时,酚羟基中氧原子的电子云密度降低致使氧 氢键的极性增加,与醇相比,酚的酸性明显增强。另外,山于酚羟基的给电子效应,使苯环上 的电子云密度增加,芳环上的亲电取代反应史容易进行
、 苯酚中p-π共轭示意图 综上所述,酚的主要化学性质可归纳如下: 酚的胶性 胎酸和南的生成 6+ 附与FcC,是色反应 芳环上的亲电取代反应 1.酸性 酚类化合物呈酸性,大多数酚的pK都在10左右,酸性强于水和醇,能与强碱溶液作用 生成盐。例: OH、 pKa=9.95 OH NaOH ONa H2O 苯酚钠 苯酚的酸性比碳酸弱,能溶于碳酸钠溶液,但不能溶于碳酸氢钠溶液,在苯酚钠的溶液中 通入二氧化碳能使苯酚游离出来。利用此性质可进行苯酚的分离和提纯。 ONa CO2- H20 OH NaHCO3 芳环上取代基的性质对酚的酸性影响很大。当芳环上连有供电子基时,使酚羟基的氧氢键 极性减弱,释放质子的能力减弱,因而酸性减弱:当芳环上连有吸电子基时,使酚羟基的氧氢 键极性增强,释放质子的能力增强,酸性增强。例: pKa 10.2 9.95 7.17 0.38 OH OH OH OH CH3 -NO2 O2N -NO2 2.与二三氯化铁的显色反应 NO2 酚与三氯化铁溶液作用生成有色的配合物: 6CcHsOH+FeCl3-[Fe (CoHsO)6]3 +6H*+3CI 不同的酚与三氯化铁作用产生的颜色个同。除酚以外,凡具有稳定的烯醇式结构的化合物