
第十章 含氮含磷有机化合物 教学目标: 1.胺的结构和性质。对于胺的碱性及氮原子上的未共用电子对的亲核性应作详细介绍。 例,各类胺的碱性强弱比较及其原因,烃基化、酰基化反应的应用等。 2.酰胺的结构对于了解蛋白质结构有重要作用应该详细讲解。此外,通过酰胺与溴的氢 氧化钠反应的讲授,使学生认识到分子重排是有机反应的一个重要类型。 3.芳香重氮盐的讲解,可着重于生成重氮盐的条件及其在合成上的应用。季铵碱热分解 的霍夫曼规则是杏讲授山教师自己决定。 教学重点、难点: 胺的结构和化学性质。重氮盐在有机合成上的应用 教学方法、手段:讲授、CAI课件辅助教学。 本章学时:5学时

教学内容: 第九章含氮和含磷有机化合物 分子中含有C一N键的化合物称为含氮有机化合物。含氨有机化合物的种类很多。例如 前面学习过的硝基苯,酰胺,苯肼等,甚全于氨基酸、蛋白质和含氮的杂环化合物等都属于 含氮有机化合物。 含磷有机化合物广泛存在于尘物体内。它们有的是维持尘命和生物体遗传不可缺少的物 质。在农业上,许多含磷有机化合物用作杀虫剂、杀菌剂和植物生长调节剂等,已成为一类 极为重要的农药。 第一节胺 胺类化合物可以看作是氨的烃类衍生物,广泛存在于自然界中。胺类化合物和生命活动 有密切的关系,许多激素、抗生素、尘物碱及所有的蛋白质、核酸都是胺的复杂衍生物。 一,胺的分类和命名 1.胺的分类 根据氮原子上所连烃基的数目,可把胺分为伯胺(一级胺)、仲胺(二级胺)、叔胺(二 级胺)、季铵盐(四级铵盐)和季铵碱(四级铵碱)。例: RNH2 R2NH RN RNX RANOH 伯胺 仲胺 叔胺 季铵盐 季铵碱 需要注意的是伯、仲、叔胺的分类方法与学过的伯、仲、叔卤代烃和伯、仲、叔醇的分 类方法是不同的。例: CH; CHs CH3 H3C一C-CH3 H:C-C-CHg HC-C-CHa Cl OH NH, 叔卤代烃 叔醇 伯胶 根据分子中烃基的结构,可把胺分为脂肪胺和芳香胺。例: NH2 CH,CH,NH, CH:CH2NH2 脂肪胺 NH NHCH2CH3 NH 芳香胶 根据分子中氨基的数目,可把胺分为一元胺、二元胺和多元胺等。例如: NH NH2 NH HNCH,CH2NH2 一儿胺 二元胺 多元胺 2.胺的命名

结构简单的胺可以根据烃基的名称命名,即在烃基的名称后加上“胺”字。若氮原子上 所连烃基相同,用二或二表明烃基的数日:若氮原子上所连烃基不同,则按基团的次序规则 山小到大写出其名称,“基”宁一般可省略。例: CH:NH2 CH:NHCH3 (CH3)2NCH2 CH3 甲胺 二甲胺 二甲基乙基胺 H2NCH2CH2NH2 H2NCH2CH2CH2CH2CH2CH2NH2 H2NCH2CH2 CH2 CH2 NH2 1.2-乙二胺 1.6-已二胺 1.4-」广二胺(腐胶) 芳香胺的命名,一般把芳香胺定为母体,其它烃基为取代基。命名时应标出烃基的位置, 接在氮上的烃基用“N某基”来表示。例: HC. CH,CH3 NH2 NHCH. CH3 对甲基苯胺 N甲基苯胺 N-甲基N-乙基对氯苯胶 复杂的胺则以烃为母体,氨基作为取代基来命名。例1: H C-CH CH,CHCH CH,CH,CH-CH-N(CH) CH2 NH2 CH CH 2甲基-4-氨基戊烷 3甲基-2(N,N甲氨基)戊烷 季铵盐或季铵碱可以看作铵的衍生物来命名。例如: (CH3)4N'CI [(CH3)3N CH2 CH3 ]OH 氯化四甲铵 氢氧化二甲基乙基铵 二.胺的物理性质 常温下,低级和中级脂肪胺为无色气体或液体,高级脂肪胺为固体,芳香胺为高沸点 的液体或固体。低级胺具有氨的气味或鱼腥味,高级胺没有气味,芳香胺有特殊气味,并有 较大的毒性。 山于胺是极性化合物,除叔胺外,其它胺分子间可通过氢键缔合,因此胺的熔点和沸 点比分子量相近的非极性化合物高。但山于氮的电负性比氧小,所以胺形成的氢键弱于醇或 羧酸形成的氢键,因而胺的熔点和沸点比分子量相近的醇和羧酸低。 伯、仲、叔胺都能与水形成氢键,所以低级脂肪胺可溶于水。随着烃基在分子中的比 例增大,溶解度迅速下降,所以中级胺、高级胺及芳香胺微溶或难溶于水。胺大都可溶于 有机溶剂。 三.胺的化学性质 氨基是胺类化合物的官能团,氨基中的氮原子为不等性p杂化,其中一个杂化轨道上 有一对未共用电子对,其余二个杂化轨道上各有一个电子。这样,氮原子可以和共它三个原 子分别形成二个0键,胺分子的构型是二三角锥形,与氨的构型相似

HR) H(R") H(R) (A)脂肪胶 (B)芳香胺 脂肪胺和芳香胺的结构 与氨相似,氨基中的氮原子上含有一对未共用电子对,有与其它原子共享这对电子的倾 向,所以胺具有碱性和亲核性。在芳香胺中,山于未共用电子对与苯环π键发生部分重叠, 使N原子的sp3轨道的未成键电子对的p轨道性质增加,N原子山sp杂化趋向于p2杂化。 因此,这对未共用电子对与芳环的π电子可以形成Ⅱ共轭体系,使芳香胺的碱性和亲核 性都有明显的减弱。另外,芳香胺中的这种厂π共轭体系使芳环的电子云密度增大,因此 芳香胺在芳环上容易发生亲电取代反应。 1.碱性 氨基的未共用电子对能接受质子,因此胺显碱性。按的碱性强弱用离解常数Kb或其负 对数DKb表示,Kb愈大或DKb愈小,碱性愈强。胺可以和大多数酸反应生成盐。 RNH2+H2O-RNH3+OH RNH2+HCI RNHCI 在脂肪胺中,山于烷基的+【效应,使氨基上的电子云密度增加,接受质子的能力增强, 所以脂肪胺的碱性大于氨。在芳香胺中,山于氨基的未共用电子对与芳环的大π键形成厂 T共轭体系,使氨基上的电子密度降低,接受质子的能力械弱,所以它的碱性比氨弱。取代 苯胺的碱性强弱取决于取代基的性质,取代基为供电子基团时,使碱性增强:取代基为吸电 子基团时,使减性城弱。 胺的碱性强弱除与烃基的诱导效应和共轭效应有关外,还受到水的溶剂化效应,空间 位阻效应等因素的影响。胺分子中,氮上连接的氢愈多,溶剂化程度愈大,铵正离子就愈稳 定,胺的碱性也愈强:氮上取代的烃基愈多,空间位阻愈大,使质子个易与氮原子接近,胺 的碱性也就愈弱。 综合以上各种效应的作用结果,胺类化合物的碱性强弱次序一般为: 脂肪族仲胺>脂肪族伯胺〉脂肪族叔胺〉氨〉芳香族伯胶〉芳香族仲胺〉芳香族叔胺 山于胺是弱碱,与酸生成的铵盐遇强碱会释放出原来的胺。 RN H:CI+NaOH RNH2 +NaCl+H2O 可以利用这一性质进行胺的分离、提纯。1将不溶于水的胺溶于稀酸形成盐,经分离后, 再用强碱将胺山铵盐中释放出来。 2.烷基化反应 卤代烃可以与氨作用生成胺,胺作为亲核试剂又可以继续与卤代烃发生亲核取代反应, 结果得到仲胺、叔胺,直至生成季铵盐。 NH;+RX -RNH2+HX RNH2+RX RNH+HX RNH+RX RN+HX
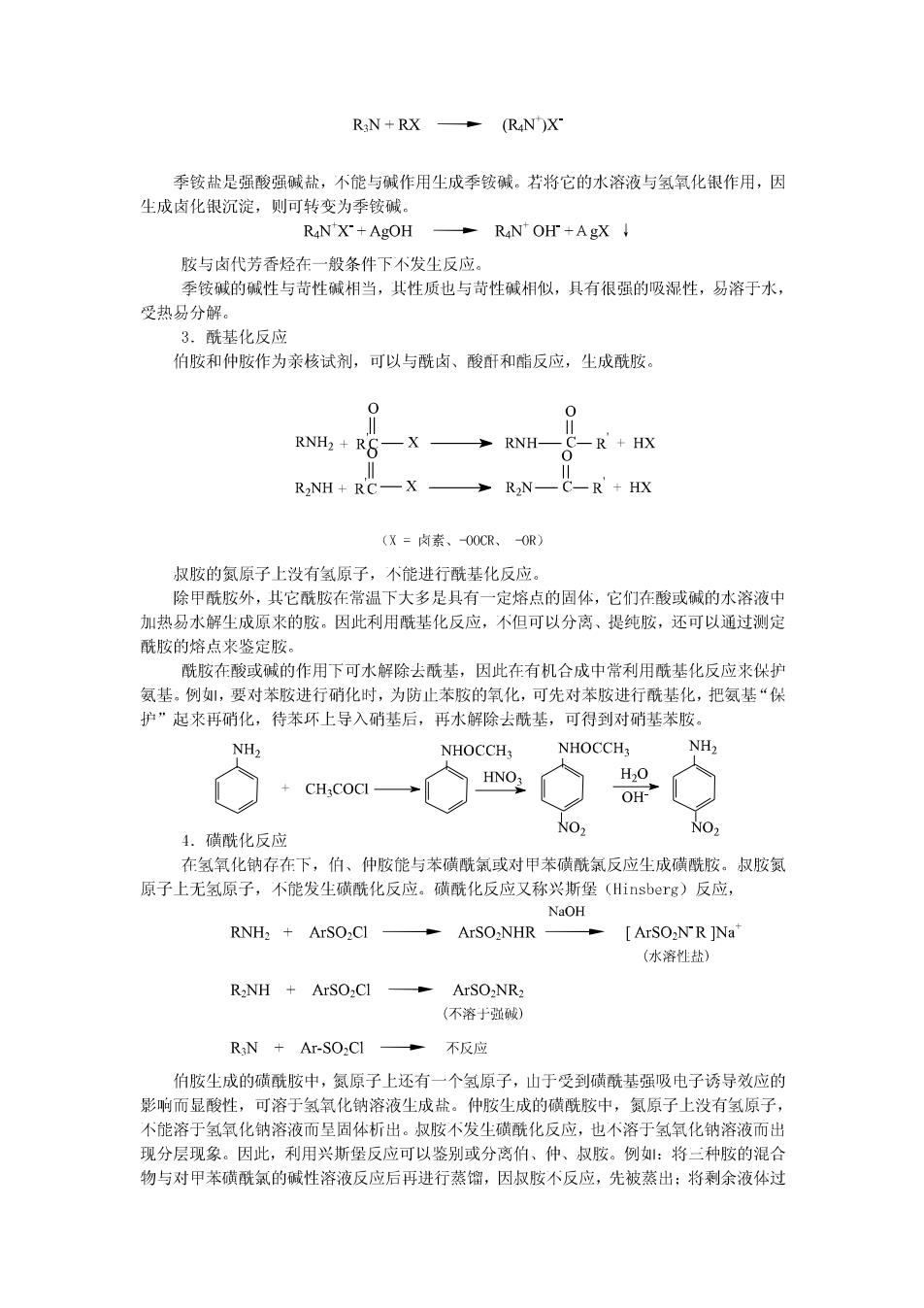
RiN+RX (R4N)X 季铵盐是强酸强碱盐,不能与碱作用生成季铵减。若将它的水溶夜与氢氧化银作用,因 尘成卤化银沉淀,则可转变为季铵碱。 RANX+AgOH R4NOH+AgX↓ 胺与卤代芳香烃在一般条件下不发生反应。 季铵碱的碱性与苛性碱相当,其性质也与苛性碱相似,具有很强的吸湿性,易溶于水, 受热易分解。 3.酰基化反应 伯胺和仲胺作为亲核试剂,可以与酰卤、酸酐和酯反应,生成酰胺。 0 0 RNH,+RS一X RNH- C-R+HX RNH+RC—X多RN—C-R'+HX (X=卤素、O0CR、OR) 叔胺的氮原子上没有氢原子,不能进行酰基化反应。 除甲酰胺外,其它酰胺在常温下大多是具有一定熔点的固体,它们在酸或碱的水溶液中 加热易水解生成原来的胺。因此利用酰基化反应,不但可以分离、提纯胺,还可以通过测定 酰胺的熔点来鉴定胺。 酰胺在酸或碱的作用下可水解除去酰基,因此在有机合成中常利用酰基化反应来保护 氨基。例,要对苯胺进行硝化时,为防止苯胺的氧化,可先对苯胺进行酰基化,把氨基“保 护”起来再硝化,待苯环上导入硝基后,再水解除去酰基,可得到对硝基苯胺。 NH2 NHOCCH NHOCCH NH2 HNO H2O CHCOCI OH- NO NO2 4.磺酰化反应 在氢氧化钠存在下,伯、仲胺能与苯磺酰氯或对甲苯磺酰氣反应生成磺酰胺。叔胺氮 原子上无氢原子,不能发生磺酰化反应。磺酰化反应又称兴斯堡(Hinsberg)反应, NaOH RNH2+ArSO2Cl ArSO-NHR ArSO2NR ]Na (水溶性盐) RNH ArSO,CI ArSO-NR2 (不溶于强碱) R3N Ar-SO2CI 。不反应 伯胺尘成的磺酰胺中,氮原子上还有一个氢原子,山于受到磺酰基强吸电子诱导效应的 影响而显酸性,可溶于氢氧化钠溶液生成盐。仲胺生成的磺酰胺中,氮原子上没有氢原子, 不能溶于氢氧化钠溶液而呈固体析出。叔胺不发生磺酰化反应,也不溶于氢氧化钠溶液而出 现分层现象。因此,利用兴斯堡反应可以鉴别或分离伯、仲、叔胺。例:将三种胺的混合 物与对甲苯磺酰氯的碱性溶液反应后再进行蒸馏,因叔胺不反应,先被蒸出:将剩余液体过

滤,固体为仲胺的磺酰胺,加酸水解后可得到仲胺:滤液酸化后,水解得到伯胺。 5.与亚硝酸反应 不同的胺与亚硝酸反应,产物各不相同。山于亚硝酸不稳定,在反应中实际使用的是亚 硝酸钠与盐酸的混合物。 NaNO2+HCI HNO2 NaCl 脂肪族伯胺与亚硝酸反应,生成醇、烯烃、卤代烃等混合物,在合成上没有价值。但 放出的氮气是定量的,可用于氨基的定量分析。 RNH2 NaNO2+HCl 。醇、烯、卤代烃等混合物+↑ 芳香族伯胺与亚硝酸在低温下反应,生成重氮盐。芳香族重氮盐在低温(5℃以下)和 强酸水溶液中是稳定的,升高温度则分解成酚和氮气。 ArNH2+NaNO2 HCI [ArN=N]+C1-H2O ArOH+N2↑ 0-5℃ 仲胺与亚硝酸反应,生成N-亚硝基胺。N-亚硝基胺为不溶于水的黄色油状液体或固体, 有致癌作用,能引发多种器官或组织的肿瘤。 R2NH HNO2 R2N-NO (Ar)2NH HNO2 (Ar)2N-NO N-亚硝基胺与稀酸共热,可分解为原来的胺,可用来鉴别或分离提纯仲胺。 脂肪族叔胺因氮原子上没有氢,只能与亚硝酸形成不稳定的盐。 RN+HNO2◆ RaN HNO2 芳香族叔胺与亚硝酸反应,在芳环上发生亲电取代反应导入亚硝基。例: N(CH3)2+HNO2 O N(CH3)2 对亚硝基-N,N-二甲基苯胺 亚硝化的芳香族叔胺通常带有颜色,在不同介质中,其结构个同,颜色也不相同。 根据脂肪族和芳香族伯、仲、叔胺与亚硝酸反应的不同结果,可以鉴别伯、仲、叔胺。 6.芳香胺的取代反应 芳香胺中,氨基的未共用电子对与芳环的π电子形成Dπ共轭体系,使芳环的电子云 密度增大,因此芳香胺特别容易在芳环上发生亲电取代反应。例,苯胺非常容易进行卤代 反应,而月常常生成多卤代产物: NH2 NH Br Br2 (H2O) (白色↓) Br 如先进行酰基化以降低氨基的致活作用,再进行卤代反应可得到一卤代产物。例如:

NH2 NHCCH NHCCH3 NH, CH;COCI Br2 H20 OH 乐 Br 苯胺用浓硫酸磺化时,首先生成盐,在加训热下失水生成对氨基苯磺酸。例: NH NHSOH H,S04 △ SOH 7.霍夫曼消除反应 季铵碱受热很容易分解,产物和烃基的结构有关。如果烃基没有B-氢原子,加热分解 成叔胺和醇。例: (CHs)NOHA 如果烃基含有B-氢原子,加热分解成烯烃、叔胺和水。例: (CH)N'CH.CH.OHr_A→ CH2=CH2 (CHs)3 N +H2O N(CH3)3OH_△ +(CH),N+H20 如果有多个烃基金有B一氢原子,不同烃基消除B-氢原子生成烯烃的难易顺序为: CH,CH->RCH-CHz->R2CHCHz-,结果主要得到双键碳原子上连有较少烷基的烯烃,这个规 律称为霍夫曼消除规则。例: CHCHCHCH.CHN (CH)OH CH,CH:CH.CHCH-CH+CH,CH.CHCH-CHCH, CH; 96% 4% +(CH3)N+H2O 四.重氮化合物和偶氨化合物 重氮化合物和偶氮化合物分子中都含有-N2基团,该基团只有一端与烃基相连时叫做重 氨化合物,两端都与烃基相连时叫做偶氮化合物。 ArN=NC17 ArN-NAr 重氮化合物 偶氮化合物 1.重氮化合物 重氮盐是离子型化合物,具有盐的性质,易溶于水,不溶于一般有机溶剂。 重氮盐只在低温的溶液中才能稳定存在,干燥的重氮盐对热和震动都很敏感,易发生尘 爆炸。制备时一般不从溶液中分离出来,直接进行下一步反应。重氮盐的化学性质很活泼, 能发生多种反应。 (1)取代反应重氮盐分子中的重氮基带有正电荷,是很强的吸电子基团,它使C一N
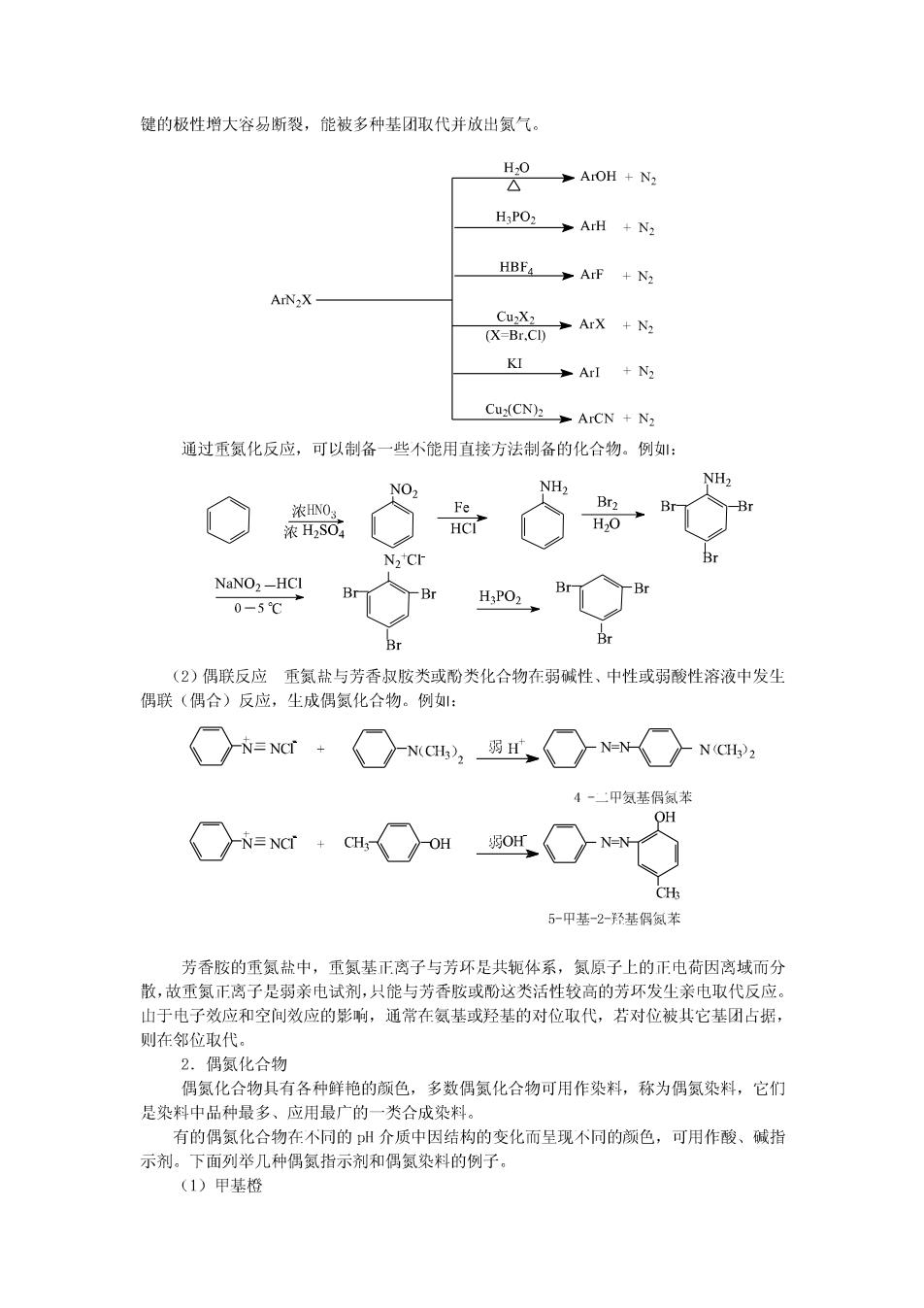
键的极性增大容易断裂,能被多种基团取代并放出氮气。 HO ArOH N2 H3PO2>ArH N2 HBF4>ArF +N2 ArN2X- CuX (X=Br.Cl) ArX N2 KI ArI +N2 Cu:(CN)2ArCN +N2 通过重氮化反应,可以制备一些不能用直接方法制备的化合物。例: NH2 NH2 NO 浓HNO Fe Br, Br 浓H2SO HCI H20 Br NaNO,-HCI Br H:PO, 0-5℃ Br (2)偶联反应重氮盐与芳香叔胺类或酚类化合物在弱碱性、中性或弱酸性溶液中发生 偶联(偶合)反应,生成偶氮化合物。例: N=NCI+ N(CH3),_ 弱 N-N N(CHp2 4-甲氨基偶氮苯 OH N≡NCr+CH OH 弱OH N=N CH: 5-甲基-2-羟基侣氮苯 芳香胺的重氮盐中,重氮基正离子与芳环是共轭体系,氮原子上的正电荷因离域而分 散,故重氮正离子是弱亲电试剂,只能与芳香胺或酚这类活性较高的芳环发尘亲电取代反应。 山于电子效应和空间效应的影响,通常在氨基或羟基的对位取代,若对位被其它基团占据, 则在邻位取代。 2.偶氮化合物 偶氮化合物具有各种鲜艳的颜色,多数偶氮化合物可用作染料,称为偶氮染料,它们 是染料中品种最多、应用最广的一类合成染料。 有的偶氮化合物在不同的州介质中因结构的变化而呈现不同的颜色,可用作酸、碱指 示剂。下面列举几种偶氮指示剂和偶氮染料的例子。 (1)甲基橙
(2)刚果红 五.个别化合物 1.苯胺 2.乙二胺 3.已二胺 4.胆胺和胆碱 HOCHCH2NH2 HOCH2CH2N'(CH;)3OH 胆胶(2-氨基乙醇) 胆碱(氢氧化三甲基羟乙基铵) 5.多巴和多巴胺 第二节 酰 胺 一,酰胺的结构和命名 在酰胺分子中,氨基氮原子上的未共用电子对与羰基形成p共轭体系,因此羰基与 氨基间的C-N单键具有部分双键的性质,在常温下不能自山旋转,酰基的C、N、0以及与C、 N直接相连的其它原子就处于同一平面上。酰胺的这种半面结构不仪影响着它的性质,对蛋 白质的构象也有重要意义。 酰胺通常根据酰基来命名,称为“某酰胺”,连接在氮原子上的烃基用“N某基”表示。 例: 0 0 -NH H NHCH3 C-N(CH3) 乙酰胺 N-甲基甲酰胺 N,N-二甲基苯甲酰胺 氨基上连接有两个酰基时,称为“某酰亚胺”。例如: 0 CH3C NH NH CH3- 0 二乙酰亚胺 邻苯二甲酰亚胺 二.酰胺的物理性质 酰胺分子间可通过氢键缔合,熔点和沸点较高,除甲酰胺外都是固体。氨基上有烃基取 代时,分子间的缔合程度减小,熔点和沸点降低。山于酰胺可与水形成氢键,所以低级酰胺 易溶于水,随着分子量的增大,在水中的溶解度逐渐减小。 三.酰胺的化学性质 1.酸碱性 酰胺分子中,氨基上的未共用电子对与羰基形成少π共轭体系,使氮原子上的电子云 密度降低,减弱了氨基接受质子的能力,是近乎中性的化合物
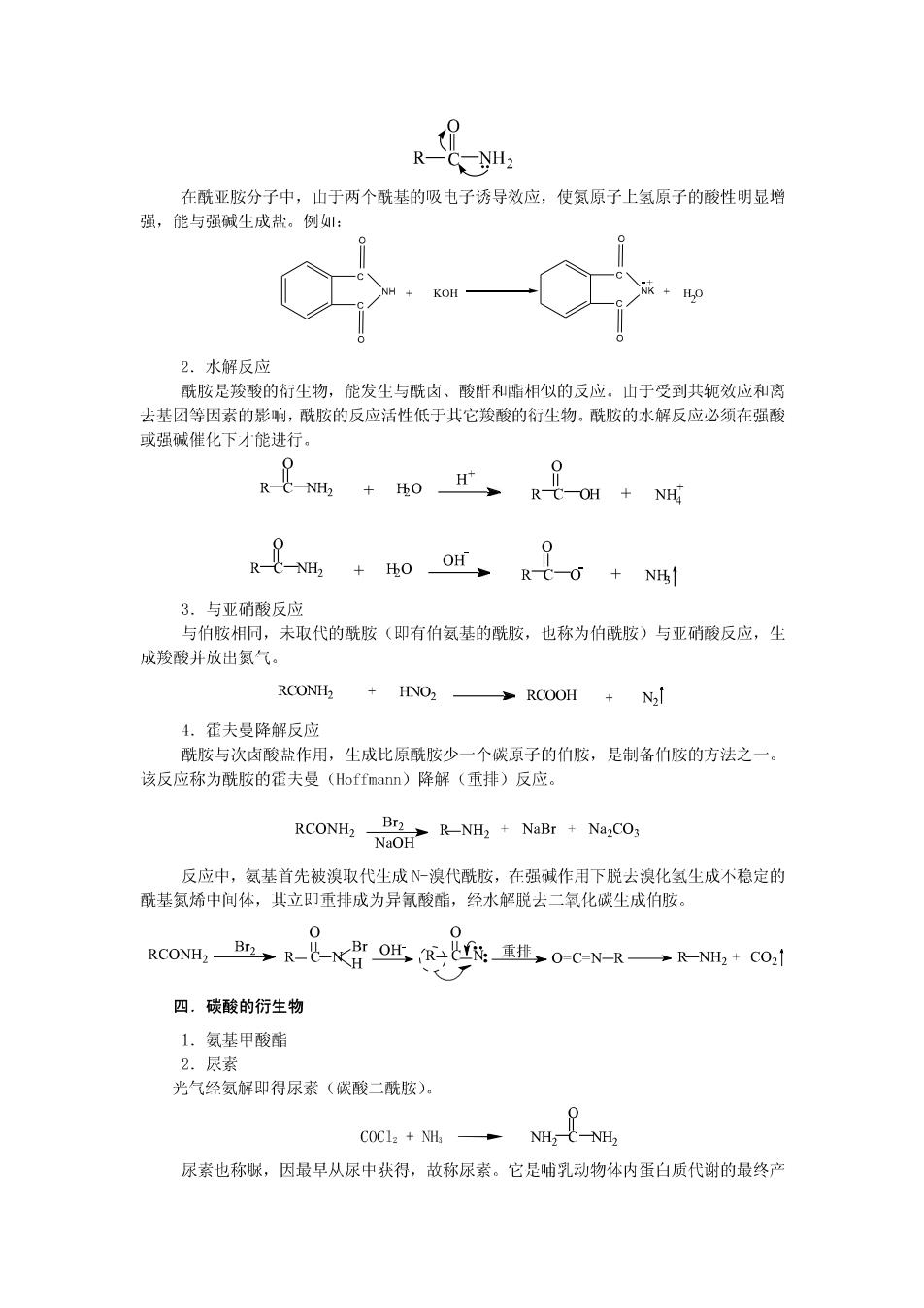
R-C NH2 在酰亚胺分子中,山于两个酰基的吸电子诱导效应,使氮原子上氢原子的酸性明显增 强,能与强碱生成盐。例: 2.水解反应 酰胺是羧酸的衍生物,能发生与酰卤、酸断和脂相似的反应。山于受到共轭效应和离 去基团等因素的影响,酰胺的反应活性低于其它羧酸的衍生物。酰胺的水解反应必须在强酸 或强碱催化下才能进行。 Q R- NH. +0 H R-C OH NH RC-NH2+HO OH RC-O NH 3.与亚硝酸反应 与伯胺相同,未取代的酰胺(即有伯氨基的酰胺,也称为伯酰胺)与亚硝酸反应,尘 成羧酸并放出氮气。 RCONH2 +HNO2—RCOOH+N2 4.霍夫曼降解反应 酰胺与次卤酸盐作用,生成比原酰胺少一个碳原子的伯胺,是制备伯胺的方法之一。 该反应称为酰胺的霍夫曼(Hoffmann)降解(重排)反应。 RCONH:NOR-NH2 NaBr NaCO. 反应中,氨基首先被溴取代尘成N-溴代酰胺,在强碱作用下脱去溴化氢生成不稳定的 酰基氮烯中间体,其立即重排成为异氰酸酯,经水解脱去二氧化碳生成伯胺。 0 RCONH2- B2,R--Br OH R:重挂,0-C=N-RR-N,+CO1 四.碳酸的衍生物 1.氨基甲酸酯 2.尿素 光气经氨解即得尿素(碳酸二酰胺)。 COC12 NHa NH,C-NH, 尿素也称脲,因最早从尿中获得,故称尿素。它是哺乳动物体内蛋白质代谢的最终产