正在加载图片...
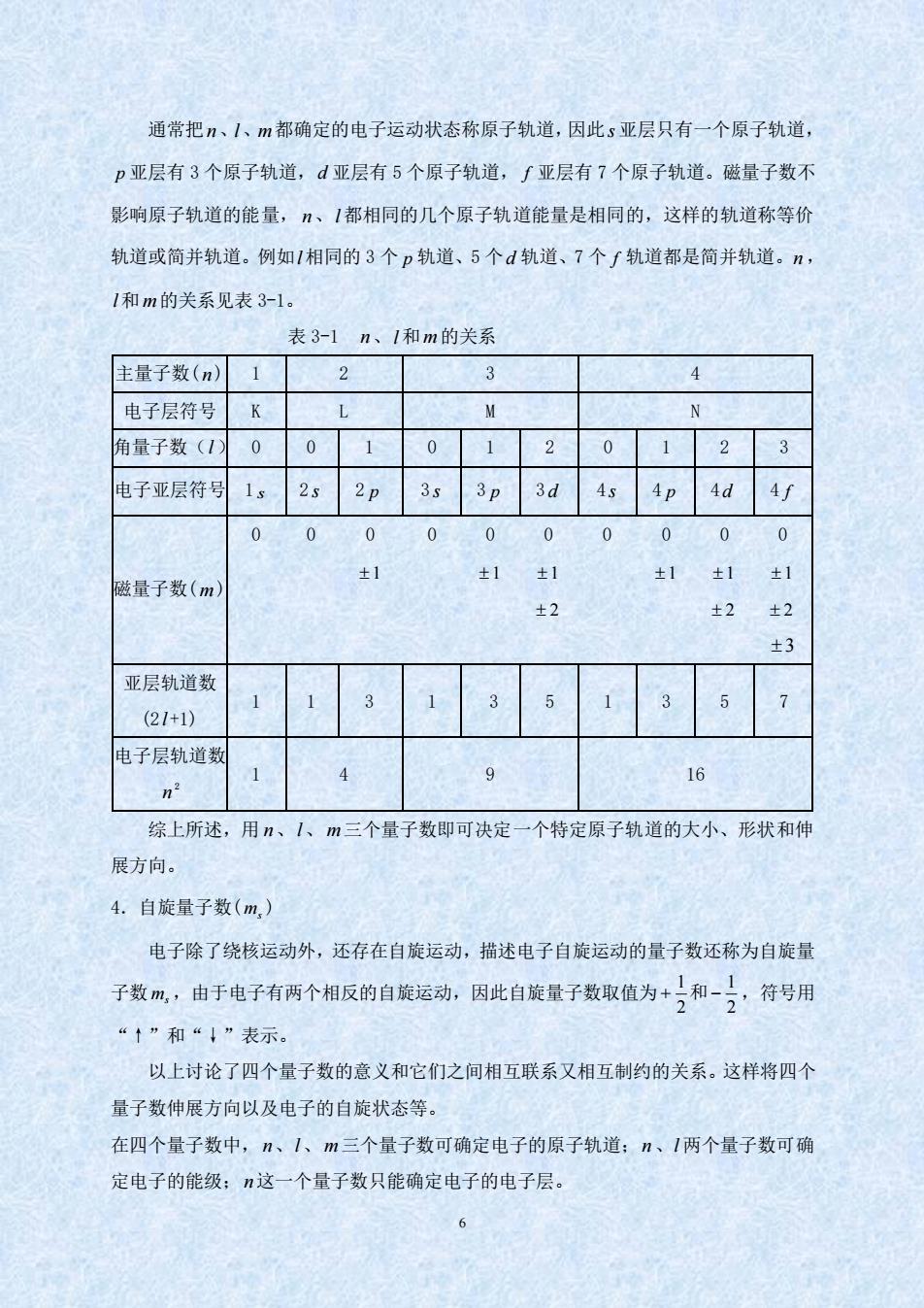
通常把、1、m都确定的电子运动状态称原子轨道,因此s亚层只有一个原子轨道, p亚层有3个原子轨道,d亚层有5个原子轨道,∫亚层有7个原子轨道。磁量子数不 影响原子轨道的能量,、1都相同的几个原子轨道能量是相同的,这样的轨道称等价 轨道或简并轨道。例如1相同的3个p轨道、5个d轨道、7个∫轨道都是简并轨道。n, 1和m的关系见表3-1。 表3-1n、1和m的关系 主量子数(n)1 2 3 4 电子层符号K N 角量子数(10 0 0 120123 电子亚层符号1s2s2p 3s 3p 3d 4s 4p 4d 4f 0 0 0 000000 0 ±1 ±1±1 ±1 ±1 磁量子数(m) ±1 ±2 ±2 ±2 +3 亚层轨道数 35 3 (21+1) 电子层轨道数 n2 9 16 综上所述,用n、1、m三个量子数即可决定一个特定原子轨道的大小、形状和伸 展方向。 4.自旋量子数(m,) 电子除了绕核运动外,还存在自旋运动,描述电子自旋运动的量子数还称为自旋量 子数m,由于电子有两个相反的自旋运动,因此自旋量子数取值为+)和-),符号用 “↑”和“↓”表示。 以上讨论了四个量子数的意义和它们之间相互联系又相互制约的关系。这样将四个 量子数伸展方向以及电子的自旋状态等。 在四个量子数中,n、1、m三个量子数可确定电子的原子轨道:n、1两个量子数可确 定电子的能级:n这一个量子数只能确定电子的电子层。 6 6 通常把 n、l、m 都确定的电子运动状态称原子轨道,因此 s 亚层只有一个原子轨道, p 亚层有 3 个原子轨道, d 亚层有 5 个原子轨道, f 亚层有 7 个原子轨道。磁量子数不 影响原子轨道的能量, n、l 都相同的几个原子轨道能量是相同的,这样的轨道称等价 轨道或简并轨道。例如 l 相同的 3 个 p 轨道、5 个 d 轨道、7 个 f 轨道都是简并轨道。 n , l 和 m 的关系见表 3-1。 表 3-1 n、l 和 m 的关系 主量子数( n ) 1 2 3 4 电子层符号 K L M N 角量子数( l ) 0 0 1 0 1 2 0 1 2 3 电子亚层符号 1 s 2 s 2 p 3 s 3 p 3 d 4 s 4 p 4 d 4 f 磁量子数( m ) 0 0 0 0 0 0 0 0 0 0 1 1 1 1 1 1 2 2 2 3 亚层轨道数 (2 l +1) 1 1 3 1 3 5 1 3 5 7 电子层轨道数 n 2 1 4 9 16 综上所述,用 n、l 、m 三个量子数即可决定一个特定原子轨道的大小、形状和伸 展方向。 4.自旋量子数( ms ) 电子除了绕核运动外,还存在自旋运动,描述电子自旋运动的量子数还称为自旋量 子数 ms ,由于电子有两个相反的自旋运动,因此自旋量子数取值为 2 1 2 1 + 和 − ,符号用 “↑”和“↓”表示。 以上讨论了四个量子数的意义和它们之间相互联系又相互制约的关系。这样将四个 量子数伸展方向以及电子的自旋状态等。 在四个量子数中, n、l 、m 三个量子数可确定电子的原子轨道; n、l 两个量子数可确 定电子的能级; n 这一个量子数只能确定电子的电子层