正在加载图片...
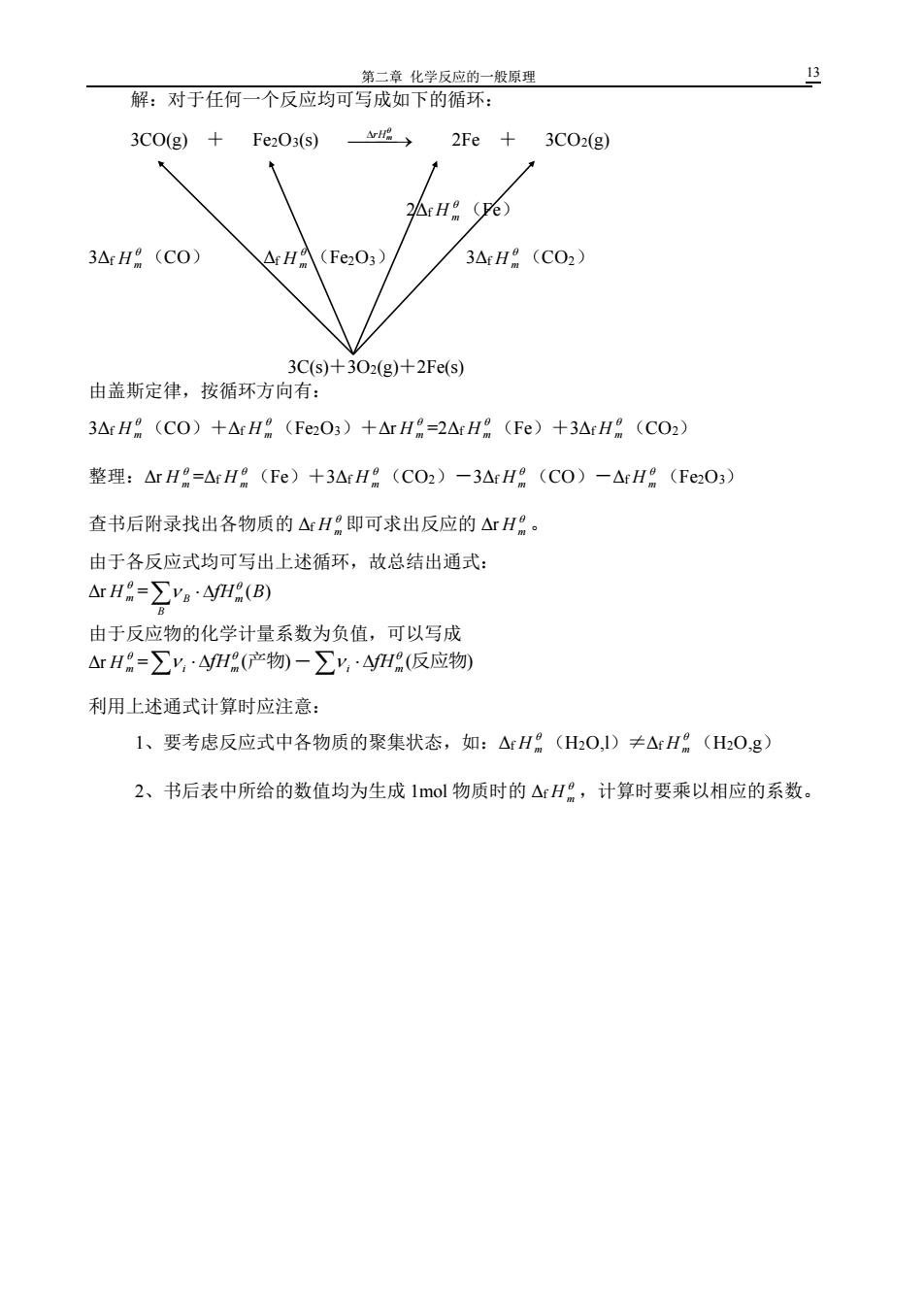
第二章化学反应的一般原理 解:对于任何一个反应均可写成如下的循环: 3C0(g)+ Fe2O3(s) 成→ 2Fe+3C02(g) Ar H (ve) 3△rH(CO) △rHA(Fe2O3) 3ArH (CO2) 3Cs)+302(g)+2Fe(s) 由盖斯定律,按循环方向有: 3ArH(C0)+△rH(Fe2O3)+△rH=2△rH(Fe)+3ArH8(CO2) 整理:△rH=△rH(FC)+3△rH(CO2)-3△rH:(CO)-△rH。(Fe2O3) 查书后附录找出各物质的△H即可求出反应的△rH:。 由于各反应式均可写出上述循环,故总结出通式: ArH=∑ya·4yHR(B) 由于反应物的化学计量系数为负值,可以写成 △rH=∑y,4H(产物)-∑y,·4H(反应物 利用上述通式计算时应注意: 1、要考虑反应式中各物质的聚集状态,如:△H(H2O,1)≠△H(HzO,g) 2、书后表中所给的数值均为生成1mol物质时的△rH,计算时要乘以相应的系数。第二章 化学反应的一般原理 13 解:对于任何一个反应均可写成如下的循环: 3CO(g) + Fe2O3(s) ⎯ ⎯→ rHm 2Fe + 3CO2(g) 2Δf H m (Fe) 3Δf H m (CO) Δf H m (Fe2O3) 3Δf H m (CO2) 3C(s)+3O2(g)+2Fe(s) 由盖斯定律,按循环方向有: 3Δf H m (CO)+Δf H m (Fe2O3)+Δr H m =2Δf H m (Fe)+3Δf H m (CO2) 整理:Δr H m =Δf H m (Fe)+3Δf H m (CO2)-3Δf H m (CO)-Δf H m (Fe2O3) 查书后附录找出各物质的 Δf H m 即可求出反应的 Δr H m 。 由于各反应式均可写出上述循环,故总结出通式: Δr H m = B B fHm (B) 由于反应物的化学计量系数为负值,可以写成 Δr H m = (产物) i m fH - (反应物) i m fH 利用上述通式计算时应注意: 1、要考虑反应式中各物质的聚集状态,如:Δf H m (H2O,l)≠Δf H m (H2O,g) 2、书后表中所给的数值均为生成 1mol 物质时的 Δf H m ,计算时要乘以相应的系数