正在加载图片...
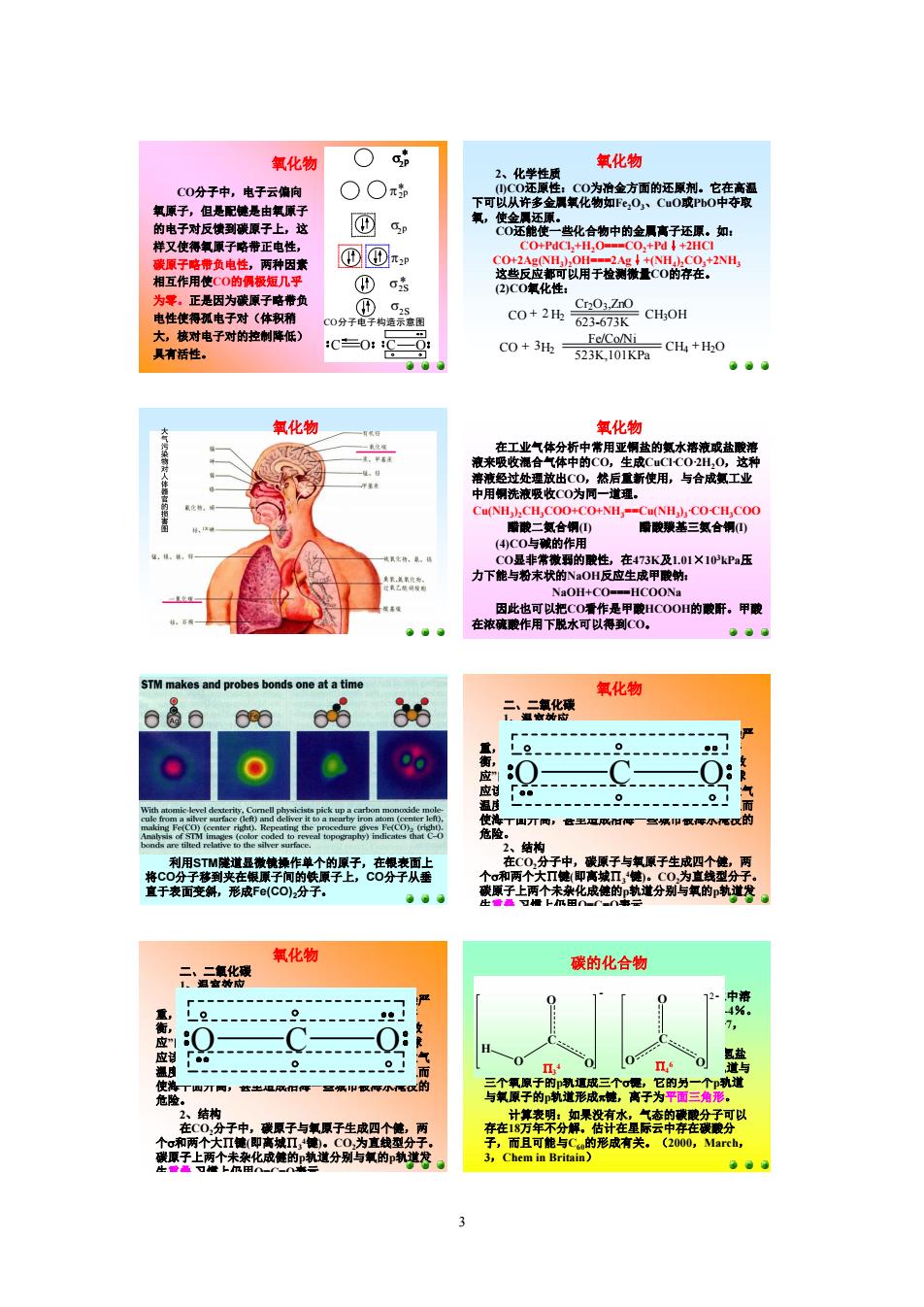
氧化钩 ○ 氧化物 0中,子云向 ○○a 氧原子,但是配是由氧原与 可以 样又使海子略带正电性 咨化合物中的金属高子还原。知: D①x 2C0氧化性: 为零 ,正是因为碳原子略带 c0+2h2-67 c0+352101Km :CH+H-O 氧化转 氧化物 的氯水 经过处放出( ,松后 新使用,与合工业 CH. Co+NH, 的作 01X10P压 力下能与粉末状的 STM and probes bonds one at a tim 氧化物 6 · 1。 氧原子生收四个, 原千两个化成德的 道分别与氧的航道 氧化物 碳的化合物 Le. 0 0●03 氧化物 CO分子中,电子云偏向 氧原子,但是配键是由氧原子 的电子对反馈到碳原子上,这 样又使得氧原子略带正电性, 碳原子略带负电性,两种因素 相互作用使CO的偶极短几乎 为零。正是因为碳原子略带负 电性使得孤电子对(体积稍 大,核对电子对的控制降低) 具有活性。 C O p s2s s2s * s2p 2*p s2p* 2p s* 2p* p2p CO分子电子构造示意图 C O 氧化物 2、化学性质 (l)CO还原性:CO为冶金方面的还原剂。它在高温 下可以从许多金属氧化物如Fe 2O 3、CuO或PbO中夺取 氧,使金属还原。 CO还能使一些化合物中的金属离子还原。如: CO+PdCl 2+H 2O===CO 2+Pd↓+2HCl CO+2Ag(NH 3) 2OH===2Ag↓+(NH 4) 2CO 3+2NH 3 这些反应都可以用于检测微量CO的存在。 (2)CO氧化性: + H + CO 2 + 523K,101KPa 623673K 3 2 Fe/Co/Ni Cr2O3,ZnO CH4 H2O CH H 3 OH CO 2 (3)CO的配合性:由于CO分子中有孤对电子, 可以作配体与一些有空轨道的金属原子或离子形成配 合物。例如同VIB、VIIB和VIII族的过渡金属形成羰 基配合物:Fe(CO)5、Ni(CO)4和Cr(CO) 6等(在过渡金 属中讲)。 CO有毒,它能与血液中携带O 2的血红蛋白(Hb) 形成稳定的配合物COHb。CO与Hb的亲和力约为O 2 与Hb的230—270倍。COHb配合物一旦形成后,就 使血红蛋白丧失了输送氧气的能力。所以CO中毒将 导致组织低氧症.如果血液中50%的血红蛋白与CO结 合,即可引起心肌坏死. 大气污染 物对人体器官的损 害图 氧化物 在工业气体分析中常用亚铜盐的氨水溶液或盐酸溶 液来吸收混合气体中的CO,生成CuCl·CO·2H 2O,这种 溶液经过处理放出CO,然后重新使用,与合成氨工业 中用铜洗液吸收CO为同一道理。 Cu(NH 3) 2CH 3COO+CO+NH 3==Cu(NH 3) 3·CO·CH 3COO 醋酸二氨合铜(I) 醋酸羰基三氨合铜(I) (4)CO与碱的作用 CO显非常微弱的酸性,在473K及1.01×10 3kPa压 力下能与粉末状的NaOH反应生成甲酸钠: NaOH+CO===HCOONa 因此也可以把CO看作是甲酸HCOOH的酸酐。甲酸 在浓硫酸作用下脱水可以得到CO。 氧化物 利用STM隧道显微镜操作单个的原子,在银表面上 将CO分子移到夹在银原子间的铁原子上,CO分子从垂 直于表面变斜,形成Fe(CO)2分子。 二、二氧化碳 1、温室效应 近几十年来由于世界工业高速发展,各类污染严 重,森林又滥遭砍伐,石油轮泻油,影响了生态平 衡,使大气中的CO 2越来越多,是造成地球“温室效 应”的主要原因。CO 2能吸收红外光,这就使得地球 应该失去的那部分能量被储存在大气层内,造成大气 温度升高。会使地球两极的冰山发生部分融化,从而 使海平面升高,甚至造成沿海一些城市被海水淹没的 危险。 2、结构 在CO 2分子中,碳原子与氧原子生成四个健,两 个s和两个大∏键(即离城∏3 4键)。CO 2为直线型分子。 碳原子上两个未杂化成健的p轨道分别与氧的p轨道发 生重叠,习惯上仍用O=C=O表示。 氧化物 O C O 二、二氧化碳 1、温室效应 近几十年来由于世界工业高速发展,各类污染严 重,森林又滥遭砍伐,石油轮泻油,影响了生态平 衡,使大气中的CO 2越来越多,是造成地球“温室效 应”的主要原因。CO 2能吸收红外光,这就使得地球 应该失去的那部分能量被储存在大气层内,造成大气 温度升高。会使地球两极的冰山发生部分融化,从而 使海平面升高,甚至造成沿海一些城市被海水淹没的 危险。 2、结构 在CO 2分子中,碳原子与氧原子生成四个健,两 个s和两个大∏键(即离城∏3 4键)。CO 2为直线型分子。 碳原子上两个未杂化成健的p轨道分别与氧的p轨道发 生重叠,习惯上仍用O=C=O表示。 氧化物 O C O 一、碳酸和碳酸盐 CO 2在水中的溶解度不大,298K时,1L水中溶 1.45g(约0.033mol)。CO 2转变成H 2CO 3的只有14%。 因为CO 2能溶于水,所以蒸馏水的PH值常小于7, 酸碱滴定时粉色的酚酞溶液在空气中能退色。 H 2CO 3是二元弱酸,能生成两种盐:碳酸氢盐 和碳酸盐。碳原子在这两种离子中均以sp 2化轨道与 三个氧原子的p轨道成三个s键,它的另一个p轨道 与氧原子的p轨道形成p键,离子为平面三角形。 碳的化合物 计算表明:如果没有水,气态的碳酸分子可以 存在18万年不分解。估计在星际云中存在碳酸分 子,而且可能与C 60的形成有关。(2000,March, 3,Chem in Britain) C O O O H C O O O 2 P4 6 P3 4