正在加载图片...
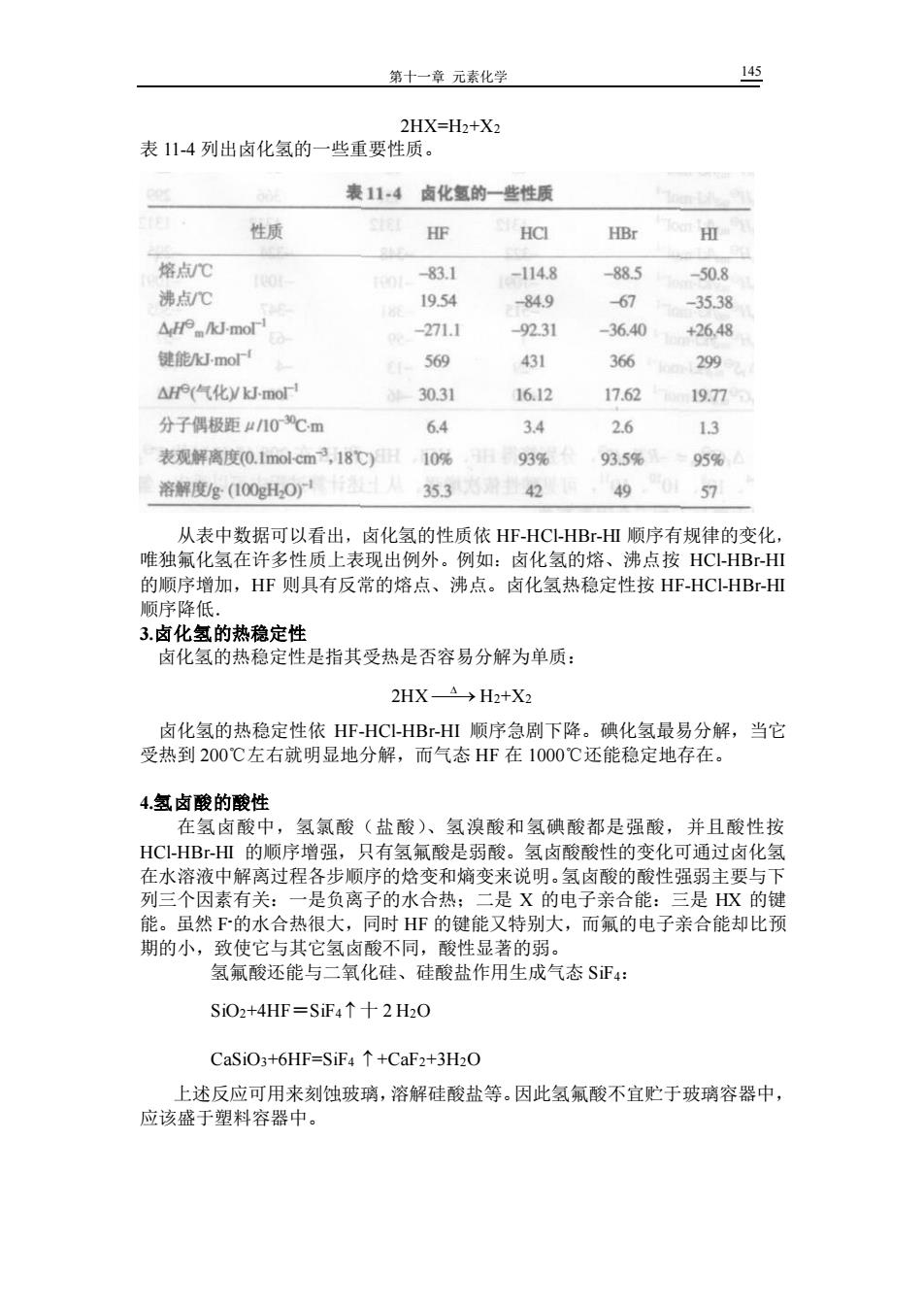
第十一章元素化学 2HX=H2+X2 表14列出卤化氢的一些重要性质, 表114卤化氢的一些性质 性质 HF HCI HBr 用 惊占℃ -83.1 -114.8 -88.5 -50.8 沸点C 19.54 -84.9 67 -35.38 △.Jmor -271.1 9231 -36.40 +26,48 键能mo' 569 431 366 299 △e气化ymo 30.31 16.12 17.62 19.7 分子偶极距r10℃m 6.4 34 2.6 13 表观解离度(0.1 nol cm3,18℃)日10% 93% 935 95% 溶解度g(100gH,O)12 35.3 42 49 57 从表中数据可以看出,卤化氢的性质依HF-HC-HB-HΠ领序有规律的变化 唯独氟化氢在许多性质上表现出例外。例如: 卤化氢的熔、 沸点按HC-HBr-HI 的顺序增加,HF则具有反常的熔点、沸点。卤化氢热稳定性按HF-HC-HBr-Ⅲ 顺序降低。 3.卤化氢的热稳定性 卤化氢的热稳定性是指其受热是否容易分解为单质: 2HXA→H2+X3 卤化氢的热稳定性依HF-HCHBⅢ顺序急剧下降。碘化氢最易分解,当它 受热到200℃左右就明显地分解,而气态HF在1000℃还能稳定地存在。 4.氢卤酸的酸性 在氢卤酸中,氢氯酸(盐酸)、氢溴酸和氢碘酸都是强酸,并且酸性按 HCl-HBr-HⅢ的顺序增强,只有氢氟酸是弱酸。氢卤酸酸性的变化可通过卤化氢 在水溶液中解离过程各步顺序的焓变和熵变来说明,氢卤酸的酸性强弱主要与下 列三个因素有关:一是负离子的水合热:二是X的电子亲合能:三是K的键 能。虽然下的水合热很大,同时HF的键能又特别大,而氟的电子亲合能却比预 期的小, 致使它与其它氢卤酸不同,酸性显著的弱, 氢氟酸还能与二氧化硅、硅酸盐作用生成气态S正4: SiO2+4HF=S证4↑十2H20 CaSiO3+6HF=SiF4+CaF2+3H2O 上述反应可用来刻蚀玻璃,溶解硅酸盐等。因此氢氟酸不宜贮于玻璃容器中, 应该盛于塑料容器中。第十一章 元素化学 145 2HX=H2+X2 表 11-4 列出卤化氢的一些重要性质。 从表中数据可以看出,卤化氢的性质依 HF-HCl-HBr-HI 顺序有规律的变化, 唯独氟化氢在许多性质上表现出例外。例如:卤化氢的熔、沸点按 HCl-HBr-HI 的顺序增加,HF 则具有反常的熔点、沸点。卤化氢热稳定性按 HF-HCl-HBr-HI 顺序降低. 3.卤化氢的热稳定性 卤化氢的热稳定性是指其受热是否容易分解为单质: 2HX ⎯⎯→ H2+X2 卤化氢的热稳定性依 HF-HCl-HBr-HI 顺序急剧下降。碘化氢最易分解,当它 受热到 200℃左右就明显地分解,而气态 HF 在 1000℃还能稳定地存在。 4.氢卤酸的酸性 在氢卤酸中,氢氯酸(盐酸)、氢溴酸和氢碘酸都是强酸,并且酸性按 HCl-HBr-HI 的顺序增强,只有氢氟酸是弱酸。氢卤酸酸性的变化可通过卤化氢 在水溶液中解离过程各步顺序的焓变和熵变来说明。氢卤酸的酸性强弱主要与下 列三个因素有关:一是负离子的水合热;二是 X 的电子亲合能:三是 HX 的键 能。虽然 F -的水合热很大,同时 HF 的键能又特别大,而氟的电子亲合能却比预 期的小,致使它与其它氢卤酸不同,酸性显著的弱。 氢氟酸还能与二氧化硅、硅酸盐作用生成气态 SiF4: SiO2+4HF=SiF4 十 2 H2O CaSiO3+6HF=SiF4 +CaF2+3H2O 上述反应可用来刻蚀玻璃,溶解硅酸盐等。因此氢氟酸不宜贮于玻璃容器中, 应该盛于塑料容器中