第十一章元素化学 144 第十一章元素化学 一、教学基本要求 1.氢卤酸、卤化物 掌握卤化氢性质的变化规律,卤化物的溶解性、水解性(只要求锡、锑、 铋盐的水解):掌握卤离子的性质, 2.氧及氧化物 了解臭氧的结构和性质:掌握过氧化氢的结构与性质:掌握二氧化铅、二 氧化锰的性质。 3.氧化物、含氧酸及其盐 竿握OH规则及鲍林规则:理解含氧酸盐的溶解性与热稳定性:掌握氯的 含氧酸及其盐的主要性质及其变化规律:掌握硫酸、亚硫酸、硫代硫酸、过硫酸 及其盐的性质:掌握硝酸、亚硝酸及其盐的性质:掌握铋酸钠、重铬酸钾、高锰 酸钾的性质。 4.配位化合物 掌握氰合物、异硫氰合物、含氧酸配合物等简单配合物。 二、学时分配: 讲授内容 学时数(10.0) 1.氢卤酸、卤化物 3.5 2.氧及氧化物 2.0 3.氢氧化物、含氧酸及其盐 4.0 4.配位化合物 0.5 三、教学内容 §11一1氢卤酸、卤化物 11.1.1氢卤酸 1.卤化氢的制备 卤化氢的制备可采用由单质合成、复分解和卤化物的水解等方法。 2.卤化氢的性质 卤化氢均为具有强烈刺激性臭味的无色气体,在空气中易与水蒸气结合而形 成白色酸雾.卤化氢是极性分子,极易溶于水,其水溶液称为氢卤酸。卤化氢受 热分解为氢气和相应的卤素:
第十一章 元素化学 144 第十一章 元素化学 一、教学基本要求 1.氢卤酸、卤化物 掌握卤化氢性质的变化规律,卤化物的溶解性、水解性(只要求锡、锑、 铋盐的水解);掌握卤离子的性质。 2.氧及氧化物 了解臭氧的结构和性质;掌握过氧化氢的结构与性质;掌握二氧化铅、二 氧化锰的性质。 3.氧化物、含氧酸及其盐 掌握 ROH 规则及鲍林规则;理解含氧酸盐的溶解性与热稳定性;掌握氯的 含氧酸及其盐的主要性质及其变化规律;掌握硫酸、亚硫酸、硫代硫酸、过硫酸 及其盐的性质;掌握硝酸、亚硝酸及其盐的性质;掌握铋酸钠、重铬酸钾、高锰 酸钾的性质。 4.配位化合物 掌握氰合物、异硫氰合物、含氧酸配合物等简单配合物。 二、学时分配: 讲授内容 学时数(10.0) 1. 氢卤酸、卤化物 3.5 2. 氧及氧化物 2.0 3. 氢氧化物、含氧酸及其盐 4.0 4. 配位化合物 0.5 三、教学内容 §11—1 氢卤酸、卤化物 11.1.1 氢卤酸 1. 卤化氢的制备 卤化氢的制备可采用由单质合成、复分解和卤化物的水解等方法。 2. 卤化氢的性质 卤化氢均为具有强烈刺激性臭味的无色气体,在空气中易与水蒸气结合而形 成白色酸雾.卤化氢是极性分子,极易溶于水,其水溶液称为氢卤酸.卤化氢受 热分解为氢气和相应的卤素:
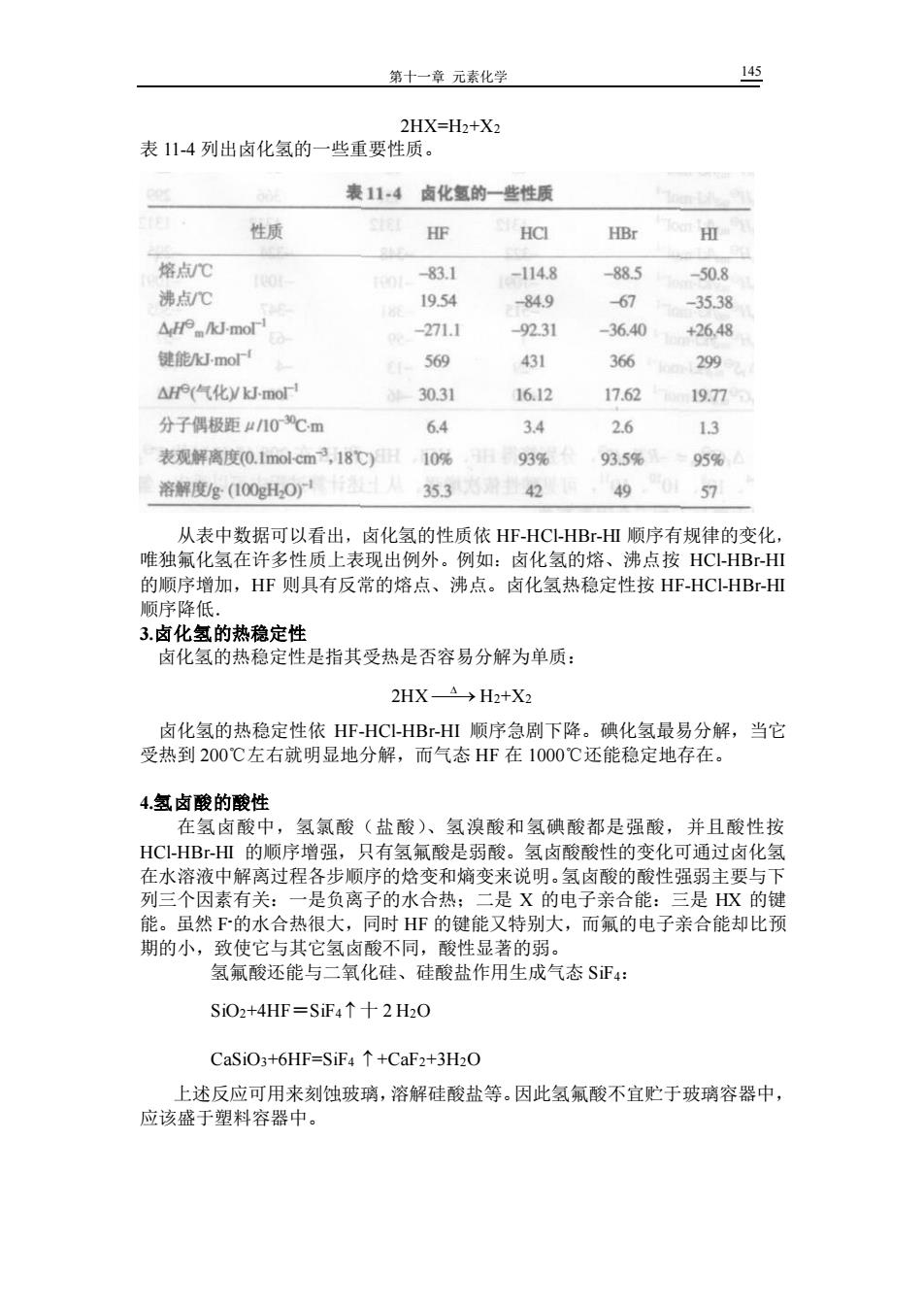
第十一章元素化学 2HX=H2+X2 表14列出卤化氢的一些重要性质, 表114卤化氢的一些性质 性质 HF HCI HBr 用 惊占℃ -83.1 -114.8 -88.5 -50.8 沸点C 19.54 -84.9 67 -35.38 △.Jmor -271.1 9231 -36.40 +26,48 键能mo' 569 431 366 299 △e气化ymo 30.31 16.12 17.62 19.7 分子偶极距r10℃m 6.4 34 2.6 13 表观解离度(0.1 nol cm3,18℃)日10% 93% 935 95% 溶解度g(100gH,O)12 35.3 42 49 57 从表中数据可以看出,卤化氢的性质依HF-HC-HB-HΠ领序有规律的变化 唯独氟化氢在许多性质上表现出例外。例如: 卤化氢的熔、 沸点按HC-HBr-HI 的顺序增加,HF则具有反常的熔点、沸点。卤化氢热稳定性按HF-HC-HBr-Ⅲ 顺序降低。 3.卤化氢的热稳定性 卤化氢的热稳定性是指其受热是否容易分解为单质: 2HXA→H2+X3 卤化氢的热稳定性依HF-HCHBⅢ顺序急剧下降。碘化氢最易分解,当它 受热到200℃左右就明显地分解,而气态HF在1000℃还能稳定地存在。 4.氢卤酸的酸性 在氢卤酸中,氢氯酸(盐酸)、氢溴酸和氢碘酸都是强酸,并且酸性按 HCl-HBr-HⅢ的顺序增强,只有氢氟酸是弱酸。氢卤酸酸性的变化可通过卤化氢 在水溶液中解离过程各步顺序的焓变和熵变来说明,氢卤酸的酸性强弱主要与下 列三个因素有关:一是负离子的水合热:二是X的电子亲合能:三是K的键 能。虽然下的水合热很大,同时HF的键能又特别大,而氟的电子亲合能却比预 期的小, 致使它与其它氢卤酸不同,酸性显著的弱, 氢氟酸还能与二氧化硅、硅酸盐作用生成气态S正4: SiO2+4HF=S证4↑十2H20 CaSiO3+6HF=SiF4+CaF2+3H2O 上述反应可用来刻蚀玻璃,溶解硅酸盐等。因此氢氟酸不宜贮于玻璃容器中, 应该盛于塑料容器中
第十一章 元素化学 145 2HX=H2+X2 表 11-4 列出卤化氢的一些重要性质。 从表中数据可以看出,卤化氢的性质依 HF-HCl-HBr-HI 顺序有规律的变化, 唯独氟化氢在许多性质上表现出例外。例如:卤化氢的熔、沸点按 HCl-HBr-HI 的顺序增加,HF 则具有反常的熔点、沸点。卤化氢热稳定性按 HF-HCl-HBr-HI 顺序降低. 3.卤化氢的热稳定性 卤化氢的热稳定性是指其受热是否容易分解为单质: 2HX ⎯⎯→ H2+X2 卤化氢的热稳定性依 HF-HCl-HBr-HI 顺序急剧下降。碘化氢最易分解,当它 受热到 200℃左右就明显地分解,而气态 HF 在 1000℃还能稳定地存在。 4.氢卤酸的酸性 在氢卤酸中,氢氯酸(盐酸)、氢溴酸和氢碘酸都是强酸,并且酸性按 HCl-HBr-HI 的顺序增强,只有氢氟酸是弱酸。氢卤酸酸性的变化可通过卤化氢 在水溶液中解离过程各步顺序的焓变和熵变来说明。氢卤酸的酸性强弱主要与下 列三个因素有关:一是负离子的水合热;二是 X 的电子亲合能:三是 HX 的键 能。虽然 F -的水合热很大,同时 HF 的键能又特别大,而氟的电子亲合能却比预 期的小,致使它与其它氢卤酸不同,酸性显著的弱。 氢氟酸还能与二氧化硅、硅酸盐作用生成气态 SiF4: SiO2+4HF=SiF4 十 2 H2O CaSiO3+6HF=SiF4 +CaF2+3H2O 上述反应可用来刻蚀玻璃,溶解硅酸盐等。因此氢氟酸不宜贮于玻璃容器中, 应该盛于塑料容器中

第十一章元素化学 146 5.氢卤酸的还原性 氢卤酸的还原强弱可用o日(X2八)数值来衡量和比较。X还原能力的递变 顺序为>B>C>F,事实上HF不能被一般氧化剂所氧化:与一些强氧化剂入 F2,MnO2,KMnO4,PbO2等反应才显还原性:Br和r的还原性较强,空气中的氧就 可以使他们氧化为单质。溴化氢溶液在日光、空气作用下即可变为棕色:而碘化 氢溶液即使在暗处,也会逐渐变为棕色。 11.1.2卤化物 严格地说,卤素与电负性较小的元素所形成的化合物才称为卤化物,例 如卤素与IA、ⅡA族的绝大多数金属形成的离子型卤化物。这些卤化物具有高的 熔、沸点和低挥发性,熔融时能导电。但广义来说,卤化物也包括卤素与非金属、 氧化值较高的金属所形成的共价型卤化物,如SF6、UF6、SnCL4等。共价型卤化 物固态时为分子晶体, 一般熔、沸点低,熔融时不导电,并且有挥发性,如常温 下呈气态的SFo,呈液态的CCh及固态的HsC(升汞),但是离子型卤化物与共 价型卤化物之间没有严格的界限,如FC是易挥发共价型卤化物,它在熔融态 时能导电。卤化物中我们着重讨论氯化物。 1.卤化物的溶解性 大多数卤化物易溶于水。氯、溴、碘的银盐(AgX)、铅盐(PbX)、亚汞盐 (HgX)、亚铜盐(CuX)是难溶的。氟化物的溶解度表现有些反常,例如CF2难 溶,而其它CaX2易溶:AgF易溶,而其它AgX难溶。这是因为钙的卤化物基本 上是离子型的,氟的离子半径小,CF2的晶格能大,致使其难溶。而在AgX系 列中,虽然Ag的极化力和变形性都大,但F半径小难以被极化,故AgF基本 上是离子型的易溶于水:而从C到F 变形性增 Ag相互极化作用增加 键的共价性随之增加,故它们均难溶,且溶解度越来越小。一般来说,重金属卤 化物的溶解度大小次序为: ME.>MCL>MBE>MI 此外,金属卤化物的溶解度常因生成配合物而加大。如]PbC在冷水中溶解度 较小,在HC1溶液中因与C离子形成配离子而增大了溶解度。 PbCl2+Cl=PbCl3 2.卤化物的水解 大多数不太活泼金属(如镁、锌等)的卤化物会不同程度地与水发生反应, 尽管反应常常是分级进行和可逆的,却总会引起溶液酸性的增强。它们与水反应 的产物一般为碱式盐与盐酸,例如: MgCl2+H2O=Mg(OH)CI+HCI 在焊接金属时常用氯化锌浓溶液以清除钢铁表面的氧化物,主要是利用 ZnCh与水反应产生的酸性。而SnC2、SbCs和BiCls水解后分别以碱式氯化亚 锡S(OH)Cl,氯氧化锑SbOCI和氯氧化铋BiOCI的沉淀形式析出。 SnCh十HO=Sn(OH)CI↓+十HCI SbCl3+H2O=SbOCI+2HCI BiCl3十HO=BiOCl↓十2HCI
第十一章 元素化学 146 5.氢卤酸的还原性 氢卤酸的还原强弱可用 (X2/X-)数值来衡量和比较。X-还原能力的递变 顺序为 I ->Br->Cl->F- ,事实上 HF 不能被一般氧化剂所氧化;与一些强氧化剂入 F2,MnO2,KMnO4,PbO2 等反应才显还原性;Br- 和 I -的还原性较强,空气中的氧就 可以使他们氧化为单质。溴化氢溶液在日光、空气作用下即可变为棕色;而碘化 氢溶液即使在暗处,也会逐渐变为棕色。 11.1.2 卤化物 严格地说,卤素与电负性较小的元素所形成的化合物才称为卤化物,例 如卤素与 IA、IIA 族的绝大多数金属形成的离子型卤化物。这些卤化物具有高的 熔、沸点和低挥发性,熔融时能导电。但广义来说,卤化物也包括卤素与非金属、 氧化值较高的金属所形成的共价型卤化物,如 SF6、UF6、SnCl4 等。共价型卤化 物固态时为分子晶体,一般熔、沸点低,熔融时不导电,并且有挥发性,如常温 下呈气态的 SF6,呈液态的 CCl4 及固态的 HgCl2(升汞)。但是离子型卤化物与共 价型卤化物之间没有严格的界限,如 FeCl3 是易挥发共价型卤化物,它在熔融态 时能导电。卤化物中我们着重讨论氯化物。 1.卤化物的溶解性 大多数卤化物易溶于水。氯、溴、碘的银盐(AgX)、铅盐(PbX2)、亚汞盐 (HgX2)、亚铜盐(CuX)是难溶的。氟化物的溶解度表现有些反常,例如 CaF2 难 溶,而其它 CaX2 易溶;AgF 易溶,而其它 AgX 难溶。这是因为钙的卤化物基本 上是离子型的,氟的离子半径小,CaF2 的晶格能大,致使其难溶。而在 AgX 系 列中,虽然 Ag+的极化力和变形性都大,但 F -半径小难以被极化,故 AgF 基本 上是离子型的易溶于水;而从 Cl-到 I -,变形性增大,与 Ag+相互极化作用增加, 键的共价性随之增加,故它们均难溶,且溶解度越来越小。一般来说,重金属卤 化物的溶解度大小次序为: MFn MCln>MBrn>MIn 此外,金属卤化物的溶解度常因生成配合物而加大。如]PbCl2 在冷水中溶解度 较小,在 HCl 溶液中因与 Cl-离子形成配离子而增大了溶解度。 PbCl2+ Cl-= PbCl3 - 2.卤化物的水解 大多数不太活泼金属(如镁、锌等)的卤化物会不同程度地与水发生反应, 尽管反应常常是分级进行和可逆的,却总会引起溶液酸性的增强。它们与水反应 的产物一般为碱式盐与盐酸,例如: MgCl2 十 H2O=Mg(OH)Cl+HCl 在焊接金属时常用氯化锌浓溶液以清除钢铁表面的氧化物,主要是利用 ZnCl2 与水反应产生的酸性。而 SnCl2、SbCl3 和 BiCl3 水解后分别以碱式氯化亚 锡 Sn(OH)Cl,氯氧化锑 SbOCl 和氯氧化铋 BiOCl 的沉淀形式析出。 SnCl2 十 H2O=Sn(OH)Cl +十 HCl SbCl3+H2O= SbOCl +2HCI BiCl3 十 H2O =BiOCl 十 2 HCI

第十一章元素化学 14 所以在配制这些盐溶液时,为了防止沉淀产生,应将盐类先溶于浓盐酸, 然后再加水稀释 较高价态金属的卤化物(如FeC、A1C、CrCb)片水反应的过程比较复 杂,不要求掌握。 11.1.3卤离子X)的性质 1还原性 卤素获得电子成为氧化值为1的X离子的标准电极电势如下: 电对 F/F Cl/CI Br/Br I2/I- 08/V2.871361.090.536 可知卤素单质的氧化性F2>C12>Br2>2,卤素离子的还原性>B>C>F,因 此每种卤素 可以把电负性比它小的卤素从后者的卤化物中置换出来。 例如氟可 以从固态氯化物、溴化物、碘化物中分别置换氯、溴、碘:氯可以从溴化物、碘 化物的溶液中置换出溴、碘;而溴只能从碘化物的溶液中置换出碘。 具有较强的还原性,遇氧化剂F3+等)可发生如下反应: 2Fe3+十2r)2Fe2+l2 而在水溶液中,Cu2+的氧化性不算强,由下列电对的o8值来看,似乎Cu2*难 把氧化。 Cu2+十e=Cutp8-0.153V 2十2e-2r00-0.536V 但实际上却能发生下列反应: 2Cu2+4=2Cul↓+I2 这是由于Cu与r反应生成了难溶于水的Cul,使溶液中Cu的浓度变得很小, 使中p8(Cu2+/Cu变大,相对来说Cu2*的氧化性增强了。CuX是难溶盐,但在 过量的浓X溶液中,易形成稳定的CXz而溶解。 2.配位性 卤素离子能与金属和非金属离子形成名种配合物.如H下可通村雄与活泼 金属的氟化物形成各种“酸式盐”,如KHF:(KF-HF)、NaHF:(NaF-.HF)等:还可 与四氟化硅直接生成比HSO,酸性还强的氟硅酸 SiF4+2HF=2H*十SiF62- 例如CdS、SbS等不溶于水和弱酸,但能溶于浓HCI也是因为生成了CdCl42: 和SbCl63-配离子的缘故。 Hg2在过量离子存在下由于形成曲Hgl4P离子而溶解。 Hgl2+2I=[Hgl4P 碘难溶于水,但易溶于碘化物(如碘化钾)中,主要是由于形成1的缘故。 I2+2I=I3° 【g可以离解生成2,故多碘化物溶液的性质实际上和碘溶液相同,实验室常用
第十一章 元素化学 147 所以在配制这些盐溶液时,为了防止沉淀产生,应将盐类先溶于浓盐酸, 然后再加水稀释。 较高价态金属的卤化物(如 FeCl3、AlCl3、CrCl3)与水反应的过程比较复 杂,不要求掌握。 11.1.3 卤离子(X- )的性质 1.还原性 卤素获得电子成为氧化值为-1 的 X-离子的标准电极电势如下: 电对 F/F - Cl2/ Cl- Br/Br- I2/I- /V 2.87 l.36 1.09 0.536 可知卤素单质的氧化性 F2>C12>Br2> I2,卤素离子的还原性 I ->Br->Cl->F-,因 此每种卤素都可以把电负性比它小的卤素从后者的卤化物中置换出来。例如氟可 以从固态氯化物、溴化物、碘化物中分别置换氯、溴、碘;氯可以从溴化物、碘 化物的溶液中置换出溴、碘;而溴只能从碘化物的溶液中置换出碘。 I -具有较强的还原性,遇氧化剂(Fe3+等)可发生如下反应: 2 Fe3+十 2 I-→ 2Fe2++I2 而在水溶液中,Cu2+的氧化性不算强,由下列电对的 值来看,似乎 Cu2+难 把 I -氧化。 Cu2+十 e -=Cu+ =0.153V I2 十 2e-=2 I- =0.536V 但实际上却能发生下列反应: 2Cu2++4 I-=2CuI + I2 这是由于 Cu+与 r 反应生成了难溶于水的 CuI,使溶液中 Cu+的浓度变得很小, 使中 (Cu2+/Cu+ )变大,相对来说 Cu2+的氧化性增强了。CuX 是难溶盐,但在 过量的浓 X-溶液中,易形成稳定的 CuX2 -而溶解。 2.配位性 卤素离子能与金属和非金属离子形成多种配合物,如 HF 可通过氢键与活泼 金属的氟化物形成各种“酸式盐”,如 KHF2(KF-HF)、NaHF2(NaF-HF)等:还可 与四氟化硅直接生成比 H2SO4 酸性还强的氟硅酸。 SiF4+2HF=2H+十 SiF6 2- 例如 CdS、Sb2S3 等不溶于水和弱酸,但能溶于浓 HCl 也是因为生成了 CdCl4 2- 和 SbCl6 3-配离子的缘故。 HgI2 在过量 I -离子存在下由于形成曲[HgI4] 2-离子而溶解。 HgI2+2 I -=[HgI4] 2- 碘难溶于水,但易溶于碘化物(如碘化钾)中,主要是由于形成 I3 -的缘故。 I2+2I -= I3 - I3 -可以离解生成 I2,故多碘化物溶液的性质实际上和碘溶液相同,实验室常用

第十一章元素化学 148 此反应获得较大浓度的碘水溶液。 从铜的电势图: Cu2+015Cut0.52L 可看出,因此在水流中发生发反限大即在衡时溶 中绝大部分Cu转变为Cu2+和Cu。例如Cu0溶于稀CSO4中,得到的不是 Cu2SO4而是CuSO4和Cu: CIo++HSO=Cu+CusotHO 只有当Cu形成沉淀或配合物时,C浓度被大大减小,该歧化反应才能向反方向 进行 例如铜与氯化铜在热浓盐酸中形成+1价铜的化合物: Cu+CuCl2=2CuCI↓ 由于生设代液中游商的C如浓度非常小,反应可续向右进行直 到完全 将制得的CuC溶液倒入大量水中稀释,会有白色氯化亚铜CuCI沉淀析出: [CuCb时CuC1↓+Cr 与铜的电势图不同,在酸性溶液中汞的电势图如下: Hg2+0.920 Hg22+0797 Hg 可以看出o日右<o8左,因此在水溶液中Hg2+不会发生歧化反应,相反Hg2*却 可以将Hg氧化Hg22+: Hg2+Hg→Hg22+K8=[Hg22*]MHg2*]=166(25℃) 这说明在平衡状态了 绝大多数Hg2*可转变Hg2 以上反应的K日值还不是很大,采取适当措施也可以使平衡向歧化反应方向 移动,如加入一种试剂和Hg2+形成沉淀(如OH、NH、S2、CO2)或形成配合物 (如,CN-等),大大降低溶液中的Hg+浓度,就会促使Hg*歧化反应的进行。 例如,加入一种试剂如,能与Hg+形成稳定的配离子HgP大大降低了 Hg+的浓度,就会促使上面反应向左进行,使Hg2*的歧化反应得以进行 Hg22++4I=[Hgl4]2-+Hg 顺便指出,加入的试剂与Hg+形成的沉淀有许多是不稳定的,也会发生歧化反 应。例如: Hg22+H2S=HgS↓+Hg↓+2H Hg22+20H=Hg0↓+Hg↓+H0 白色难溶的Hg2C12中加入氨水时也会发生以下歧化反应: Hg2C12+2NH=HgNH2Cl4(伯+Hg(黑)+HNH4CI1 此反应常用来检验Hg22+
第十一章 元素化学 148 此反应获得较大浓度的碘水溶液。 从铜的电势图: Cu2+ 0.153 Cu+ 0.521 Cu 可看出,因此在水溶液中 Cu+易发生歧化反应,且 K 值很大,即在平衡时溶液 中绝大部分 Cu+转变为 Cu2+和 Cu。例如 Cu2O 溶于稀 Cu2SO4 中,得到的不是 Cu2SO4 而是 CuSO4和 Cu: Cu2O 十 H2SO4=Cu+CuSO4+H2O 只有当 Cu+形成沉淀或配合物时, Cu+浓度被大大减小,该歧化反应才能向反方向 进行, 例如铜与氯化铜在热浓盐酸中形成+1 价铜的化合物: Cu+CuCl2=2CuCl CuCl+HCl=HCuCl2 由于生成配离子[CuCl2] -溶液中游离的 Cu+浓度非常小,反应可继续向右进行直 到完全。 将制得的[CuCl2] -溶液倒入大量水中稀释,会有白色氯化亚铜 CuCl 沉淀析出: [CuCl2] - ⎯稀释⎯→ CuCl +CI- 与铜的电势图不同,在酸性溶液中汞的电势图如下: Hg2+ 0.920 Hg2 2+ 0.797 Hg 可以看出 右< 左,因此在水溶液中 Hg2 2+不会发生歧化反应,相反 Hg2+却 可以将 Hg 氧化 Hg2 2+: Hg2+十 Hg → Hg2 2+ K =[ Hg2 2+]/[ Hg2+] =166(25℃) 这说明在平衡状态下,绝大多数 Hg2+可转变 Hg2 2+。 以上反应的 K 值还不是很大,采取适当措施也可以使平衡向歧化反应方向 移动,如加入一种试剂和 Hg2+形成沉淀(如 OH-、NH3、S 2-、CO3 2- )或形成配合物 (如 I -,CN-等),大大降低溶液中的 Hg2+浓度,就会促使 Hg2 2+歧化反应的进行。 例如,加入一种试剂如 I -,能与 Hg2+形成稳定的配离子[HgI4] 2-大大降低了 Hg2+的浓度,就会促使上面反应向左进行,使 Hg2 2+的歧化反应得以进行: Hg2 2++ 4I-=[HgI4] 2-+Hg 顺便指出,加入的试剂与 Hg2 2+形成的沉淀有许多是不稳定的,也会发生歧化反 应。例如: Hg2 2++H2S=HgS +Hg +2H+ Hg2 2++2 OH-=HgO +Hg +H2O 白色难溶的 Hg2C12 中加入氨水时也会发生以下歧化反应: Hg2C12+2NH3=HgNH2Cl (白)+ Hg (黑)+lNH4Cl 此反应常用来检验 Hg2 2+

第十一章元素化学 149 §11-2氧及氧化物 11.2.1臭氧 1.臭氧 氧单质有两种同素异形体,即O2,和O3(臭氧)。氧在O2中,两个氧原子通 过一个σ键和两个三电子π键结合,由于02分子中有两个单电子,使02表现出 顺磁性。 ①臭氧的形成和臭氧成的作用。臭氧存在于大气的最上层,由太阳对大气中 氧气的强辐射作用而形成。臭氧能吸收太阳光的紫外辐射,从而提供了一个保护 地面上一切生物免受太阳过强辐射的防御屏障一臭氧保护层。近年来发现大气上 空臭氧锐减,甚至于在南极和北极上空己形成了臭氧空洞。造成臭氧减少的元凶 是作为制冷剂和工业清洗剂而 一泛应用的化学物质 氯氟烃。臭氧层的变化还 会损害人的免疫系统,破坏整个地球的生态环境。由此可见,在世界范围内限制 氯氟烃的生产,开发研究氯氟烃的代用品势在必行。 ②臭氧的结构。O3的结构比较特殊,组成臭氧分子的三个氧原子构呈V型 排列(图11-2)。中心氧原子采取s即2杂化,形成三个sp杂化轨道(共有四个电子), 它用两个杂化轨道与两端两个氧原子键合 另一个杂化轨道被孤对电子占据,键角117P。·除此以外,中国12分于 心原子还有一个没有参加杂化的p轨道(被2个电子占据) 两端的两个氧原子也各有一个p轨道(各被1个电子占据), 这三个p轨道相互平行,形成了垂直于分子平面的三中心四 0分子的结构 电子的大π键,以Π表示。这种大π键是不定域(或离 域)π健,即成键电子不固定在两个原子之间。而0分子中的三电子π键,是 两个原子之间的π键,是定域键,也称为小π键,以区别于两个以上原子间所存 在的不定域大π键。臭氧分子中无单电子,故为反磁性物质。 ③臭氧的性质。臭氧是浅蓝色,有鱼腥臭味的气体。臭氧比氧气易溶于水。 臭氧是非常不稳定的,在常温下缓慢分解为氧,当温度高于200℃时则迅速分解。 O的氧化性仅次于】 比氧强得多,是最强的氧化剂之 臭氧作为氧化剂时 个氧原子的氧化值还原为一2,同时产生一个普通氧分子,它在酸性和碱性溶 液中的标准电极电势为: 03+2H++2e"02+IH0, 08a=2.08V 03+H20+2e→02+20H, o8b=1.24V O3能氧化许多不活泼的单质如Hg、Ag、S等,还可从碘化钾溶液中使碘析 出,此反应常作为O3的鉴定反应。 03+2+2H*→+02↑+H20
第十一章 元素化学 149 §11-2 氧及氧化物 11.2.1 臭氧 1.臭氧 氧单质有两种同素异形体,即 O2,和 O3(臭氧)。氧在 O2 中,两个氧原子通 过一个 键和两个三电子 键结合,由于 O2 分子中有两个单电子,使 O2 表现出 顺磁性。 ①臭氧的形成和臭氧成的作用。臭氧存在于大气的最上层,由太阳对大气中 氧气的强辐射作用而形成。臭氧能吸收太阳光的紫外辐射,从而提供了一个保护 地面上一切生物免受太阳过强辐射的防御屏障—臭氧保护层。近年来发现大气上 空臭氧锐减,甚至于在南极和北极上空已形成了臭氧空洞。造成臭氧减少的元凶 是作为制冷剂和工业清洗剂而广泛应用的化学物质——氯氟烃。臭氧层的变化还 会损害人的免疫系统,破坏整个地球的生态环境。由此可见,在世界范围内限制 氯氟烃的生产,开发研究氯氟烃的代用品势在必行。 ②臭氧的结构。O3 的结构比较特殊,组成臭氧分子的三个氧原子构呈 V 型 排列(图 11-2)。中心氧原子采取 sp2 杂化,形成三个 sp2 杂化轨道(共有四个电子), 它用两个杂化轨道与两端两个氧原子键合, 另一个杂化轨道被孤对电子占据,键角 117○。`除此以外,中 心原子还有一个没有参加杂化的 p 轨道(被 2 个电子占据), 两端的两个氧原子也各有一个 p 轨道(各被 1 个电子占据), 这三个 p 轨道相互平行,形成了垂直于分子平面的三中心四 O3 分子的结构 电子的大 键,以 4 3 表示。这种大 键是不定域(或离 域) 键,即成键电子不固定在两个原子之间。而 O2 分子中的三电子 键,是 两个原子之间的 键,是定域键,也称为小 键,以区别于两个以上原子间所存 在的不定域大 键。臭氧分子中无单电子,故为反磁性物质。 ③臭氧的性质。臭氧是浅蓝色,有鱼腥臭味的气体。臭氧比氧气易溶于水。 臭氧是非常不稳定的,在常温下缓慢分解为氧,当温度高于 200℃时则迅速分解。 O3 的氧化性仅次于 F2,比氧强得多,是最强的氧化剂之一。臭氧作为氧化剂时, 一个氧原子的氧化值还原为—2,同时产生一个普通氧分子,它在酸性和碱性溶 液中的标准电极电势为: O3+2H++2e-→ O2+H2O, a=2.08V O3+ H2O +2e-→ O2+2OH-, b=1.24V O3 能氧化许多不活泼的单质如 Hg、Ag、S 等,还可从碘化钾溶液中使碘析 出,此反应常作为 O3 的鉴定反应。 O3+2I-+2H+→ I2+ O2 +H2O

第十一章元素化学 150 利用臭氧的强氧化性和它不容易导致二次污染这个优点,臭氧能把酚、苯、 醇等氧化成无害物质,因而可用千工业废水的处理,臭氧可使许多垫料被氧化而 褪色,可用来做棉、麻、纸张等的漂白剂和皮毛的脱臭剂: 臭氧有很强的氧化力 能杀死多种病菌,可用来消毒水和净化空气。但是,如果空气中臭氧的含量超过 14gg则对人体健康产生有害影响。 11.2.2过氧化氢的结构与性质 过氧化氢的分子式为HO2。过氧化氢为极性分子,其成键作用和水分子 样,氧原子也是采取不等性的sp3杂化,两个sp杂化轨道中各有两个成单电子 其中一个和氢原子的1s轨道重叠形成H一Oσ键,另一个则和第二个氧原子的 sp杂化轨道重叠形成00。键。H202分子不是呈H0-0-H的直线型结构, 两个氢原子像在半展开书本的两页纸上,两页纸的夹角9351,两个氧原子在书 的夹缝上,0-H键和0-0键之间的夹角为96.52/(见图11,3): 纯的过氧化氢是近乎无色的粘稠状液体,分子见有氢键,由于极性比水强 在固态和液态时分子缔合程度比水大,所以它的沸点(150℃)远比水高。过氧 化氢能以任何比例与水互溶。过氧化氢的水溶液叫做双氧水,常用的双氧水H2O2 中的质量分数为3%或30%。 图11-3H,0的分子结构 过氧化氢分子中存在过氧键一0一0一,使H02的性质和H20有很大的差 别。它的主要化学性质如下 ①弱酸性过氧化氢具有很弱的酸性,是二元酸,在水溶液中解离如下: H2O2台H+HO2 K81=1.5×1012 HO2台H+022 K82=1.0X1023 过氧化氢能与碱作用生成盐,所生成的盐称为过氧化物 H2O2+Ba(OH)2BaO2+2H2O ②不稳定性由于过氧基一0一0一内过氧键的键能较小,过氧化氢分子不 稳定,易分解。 2H202一02↑+2H20 △H6m=-196.21 Kj.mol-: 相对而言,纯的过氧化氢液体稳定些,在常温下基本不分解,光照、加热和 增大溶液的碱度都能促使其分解。溶液中微量杂质、M血O或重金属离子(如F© Mn2+、Cu2+、Cr3+等)对O2的分解有催化作用。常将过氧化氢溶液装在棕色瓶 中,并避光放于阴凉处。在放入一些稳定剂,如微量的锡酸钠、焦磷酸钠等,效
第十一章 元素化学 150 利用臭氧的强氧化性和它不容易导致二次污染这个优点,臭氧能把酚、苯、 醇等氧化成无害物质,因而可用于工业废水的处理;臭氧可使许多染料被氧化而 褪色,可用来做棉、麻、纸张等的漂白剂和皮毛的脱臭剂;臭氧有很强的氧化力, 能杀死多种病菌,可用来消毒水和净化空气。但是,如果空气中臭氧的含量超过 1 g/g 则对人体健康产生有害影响。 11.2.2 过氧化氢的结构与性质 过氧化氢的分子式为 H2O2。过氧化氢为极性分子,其成键作用和水分子一 样,氧原子也是采取不等性的 sp3 杂化,两个 sp3 杂化轨道中各有两个成单电子, 其中一个和氢原子的 1s 轨道重叠形成 H—O 键,另一个则和第二个氧原子的 sp3 杂化轨道重叠形成 O—O 键。H2O2 分子不是呈 H-O-O-H 的直线型结构, 两个氢原子像在半展开书本的两页纸上,两页纸的夹角 93。 51,两个氧原子在书 的夹缝上,O-H 键和 O-O 键之间的夹角为 96。52/(见图 11,3)。 纯的过氧化氢是近乎无色的粘稠状液体,分子见有氢键,由于极性比水强, 在固态和液态时分子缔合程度比水大,所以它的沸点(150℃)远比水高。过氧 化氢能以任何比例与水互溶。过氧化氢的水溶液叫做双氧水,常用的双氧水 H2O2 中的质量分数为 3%或 30%。 过氧化氢分子中存在过氧键—O—O—,使 H2O2 的性质和 H2O 有很大的差 别。它的主要化学性质如下: ①弱酸性 过氧化氢具有很弱的酸性,是二元酸,在水溶液中解离如下: H2O2 H++ HO2 - K 1= 1.5×10-12 , HO2 - H++ O2 2- K 2= 1.0×10-23 过氧化氢能与碱作用生成盐,所生成的盐称为过氧化物。 H2O2+Ba(OH)2 BaO2+2H2O ②不稳定性 由于过氧基—O—O—内过氧键的键能较小,过氧化氢分子不 稳定,易分解。 2H2O2 O2 + 2H2O rH m =-196.21Kj.mol-1: 相对而言,纯的过氧化氢液体稳定些,在常温下基本不分解,光照、加热和 增大溶液的碱度都能促使其分解。溶液中微量杂质、MnO2 或重金属离子(如 Fe3+、 Mn2+、Cu2+、Cr3+等)对 H2O2 的分解有催化作用。常将过氧化氢溶液装在棕色瓶 中,并避光放于阴凉处。在放入一些稳定剂,如微量的锡酸钠、焦磷酸钠等,效

第十一章元素化学 果则更好 ③氧化还原性过氧化氢中氧的氧化数是一1,处于中间氧化态,它既可以 被氧化,也可以被还原,其标准电极电势如下: 酸性溶液:,H202+2H+2e-一2H2000a=+1.776V 02+2H*+2e=H20, p8a=+0.695V 碱性溶液: H202+2HOz+2e30H o0b=+0.878V 02+H20+2e-台H0240H p8b=-0.076V 由上述电极电势值可见,H2O2无论在酸性或碱性介质中均有氧化性,尤其 在酸性溶液中是个强氧化剂,可氧化I和Fe2 H202+2H*+22H20+I2 H2O2+2H+2Fc2+-2H2O+2Fe3 还可使黑色的PbS氧化成白色的PbSO4,这一反应用于油画的漂白。 PbS+4H2O2→PbS04↓+4H0 在强碱性介质中HO2能氧化CrOr(即[CrOH)4)。 Cr02+3H02+20H→2Cr042+4H0 基于HO2的氧化性,常把它用作漂白剂、氧化剂和消毒剂。高浓度的HO2 是火箭燃料的氧化剂。由于H02中O处于中间氧化态,当它遇到比自己更强的 氧化剂时,就表现出还原剂的性质。例如: Mn04+5H02+6H→2M2+502+8H0 2Mn04+3H202→2Mn02↓+302↑+20H+2H20 Ch+HO22HCHO 在工业上常利用HO和Cb的反应,除去漂白过的物件上残余的C2。在定 量分析中,常利用H,O,与KMO:的反应(在酸性介质中)测定H,O2的含量。 ④配位性在工IV)盐的酸性溶液中加入H2O2,则生成较稳定的橙色配合 物TH202)P*,可利用此反应测定钛。 T022+H202TiH202)P+ 在铬酸盐的酸性溶液中加入H0 ,生成深蓝色的过氧化铬CO(O22 Hcr0:+2H0:+r→Cr0O2h(蓝)+3H,0 相当于CO3中两个氧被两个过氧基取代。CO(O22不稳定,极易分解放出氧: 4Cr0(O2)2+12H+→4Cr3+702个+6H0 为了提高CO(O2上的稳定性,其生成反应必须在冷溶液中进行,同时用乙醚或 其它有机溶剂如戊醇 取 之。由于CO(O22在乙醚中能形成较稳定的深蓝色的 CrO(O2h.(C2HshO,常利用此反应鉴定Cr(VI)或HzO2
第十一章 元素化学 151 果则更好。 ③氧化还原性 过氧化氢中氧的氧化数是—1,处于中间氧化态,它既可以 被氧化,也可以被还原,其标准电极电势如下: 酸性溶液:, H2O2+2H++2e- 2H2O a=+1.776V O2+2H++2e- H2O2 a=+0.695V 碱性溶液: H2O2+2HO2 -+2e- 3OH- b=+0.878V O2+H2O+2e- HO2 -+OH- b=-0.076V 由上述电极电势值可见,H2O2 无论在酸性或碱性介质中均有氧化性,尤其 在酸性溶液中是个强氧化剂,可氧化 I -和 Fe2+。 H2O2+2H++2 I- 2H2O+ I2 H2O2+2H++2 Fe2+ 2H2O+2 Fe3+ 还可使黑色的 PbS 氧化成白色的 PbSO4,这一反应用于油画的漂白。 PbS +4H2O2 → PbSO4 +4H2O 在强碱性介质中 H2O2 能氧化 CrO2 - (即[Cr(OH)4] - )。 CrO2 -+3 H2O2+2 OH-→ 2 CrO4 2-+4 H2O 基于 H2O2 的氧化性,常把它用作漂白剂、氧化剂和消毒剂。高浓度的 H2O2 是火箭燃料的氧化剂。由于 H2O2 中 O 处于中间氧化态,当它遇到比自己更强的 氧化剂时,就表现出还原剂的性质。例如: MnO4 -+5H2O2+6 H+→ 2Mn 2++5O2+8H2O 2 MnO4 - +3 H2O2 → 2Mn O2 +3 O2 +2 OH-+2 H2O Cl2+ H2O2 → 2HCl+ O2 在工业上常利用 H2O2 和 Cl2 的反应,除去漂白过的物件上残余的 Cl2。在定 量分析中,常利用 H2O2 与 KMnO4的反应(在酸性介质中)测定 H2O2的含量。 ④配位性 在 Ti(IV)盐的酸性溶液中加入 H2O2,则生成较稳定的橙色配合 物[Ti(H2O2)]2+,可利用此反应测定钛。 TiO2 2++ H2O2 → [Ti(H2O2)]2+ 在铬酸盐的酸性溶液中加入 H2O2,生成深蓝色的过氧化铬 CrO(O2)2: HcrO4 -+2 H2O2+H+→ CrO(O2)2(蓝)+3 H2O 相当于 CrO3 中两个氧被两个过氧基取代。CrO(O2)2 不稳定,极易分解放出氧: 4 CrO(O2)2+12H+→ 4Cr3++7 O2 +6H2O 为了提高 CrO(O2)2 的稳定性,其生成反应必须在冷溶液中进行,同时用乙醚或 其它有机溶剂如戊醇萃取之。由于 CrO(O2)2 在乙醚中能形成较稳定的深蓝色的 CrO(O2)2.( C2H5)2O,常利用此反应鉴定 Cr(VI)或 H2O2

第十一章元素化学 11.2.3氧化物 1.氧化物的晶体结构与物理性质 氧化物按其组成可分为金属氧化物和非金属氧化物,通式为RxOy久,按照 氧化物的键型,可分为离子型氧化物和共价型氧化物,见表11一7。 表11-7额化物的耀型和晶体类型 键型品体类型 实+O例 离子键离子品体Na,0K0Mg0CaOA1,O1+ 共价分子品体 NO CHO NO CO NO P.OGAsO NO2N.O. SO CIO:N.O PO SOj(SO)Cl.O, 原子品体SiO2B2030 OH中 链状晶体S0Sb,0 层状品体As0、 绝大部分金属氧化物为离子键,固态是离子晶体。非金属氧化物为共价键, 固态时为分子晶体或原子晶体。离子晶体和原于晶体氧化物的熔点和沸点一般都 很高,如MgO和aAO(俗称刚玉)具有高熔点,可做耐火材料 Cr2O3,和SiO2 具有很高的硬度,可用作磨料和填充料。而分子品体氧化物的熔点和沸点都很低, 不少这类化合物在室温时己呈气态,如CO2、SO3、P4O6和P4O0等。 2.氧化物的酸越件 某些稀有气体之外,几乎所有元素都能生成氧化物。根据氧化物对酸、碱 反应的不同,可将其分为酸性、碱性、两性和中性氧化物(也称不成盐氧化物, 如CO、NO等)四类。 3.氧化物的氧化还原性 ①二氧化铅PbO2呈褐色,是一种强氧化剂,在硝酸介质中能使二价锰离子 Mn2+氧化为紫红色的高锰酸根MnO4,这个反应可用宋鉴定Mn2+。 2Mn2+5Pb02+4H+A→2Mn04+5Pb2+2H,0 酸性介质中它还可将C1氧化为单质氯。 PbO2+4HCI(浓)→PbC2+C12个+2H20 在工业上PbO2主要用于制造铅蓄电池,铅蓄电池的正极材料是PbO2,电极反应 如下: PbS04+2e台Pbt+S042: p8=0.351V Pb02+S042+4Ht+2e-PbS04+2H20,08=1.691V
第十一章 元素化学 152 11.2.3 氧化物 1.氧化物的晶体结构与物理性质 氧化物按其组成可分为金属氧化物和非金属氧化物,通式为 RxOy 久,按照 氧化物的键型,可分为离子型氧化物和共价型氧化物,见表 11—7。 绝大部分金属氧化物为离子键,固态是离子晶体。非金属氧化物为共价键, 固态时为分子晶体或原子晶体。离子晶体和原于晶体氧化物的熔点和沸点一般都 很高,如 MgO 和 -Al2O3(俗称刚玉)具有高熔点,可做耐火材料。Cr2O3,和 SiO2 具有很高的硬度,可用作磨料和填充料。而分子晶体氧化物的熔点和沸点都很低, 不少这类化合物在室温时已呈气态,如 CO2、SO3、P4O6和 P4O10等。 2.氧化物的酸碱性 除了某些稀有气体之外,几乎所有元素都能生成氧化物。根据氧化物对酸、碱 反应的不同,可将其分为酸性、碱性、两性和中性氧化物(也称不成盐氧化物, 如 CO、NO 等)四类。 3.氧化物的氧化还原性 ①二氧化铅 PbO2 呈褐色,是一种强氧化剂,在硝酸介质中能使二价锰离子 Mn2+氧化为紫红色的高锰酸根 MnO4 -,这个反应可用宋鉴定 Mn2+。 2 Mn2++5PbO2+4H+ ⎯⎯→ 2MnO4 -+5Pb2++2H2O 酸性介质中它还可将 C1-氧化为单质氯。 PbO2+4HCl(浓) → PbCl2+C12 +2H2O 在工业上 PbO2 主要用于制造铅蓄电池,铅蓄电池的正极材料是 PbO2,电极反应 如下: PbSO4+2e- Pb+SO4 2- ==-0.351V PbO2+ SO4 2-+4H++2e- PbSO4+2H2O, =1.691V

第十一章元素化学 总反应 Pb02+2H2S04+Pb=2PbS04+2H20,p8=2.042V ②二氧化锰MO2是灰黑色固体,是锰的最稳定的氧化物,也是自然界中 软锰矿的主要成分。MnO2不溶于水,显两性,与它相应的水合物Mn(OH)4或 。是平性溶液中是稳定的,在酸性溶液中是较强的氧化剂,本身被还原 为Mn2+。例如MnO2与浓HCI共热可制备C12气,与浓SO4共热能放出氧气。 MnO2+4HCI→MnCl2+2H2O+Ch↑ 2MnO2+2H2S04-→2MnS04+2H0+O2↑ 二氧化锰在碱性介质中可被一些较强氧化剂(如KC1O,O2等)氧化为+6价 的锰。例如将MO2和O2或固体的KCIO3一起共熔,可得到绿色的锰酸钾 K2Mn04. 2Mn02+4KOH+O2→2K2MnO4+2H0 3MnO2+6KOH+KClO3->3K2MnO4+KCH+3H2O 二氧化锰常用作氧化剂(如大量用于干电池的制造)和催化剂,还常用于制造火 柴、玻璃和其它锰的化合物。 §11-3氢氧化物、含氧酸及其盐 11.3.1氢氧化物、含氧酸酸性的相对强弱 1.R一O一H规则 氧化物的水合物形成酸成减,其组成均可可用R一O一H诵式表示。R称为中 心离子或原子, 如果解离时在R 一0键处断裂,即按碱式解离,则呈碱性:如果 在O一H健处断裂,即按酸式解离,则呈酸性: R十O-H R-O十H 碱式解离 酸式解离 R一O一H究竞进行酸式解离还是碱式解离,以及解离的程度如何,其影响 因素比较复杂。 一般由R 无素的电荷多少以及半径大小等因素来决定,可由“离 子势”来衡量阳离子极化作用的强弱: 离子势()-阳离子电荷(2) 阳离子半径(r) 在R一O一H中,若R的中值大,则R极化作用强,氧原子的电子云将偏向 R,使O一H键的极性增强,则R一O一H以酸式电离为主:若R的值小,则 R一O一H倾向于进行碱式解离。据此,有人提出用以下√中值r以nm为单
第十一章 元素化学 153 总反应 PbO2+2 H2SO4+Pb 2PbSO4+2H2O , =2.042V ②二氧化锰 MnO2 是灰黑色固体,是锰的最稳定的氧化物,也是自然界中 软锰矿的主要成分。MnO2 不溶于水,显两性,与它相应的水合物 Mn(OH)4 或 MnO(OH)2 也显两性。 MnO2 在中性溶液中是稳定的,在酸性溶液中是较强的氧化剂,本身被还原 为 Mn2+。例如 MnO2 与浓 HCl 共热可制备 C12 气,与浓 H2SO4 共热能放出氧气。 MnO2+4HCl → MnCl2+2H2O+ Cl2 2MnO2+2H2SO4 → 2MnSO4+2H2O+ O2 二氧化锰在碱性介质中可被一些较强氧化剂(如 KClO3,O2 等)氧化为+6 价 的锰。例如将 MnO2 和 O2 或固体的 KClO3 一起共熔,可得到绿色的锰酸钾 K2MnO4。 2MnO2+4KOH+O2 ⎯熔融⎯→ 2K2MnO4+2H2O 3MnO2+6KOH+KClO3 ⎯熔融⎯→ 3K2MnO4+KCl+3H2O 二氧化锰常用作氧化剂(如大量用于干电池的制造)和催化剂,还常用于制造火 柴、玻璃和其它锰的化合物。 §11-3 氢氧化物、含氧酸及其盐 11. 3.1 氢氧化物、含氧酸酸性的相对强弱 1.R—O—H 规则 氧化物的水合物形成酸或碱,其组成均可用 R—O—H 通式表示。R 称为中 心离子或原子,如果解离时在 R—O 键处断裂,即按碱式解离,则呈碱性;如果 在 O—H 键处断裂,即按酸式解离,则呈酸性: R 十 O—H R—O 十 H 碱式解离 酸式解离 R—O—H 究竟进行酸式解离还是碱式解离,以及解离的程度如何,其影响 因素比较复杂。一般由 R 元素的电荷多少以及半径大小等因素来决定,可由“离 子势”来衡量阳离子极化作用的强弱: 离子势( )= 阳离子半径(r) 阳离子电荷() 在 R—O—H 中,若 R 的 值大,则 R 极化作用强,氧原子的电子云将偏向 R,使 O—H 键的极性增强,则 R—O—H 以酸式电离为主;若 R 的 值小,则 R—O—H 倾向于进行碱式解离。据此,有人提出用以下 值(r 以 nm 为单