
第八章 配位平衡与配位滴定法 目的要求: 1.掌握配位化合物的组成及命名,了解决定配位数的因素 2.掌握配位化合物键价理论要点,了解内轨型及外轨型配合 物,了解配合物的磁性 3.掌握配位平衡及有关计算:掌握沉淀反应对配位平衡的影 响并作有关计算,掌握酸碱反应对配位平衡的影响:了解多重平 衡常数及其应用 4.掌握整合物的结构特点及稳定性,了解整合剂的应用 5.了解配位化合物的应用及生物无机化学 6.掌握影响EDTA配合物稳定性的外部因素,重点掌握酸效 应和酸效应系数 7.掌握EDTA滴定法的基本原理,重点掌握单一金属离子准 确滴定的界限及配位滴定中酸度的控制 8.了解金属离子指标剂,了解提高配位滴定选择性的方法与 途径 重点: 配合物的命名和基本特点;配位平衡及其计算,酸效应、酸效应 系数和酸效应曲线:条件稳定常数:EDTA滴定法的基本原理 难点: 配合物的命名;价键理论中内、外轨及高、低自旋等概念:配位 平衡中的有关计算:酸效应曲线及其应用:配位滴定曲线 课堂组织: 配位化合物是一类由中心金属原子(离子)和配位体组成的化合物: 第一个配合物是1704年普鲁士人在染料作坊中为寻找蓝色染料,而将兽皮、 1

兽血同碳酸钠在铁锅中强烈煮沸而得到的,即KFe[Fe(CN]。配合物的形成 对元素和配位体都产生很大的影响,以及配合物的独特性质,使人们对配位 化学的研究更深入、广泛,它不仅是现代无机化学学科的中心课题,而且对 分析化学、生物化学、催化动力学、电化学、量子化学等方面的研究都有重 要的意义。 §8.1配位化合物的基本概念 一、配位化合物及其组成: 1.定义:配合物是由中心原子(或离子)和配位体(阴离子或分 子)以配位键的形式结合而成的复杂离子或分子,通常称这种复杂 离子或分子为配位单元。凡是含有配位单元的化合物都称配合物。 如:[Co(NH)63+、[HgL4子、Ni(CO)4等复杂离子或分子,其中都 含配位键,所以它们都是配位单元。由它们组成的相应化合物则 为配合物。如:[CoNH)6JCh、kHgL4]、Ni(CO)4 2.配位化合物的组成 1).中心离子:配离子的核心部分 通常是金属离子和原子,也有少数是非金属元素,例如: Cu2+,Ag",Fe,Fe2,Ni2+,B,PV. ◆过渡金属阳离子:Fe2+.Co2+ ◆金届原子:Ni(CO)4 ◆高价非金属元素:Sif62+ 阴离子:3

2)配位体: 配位体通常是非金属的阴离子或分子,例如: F,Cr,Br,T,OH,CN,H2O,NH3,CO. 配位原子一与中心离子成键的原子,含孤对电子。 单基配位体—配位体中只有一个配位原子。 多基配位体一具有两个或多个配位原子的配位体 例如: 乙二胺(en)(两个配位原子) H2N-CH2 CHz-NH2 乙二酸根(草酸根)(两个配位原子) C2012 乙二胺四乙酸根(简称EDTA,或Y(六个配位原子) 00C-H2C CH2CO0 4- N -CH2-CH2-N: -00C-H2C CH2C00 3)配位数: 在单基配体中,形成体的配位数等于配位数的数目:在多基配体 中,形成体的配位数等于配位体的数日与基数的乘积。 配位数的大小受中心离子的电荷和半径的影响。 配位化合物的命名: 对于整个配合物的命名,与一般无机化合物的命名原则相同, 如配合物外界酸根为简单离子,命名为某化某;如配合物外界酸 根为复杂阴离子,命名为某酸某:如配合物外界为OH,则命名为 氢氧化某

但配合物因为存在较为复杂的内界,起命名要比一般无机化 合物复杂。 内层命名顺序: 配位数、配位名称、“合”、形成体名称(氧化值)。配位数目 用倍数词头二、三、四等数字表示(配位数为一时省略),不同 配体名称之间以“"分开,在最后一个配体名称之后缀以“合”字。形 成体的氧化值用带括号的罗马数字表示(氧化值为0时省略)。 例: Ho[HgL] 四碘合汞(山)酸 K2[SiF] 六氟合硅(V)酸钾 K2[Co(SO)z] 二硫酸根合钴()酸钾 [Ag(NH)z]CI 氯化二氨合银(① [CrCL(NH)4]-CI-2H2O 二水合一氯化二氯四氨合铬(四) K[PtCl NH;] 三氯一氨合铂D酸钾 [Co(NH)5H20]Cl 三氯五氨一水合钴D) [Pt(NO)NH)NH,OH(Py)]CI一氯化一硝基一氨一羟胺一吡啶合铂 NH2「CrNH)(SCNI 四硫氰根二氨合铬(Ⅱ)酸铵 [Pt(NH2)(NO2)(NH)] 氨基一硝基二氨合铂四) [Ni(CO)4] 四羰基镍 0价可不标出

§8.2配位化合物的价键理论 一、价键理论: a.中心原子提供空轨道,配体提供孤对电子,以配位键相结合. 形成配位键的条件: ①M有空的价电子轨道 例:Zn2+3d4s4p Fe2+3d4s°4p ②L有孤对电子 NH3,:F,CH2CH2(π键电子对) b.中心原子在配体的影响下将采取不同的杂化形式,使配位 化合物有不同的空间构型和一定的配位数. 杂化轨道与配体孤对电子原子轨道以“头碰头”的方式重叠形 成σ配键,每个杂化轨道接受一个配位原子提供的孤对电子, 故:杂化轨道数=孤对电子数(配体数)=配键数目 ©.由于中心原子和配体的特征不同,形成稳定性不同的内轨或 外轨型配合物。 内轨型: (m-l)d,ns,np杂化成键 外轨型: ns,np,nd杂化成键 二、配离子的形成: 1外轨型配离子的形成: A.内层d轨道全充满,只能形成外轨型配合物 如:Zn2+3d104s04p0 Ag+4d105s050 例:ZnNH)42+Zn2+3d4s4p°(见课件)

B.中心离子内层d轨道未充满,但配体(F,H0,0H)的配位原子 电负性大,吸引电子能力强,对中心离子内层d电子排斥作用小, 不易使其电子重排,只能与外层轨道成键 例:FcH2063+ Ffe3+3d54s040 见课件 2.内轨型配离子的形成: A.中心离子本身具有空的内层d轨道,一般形成内轨型配离子。 如:Cr3+ 3d34s04p0 例:Cr(CN63 Cr3+:3d34s04p0 见课件 B.中心离子内层d电子在配体影响下激发,空出内层轨道杂化成 键,形成内轨型离子。 例:CuNH3)42+ Cu2+3d94s04p0 见课件 C.中心离子内层d电子在配体影响下重排,空出内层d轨道,形成 内轨型离子。 配体CN,CO:配位原子C电负性小,给出电子能力强,孤对电子对 中心离子内层d电子作用大,使其容易发生电子重排而空出内层d 轨道,形成内轨型配合物。 例:Fe(CN63-Fe3+3a54s04p0 见课件 3.杂化轨道与配离子空间构型 6
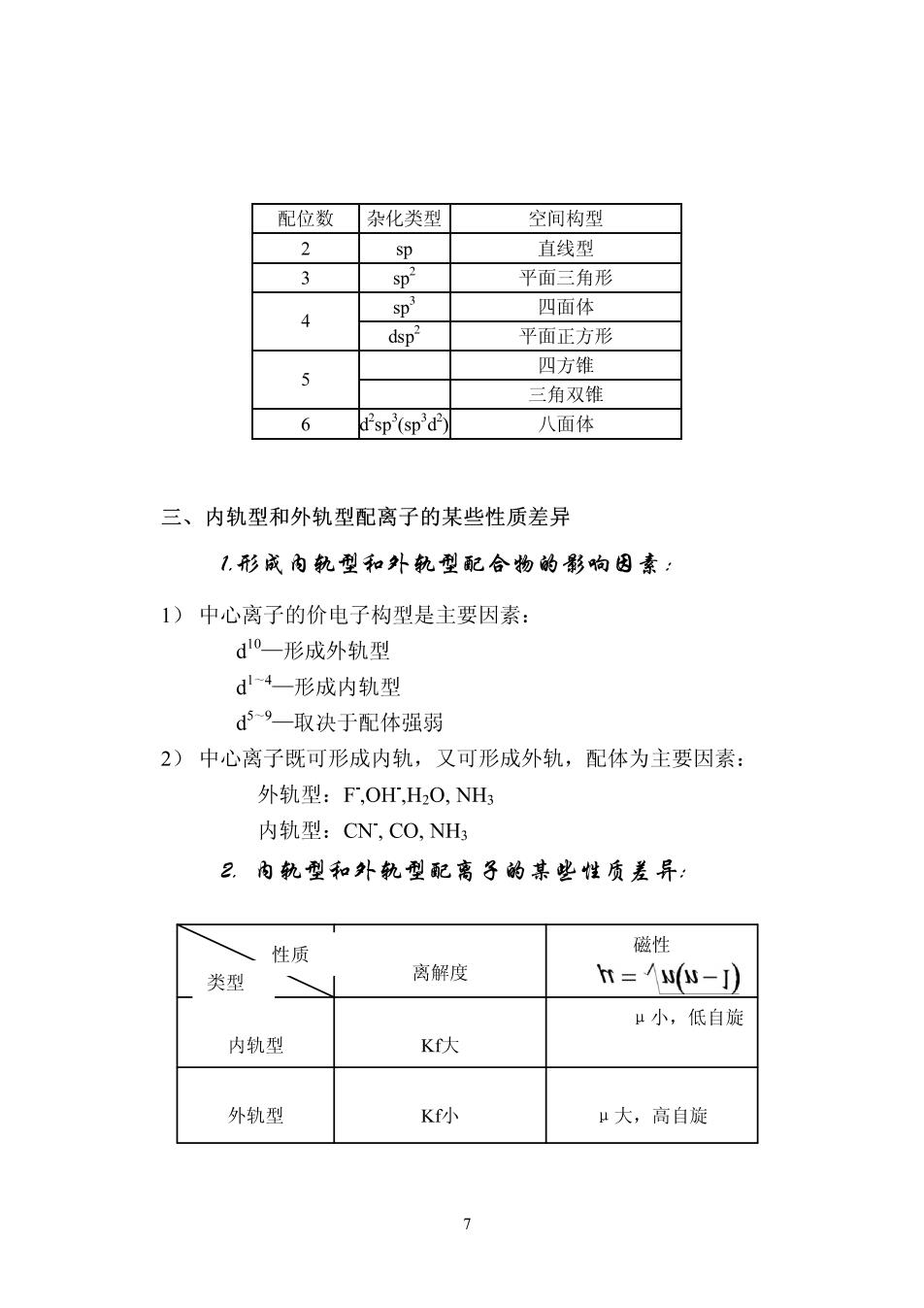
配位数杂化类型 空间构型 2 sp 直线型 3 sD 平面三角形 sp' 四面体 平面正方形 四方锥 三角双锥 6 d'sp'(sp'd) 八面体 三、内轨型和外轨型配离子的某些性质差异 1.形成内轨型和外轨型配合物的影响因素: 1)中心离子的价电子构型是主要因素: d0一形成外轨型 d4一形成内轨型 d9一取决于配体强弱 2)中心离子既可形成内轨,又可形成外轨,配体为主要因素: 外轨型:F,OH,HO,NH 内轨型:CN,CO,NH 2.内轨型和外轨型配离子的某些性质差异: 性质 磁性 类型 离解度 t=(-J) μ小,低自旋 内轨型 Kf大 外轨型 K小 μ大,高自旋 7

§8.3配位平衡 一、配离子的稳定常数 配离子或配合物分子在水溶液中存在着配合物的解离反应和生成 反应之间的平衡,这种平衡称为配位平衡。 1.稳定常数K:表示配离子在溶液中的稳定性的大小。 例: Ag"+2 NH3 位Ag(NHB)h 离解 配位平衡的平衡常数称配合物的稳定常数,用K表示.上述配 位平衡的稳定常数为: K,= c(Ag(NH,)) c(Ag")-c2(NH:) K愈大,配合物愈稳定.一般配合物的K数值均很大 2.配位反应是逐级进行的,每一级有相应的K。 例:Ag+NH3±AgNH3)+ Kno Ag(NH3)++NH3 Ag(NH3)2+K 配合物稳定常数是配合物在水溶液中离解稳定性的量度。对于 配位数相等的配离子,可根据K值的大小直接比较配离子的离解 稳定性,配位数不等的配离子之间,有时要通过计算才能比较。 例如,[CuY灯和[Cu(em2]2+的Kf值分别为5×1018和1.0×102, 8

实际上[CuY门比[Cu(en)z]2+更稳定。 3.配离子总的稳定常数等于各级稳定常数之积。 K-KnxK2 二、配位平衡的计算: 例:计算下列溶液中的浓度: 1.含有0.01 mol-LAg(NH)2*和0.01 molL"NH的溶液 2.含有0.01 mol-LAg(NH3)2和4 mol-L"NH的溶液 解: Ag+2NH,Ag(NH) 平衡x 0.01+2x 0.01-x k墙0a=1w 0.01 x=Ag+=5.9×106mol.L [NH3]=4molL,则Ag+=3.7×10mol.L 三、配位平衡的移动: 1.配位平衡与酸碱平衡 配合物中很多配体可接受质子,是碱。若配体碱性较强,溶 液中浓度又较大时,配体与质子结合,导致配离子离解。如 Cu(NH3)42+3d.0.5MH2SO4→天蓝色混浊+继续滴加0.5M H2SO,→混浊消失,溶液呈淡蓝色。 Cu(NH3)42*+2H*+2H2O-Cu(OH)2+4 NH" Cu(OH)2(s)+H2SO4-CuSO4+2H2O 这种因溶液浓酸度增大而导致配离子离解作用称为酸效应。 溶液酸度一定时,配体的碱性愈强,配离子愈不稳定。 配合物的中心原子大多是过渡金属离子,它们在水溶液中往 往会发生水解。溶液的碱性愈强,愈有利于水解的进行。这种因

金属离子与溶液中OH结合而使配离子离解的作用称为水解效应。 如 FeF3+3OH=6F+Fe(OH)3 为使配离子稳定,从水解效应考虑,pH值愈低愈好;从酸效 应考虑,则PH值愈高愈好。在一定酸度下,究竟是配位反应为主, 还是水解反应为主,或者是矿与配体结合成弱酸碱反应为主,这 要由配离子的稳定性、配体碱性强弱和中心原子氢氧化物的溶解 度等因素综合考虑,一般采取在不生成氢氧化物沉淀的前提下提 高溶液pH值的办法,以保证配离子的稳定性。 2配位平衡与沉淀平衡 AgCI溶液中加入NH3H2O,溶液中同时存在的AgC1沉淀 平衡和AgNH3)2配位平衡,即C和NH3竞争Ag: AgCl==Ag++CI- 十 2NH3 Ag(NH3)2 总反应:AgC1+2NH3=AgNH3)2+CI 竞争平衡常数K; K,-4g(NH):]Cr-] NH. =K·Kp 10