
第九章氧化还原反应与氧化还原滴定法 目的要求: 1.掌握氧化数的概念及氧化数规则 2.掌握原电池的组成,电极反应,电池符号:掌握电极电势 的概念及影响因素,掌握标准电极电势的概念 3.熟练掌握Nernst方程,掌握浓度、压力、酸度、沉淀反应、 配位反应对电极电势的影响,并能熟练的运用Nernst方程式进行 计算 4.掌握原电池电动势E与电池反应△rGm的关系,掌握 标准电动势与氧化还原反应标准平衡常数K的关系 5.掌握电极电势的应用:①表示水溶液中物质氧化、还原有 力的强弱:②判断氧化还原反应的方向:③判断氧化还原反应进 行的程度:④测定水溶液中离子的浓度(活度) 6.掌握元素电势图及其应用 7.了解氧化还原滴定法的基本特点,了解条件电极电势的概 念,了解条件平衡常数的概念,掌握氧化还原滴定对条件电极电 势差值的要求 8.了解氧化还原滴定曲线的计算方法,了解氧化还原滴定法 所用的指示剂 9.掌握高锰酸钾溶液的配制与标定,了解高锰酸钾法、碘量 法和重铬酸钾法的应用 10.掌握氧化还原平衡和氧化还原滴定法的计算 重点: 氧化数的概念和原电池:Nernst方程的应用:电极电势及其应用: 高锰酸钾法、碘量法和重铬酸钾法 1

难点: Nernst方程的应用:电势图及其应用:氧化还原滴定曲线:碘量 法。 课堂组织: 大多数的酸碱反应,沉淀反应,配位反应等,因为没有发生元 素氧化数的变化,统称为非氧化还原反应,与之对应的另一类涉 及氧化数变化的反应,则称为氧化还原反应。氧化还原反应是一 类重要的化学反应,应用广泛,是化学热能和电源的来源之一。 §9.1氧化还原反应 一、氧化与还原概念的演变 起先:与氧结合的过程叫氧化: 2Mg(sHOz(g)=2MgO(s)覆盖范围比较小 后来:失电子的过程叫氧化Mg一Mg2+2e揭露实质,扩大覆盖范 现在:对2P(s)+3C(g)=2PCl(①)显然“失电子”不明显 二、氧化数Oxidation number:: 1.定义:假设在形成化学键时成键电子转移给电负性较大的原子 时,所求得的原子所带的电荷数。是元素的一种表观电荷数。 2.取值:零、正负整数、分数 3.确定:规则同于化合价 ★在单质中,元素的氧化值为零。 ★在单原子离子中,元素的氧化值等于离子所带的电荷数 ★在大多数化合物中,氢的氧化值为+1,只有在活泼金属的氢化 物(如NaH,CaH2)中,氢的氧化值为-l ★通常,在化合物中氧的氧化值为-2;但在过氧化物(如 Hz02,N202,Ba02)中氧的氧化值为-1;而在0F2和02F2中,氧

的氧化值分别为+2和+1。 ★在所有氟化物中,氟的氧化值为-1。 ★碱金属和碱土金属在化合物中的氧化值分别为+1和+2。 ★在中性分子中,各元素氧化值的代数和为零。在多原子原子离 子中各元素氧化值的代数和等于离子所带的电荷数。 例:S202(连二亚硫酸根)中硫的氧化数 00 2x+4X(-2)=-2 X=3 0-S-S0 氧化值的概念也有不足之处,不是十分严格,如CH4,CH4,CHCl, CH2CL,CHC13和CC14中C的原子价为+4,氧化数却不同,依次 为-4,-2,0,+2和+4。还有一些例子,尽管如此,用氧化值讨论 仍很方便。 三、氧化还原反应: 1.氧化(oxidation)和还原(reduction):Cl2+2Ki=2KC1+I2 在氧化和还原反应中,元素氧化数升高的过程称为氧化。在氧化 和还原反应中,元素氧化数降低的过程称为还原。 1)氧化剂(oxidant):得电子的物质,氧化数降低。 还原剂(reductant):失电子的物质,氧化数升高。 2)氧化反应(oxidation reaction):失电子的过程 还原反应(reduction reaction):得电子的过程 3)氧化性:得电子的能力 还原性:失电子的能力 2.氧化还原半反应和氧化还原电对 一个氧化还原反应可分写成表示氧化、还原过程的两个半反 应,更明确氧化剂、还原剂在反应中的变化。 例:Cl2+2KI=2KC+2 Cl2发生还原反应:Cl2+2e=2CIr 12发生氧化反应:21-2e=2 氧化还原半反应式中,同一元素的两个不同氧化值的物种组 成了电对,其中氧化数较高的物质称为氧化型物质,氧化数较低 的物质称为还原型。 3

同一元素的氧化型和还原型构成的共轭体系称为氧化还原电对 (redox couple)。用“氧化型/还原型"表示。 例:Cl2/C,l21I 氧化还原反应是由两个电对构成的反应系统。可以表示为: 还原型(1)+氧化型〔2】二氧化型(1)+还原型〔2) ,氧化还原电对的书写形式与反应式有关。 半反应 电对 MnO4-+8H++5e=Mn2++4H2O MnO4-/Mn2+ MnO4-+2H20+3e=MnO2+40H- MnO4-/Mn20 ,在氧化还原电对中,氧化型的氧化能力越强,则其共轭还原型的 还原能力越弱:反之,还原型的还原能力越强,则其共轭氧化型 的氧化能力越弱。氧化还原反应是两个氧化还原电对共同作用的 结果,反应一般按照较强的氧化剂和较强的还原剂相互作用的方 向进行。 §9.2氧化还原反应方程式的配平(自学) 一、氧化数法: 氧化数法配平基本原则是:反应中氧化剂元素氧化数降低值 等于还原剂元素氧化数增加值,或得失电子的总数相等。 例: 4
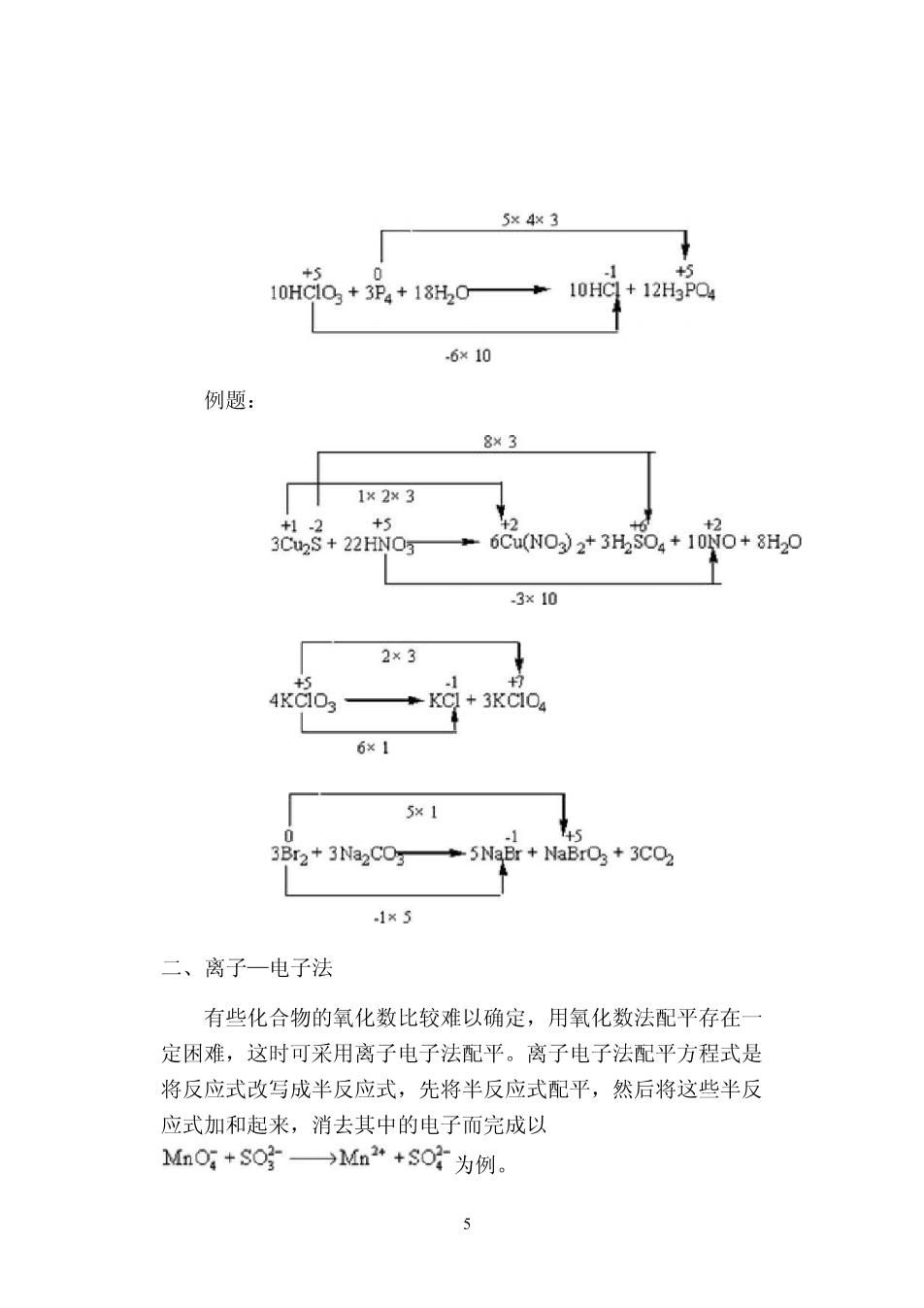
5×43 10HG0,+3,+18,0 +10HC+12H3PQ4 -6×10 例题: 8×3 1×2×3 +6Cu(NO)2+3H2S04+10N0+8H20 3x10 2×3 4KC03 ◆KC+3KCOa 6×1 5x1 3Br2+3Na2CO3 ◆5NaBr+NaBrO3+3C02 1×5 二、离子一电子法 有些化合物的氧化数比较难以确定,用氧化数法配平存在 定困难,这时可采用离子电子法配平。离子电子法配平方程式是 将反应式改写成半反应式,先将半反应式配平,然后将这些半反 应式加和起来,消去其中的电子而完成以 Mn0+S0g→Mn2“+S0为例。 5

配平步骤如下: 1·先将反应物的氧化还原产物,以离子形式写出。 MnO+S03→Mn2++S0 2.把总反应式分解为两个半反应:还原过程和氧化过程。 还原过程MaO+5→M2“ 氧化过程S0+2c→S0 3.分别配平两个半反应式中的H和O。 在酸性介质用H矿H2O配平。0多的一边加H,O少的 边加H0 在碱性介质中,用OHH0配平。0多的一边加H0,少 的一边加OH。 在中性介质中,用H0和H或OH配平。但不能一边加 H一边加OH厂。 还原过程MnO:+8阳*+5e一→Mn2+4组,0 氧化过程S0+2H*+2e→S0g+H,0 4,根据“氧化剂得电子总和等于还原剂失电子总和”的原 则,在两个半反应前面乘上适当的系数相减并约化。 还原过程:×2)MnO:+8组+5e→Mm2·+4H,0 -)氧化过程:×5)S0?+2H*+2e→S0+H20 2Mm0:+16H*+5S0}+5H20→2Mn2++8H,0+5S02+10H →2Mm0:+5S03+6H*→2Mm2++5S0子+3组,0 5.检查质量平衡及电荷平衡。 例题:配平下列方程式

1 C10+Cr0,>Cl+Cr0 (OH) 还原过程×3)C10+H,0+2e→C+20H -)氧化过程×2)Cr0+2组,0+36一→Gr0;+40H 3C10+2Cr0;+3班20+80H→3C1+2C0;+60H+420 约化:3C10°+2Cr0;+20H=3C1+2Cr0g+H20 2 As:S,+NOj+HHAsO,+S+NO+H2O 还原过程×10)NO+4*+3→N0+2组,0 -)氧化过程×3)2HAs03+3约+10F+10e一→sS,+6码,9 3AsS,+10NO5+10i*→6HAs03+9S+10N0+2E,0 3 Cu+FeCl,+HCI->HCuCl,+FeCl, 还原过程Fe”+e→Fe -)氧化过程CuC1,+e→Cu+2C1 Fe*+2C-+Cu -Fe +Cua, §9.3原电池与电极电势 一、原电池 1.原电池 1)将化学能转化为电能的装置 2)由两个半电池组成: (一)锌极===铜极(+) 低电位高电位 2.电极反应 在原电池中,两个半电池(half cell)中发生的反应叫做半电

池反应或电极反应(electrode reaction)。总的氧化还原反应叫做电 池反应(cell reaction)。 锌片为负极(negative electrode),发生氧化反应: Zn (s)=Zn2+(ag)+2e 铜片为正极(postive electrode),发生还原反应: Cu2 (aq)+2e=Cu (s) 铜-锌原电池反应为:Zn(s)+Cu2+(aq)=Zn2*(aq)+Cu(s) 3.原电他符号(cell notation): 原电池可用符号(一)电极丨电解质溶液|电极(+)表示。例 如上述铜锌原电池可表示为: 盐桥 个 (-)ZnZn2+(c)ICu*(cCu(+)→正极 ↓y 负极(個液)界面浓度(气体用分压表示) 1)左边表示负极,右边表示正极 2)表示界面,“表示盐桥 3)c,c2表示各溶液浓度,若有气体,注明气体分压。 4)每个半电极都是由两种物质组成:一种是高氧化态的氧化型物 质,Zn2*,Cu2+,另一种是低氧化态的还原型物质Zn,Cu,两种物质 组成了氧化还原电对Z2+Zn,Cu+/Cu,每个原电池都有两对氧化 还原电对。相同聚集状态(相同相态)的同一元素不同价态物质 可组成氧化还原电对如Fe2(c)和Fe3(c),PbSO4(s)和PbO2(S)。在 电池符号表示中两者用","号隔开:Fe2+(c,Fe3(c)及PbSO4(s), PbO2(s)

5)凡有参加氧化还原反应及电极反应的物质有的自身虽无发生氧 化还原反应,在原电池符号中仍需表示出来,例: MnO+5Fe2++8组*→Mm2++Fe4+4H,0 (-Fe++e→Fe2+ (+)Mm0,+89*+5e→M2++4且,0 没发生氧化还原,但有参与电极反应,故应在电池符号中表 示出来: ()PtFe(c).Fe (c)ll MnO (c).Mn (c).H (c)Pt(+) 6)若没有金属参加,引用惰性气体(如P)作导体,构成电极,如: Pt|Fe(c).Fe(c) ·由反应式写电池符号时,首先把总反应分解为两个半电极 反应:正极(还原)反应和负极(氧化)反应:找出半电极反应 的氧化还原电对,并判断所组成的电极类型:写出两个半极符号 并组成电池. 例:MnO4+5Fe2+8Ht=Mn2+5Fe3++4H20 电极反应:()Fe2+e=Fe3+ (+)MnO4-+8H++5e=Mn2++H2O 符号:(-)PtFe2+(c1),Fe3+(c2lMnO4(c3),Mn2+(c4),H*(c5)IPt(+) ●由电池符号写反应式时,应根据电池符号分别写出两个半 电极反应并分别配平(见离子电子法配平):在两个半反应前乘以 适当系数后相加或相减并约化得到总反应方程式

:(-)Pt]HNO2(c1).NO3(c2),H+(c3)IlFe3+(c4).Fe(c5)IPt(+) 电极反应: 负极:HNO2+H2O-2e=NO3+3HH 正极:Fe3++e=Fe2+ 电池反应:2Fe3++HNO2+H2O=2Fe2+NO3+H+ 二、电极电势(electrode potential) 在原电池中,用导线将两极连接在一起,检流计的指针发生偏 转,说明两个电极之间存在电势差,也就是说两个电极的电势不 同。什么是电极电势?它是如何产生的? 1.电极电势的产生 如图,当把金属棒放入它的盐溶液中时,一方面金属M表面 构成品格的金属离子和极性大的水分子互相吸引,有一种使金属 棒上留下电子而自身以水合离子M(ag)的形式进入溶液的倾 向。金属离子越活泼,这种倾向越大。另一方面,盐溶液中的离 子又有一种从金属表面获得电子而沉积在金属表面的倾向。金属 越不活泼,溶液越浓,这种倾向越大。这两种对立的倾向在某种 条件下达到暂时的平衡:M三M(ag)+ne 在某一给定浓度的溶液中,若失去电子的倾向大于获得电子 的倾向,到平衡时的最后结果是金属离子M进入溶液,使金属棒 上带负电,靠近金属棒附近的溶液带正电。这时在金属和溶液之 间产生电位差,这种产生在金属和盐溶液之间的电势叫金属的电 10