
第八章原子结构 19 第八章 原子结构 一、教学基本要求 1.氢原子结构的近代概念 了解微观粒子运动特征:了解原子轨道(波函数)、几率密度和电子云等 核外电子运动的近代的概念:熟悉四个量子数对核外电子运动状态的描述:熟 d原子轨道的形状和伸展方向。 2.电子原子结构 掌握原子核外电子分布原理,会由原子序数写出元素原子的电子分布式和 外层电子构型:掌握元素周期系和各区元素原子或离子的电子层结构的特征;根 据元素原子的电子分布式能确定元素在周期表中的位置。了解有效核电荷、屏蔽 效应的概念:熟悉原子半径、有效核电荷、电离能、电子亲合能、电负性、主要 氧化值等周期性变化规律,以了解元素的有关性质, 二、学时分配: 授内 容 学时数(6.0) ,氢原子结构的近代概念 2.0 2.多电子原子结构 4.0 三、教学内容 §8.1引言 从19世纪末,随着科学的进步和科学手段的加强,在电子、放射性和x射线 等发现后,人们对原子内部的较复杂结构的认识越来越清楚。1911年卢瑟福 (Rutherford E)建立了有核原子模型,指出原子是由原子核和核外电子组成的, 原子核是由中子和质子等微观粒子组成的,质子带正电荷,核外电子带负电荷 在一般化学反应中,原子核并不发生变化 只是核外电子运动状态发 变。因此原子核外电子层的结构和电子运动的规律,特别是原子外电子层结构, 就成为化学领域中重要问题之一。 原子中核外电子的排布规律和运动状态的研究以及现代原子结构理论的建 立,是从对微观粒子的波粒二象性的认识开始的。 §8.2氢原子结构的近代概念 8.2.1微观粒子的运动特征 1.微观粒子的波粒二象性 光的干涉、衍射现象表现出光的波动性,而光压、光电效应则表现出光的 粒子性。称为光的波粒 二象性。光的波粒二象性可表示为入=h/p=h/mv式 中,m是粒子的质量,”是粒子运动速度p是粒子的动量。 1924年,法国理论物理学家德布罗依(de Broglie L V)在光的波粒二象性 的启发下,大胆假设微观粒子的波粒二象性是具有普遍意义的一种现象。他认
第八章原子结构 100 第八章 原子结构 一、教学基本要求 1.氢原子结构的近代概念 了解微观粒子运动特征;了解原子轨道(波函数)、几率密度和电子云等 核外电子运动的近代的概念;熟悉四个量子数对核外电子运动状态的描述;熟 悉 s、p、d 原子轨道的形状和伸展方向。 2.电子原子结构 掌握原子核外电子分布原理,会由原子序数写出元素原子的电子分布式和 外层电子构型;掌握元素周期系和各区元素原子或离子的电子层结构的特征;根 据元素原子的电子分布式能确定元素在周期表中的位置。了解有效核电荷、屏蔽 效应的概念;熟悉原子半径、有效核电荷、电离能、电子亲合能、电负性、主要 氧化值等周期性变化规律,以了解元素的有关性质。 二、学时分配: 三、教学内容 §8.1引言 从19世纪末,随着科学的进步和科学手段的加强,在电子、放射性和x射线 等发现后,人们对原子内部的较复杂结构的认识越来越清楚。1911年卢瑟福 (Rutherford E)建立了有核原子模型,指出原子是由原子核和核外电子组成的, 原子核是由中子和质子等微观粒子组成的,质子带正电荷,核外电子带负电荷。 在一般化学反应中,原子核并不发生变化,只是核外电子运动状态发生改 变。因此原子核外电子层的结构和电子运动的规律,特别是原子外电子层结构, 就成为化学领域中重要问题之一。 原子中核外电子的排布规律和运动状态的研究以及现代原子结构理论的建 立,是从对微观粒子的波粒二象性的认识开始的。 §8.2 氢原子结构的近代概念 8.2.1 微观粒子的运动特征 1.微观粒子的波粒二象性 光的干涉、衍射现象表现出光的波动性,而光压、光电效应则表现出光的 粒子性。称为光的波粒二象性。光的波粒二象性可表示为λ= h/p= h /mυ 式 中,m 是粒子的质量,υ 是粒子运动速度 p 是粒子的动量。 1924年,法国理论物理学家德布罗依(de Broglie L V)在光的波粒二象性 的启发下,大胆假设微观粒子的波粒二象性是具有普遍意义的一种现象。他认 讲 授 内 容 学时数(6.0) 1.氢原子结构的近代概念 2.0 2.多电子原子结构 4.0

第八章原子结构 为不仅光具有波粒二象性,所有微观粒子,如电子、原子等也具有波粒二象性。 1927年,德布罗依的大胆假设就由戴维逊(①avi CJ)和盖革G 电子衍射实验所证实。 子束A入射到镍单品B上 观察散射电子束的强度和散射角的关系,结果得到完 全类似于单色光通过小圆孔那样得到的衍射图像,如图所示。这表明电子确实 具有波动性。电子衍射实验证明德布罗依关于微观粒子波粒二象性的假设是正 确的。 图8-1电子衍 其实验 (a) 6 电子的粒子性只需通过下面实验即可证实:阴极射线管内两极之间装一个 可旋转的小飞轮 当阴极射线打在小飞轮上,小飞轮即可旋转,说明电子是有 质量、有动量的粒子,亦即具有粒子性。 2.微观离子运动的统计性 在经典力学中,一个宏观粒子在任一瞬间的位置和动量是可以同时准确测 定的。例如发出一颗炮弹,若知道它的质量、初速及起始位置,根据经典力学 就能准确地知道某一时刻炮弹的位置、速度(或动量)。换 它的运动轨道 是可测知的。而对具有波粒二象性的微观粒子则不同,现在已证明:由于它们 运动规律的统计性.我们不能像在经典力学中那样来描述它们的运动状态,即 不能同时准确地测定它们的速度和空间位置。 l927年海森伯(Heisenberg W)提出了测不准原理(uncertainty principle),AxAP=h 为粒子位置的不确定度, △P为粒子动量的不确定度 由此可见,对于宏观物体可同时准确测定位置和动量(或速度),即不确定 原理对宏观物体实际上不起作用,而该原理却很好地反映了微观粒子的运动特 征。表明具有波动性的微观粒子与服从经典力学的宏观粒子有完全不同的特点。 8.2.2核外电子运动状态描述 一、波函数y和电子云 1,波函数 1926年,薛定谔根据波粒二象性的概念提出了一个描述微观粒子运动的基本方 程一薛定谔方程。薛定谔方程是 个二阶微分方程:
第八章原子结构 101 为不仅光具有波粒二象性,所有微观粒子,如电子、原子等也具有波粒二象性。 1927年,德布罗依的大胆假设就由戴维逊(Davisson C J)和盖革(Geiger H)的 电子衍射实验所证实。图8-1是电子衍射实验的示意图。当经过电位差加速的电 子束A入射到镍单晶B上,观察散射电子束的强度和散射角的关系,结果得到完 全类似于单色光通过小圆孔那样得到的衍射图像,如图所示。这表明电子确实 具有波动性。电子衍射实验证明德布罗依关于微观粒子波粒二象性的假设是正 确的。 图8-1电子衍射实验 电子的粒子性只需通过下面实验即可证实:阴极射线管内两极之间装一个 可旋转的小飞轮,当阴极射线打在小飞轮上,小飞轮即可旋转,说明电子是有 质量、有动量的粒子,亦即具有粒子性。 2.微观离子运动的统计性 在经典力学中,一个宏观粒子在任一瞬间的位置和动量是可以同时准确测 定的。例如发出一颗炮弹,若知道它的质量、初速及起始位置,根据经典力学, 就能准确地知道某一时刻炮弹的位置、速度(或动量)。换言之,它的运动轨道 是可测知的。而对具有波粒二象性的微观粒子则不同,现在已证明:由于它们 运动规律的统计性.我们不能像在经典力学中那样来描述它们的运动状态,即 不能同时准确地测定它们的速度和空间位置。 1927 年 海 森 伯 (Heisenberg W) 提 出 了 测 不 准 原 理 (uncertainty principle),ΔxΔP=h Δx 为粒子位置的不确定度, ΔP 为粒子动量的不确定度。 由此可见,对于宏观物体可同时准确测定位置和动量(或速度),即不确定 原理对宏观物体实际上不起作用,而该原理却很好地反映了微观粒子的运动特 征。表明具有波动性的微观粒子与服从经典力学的宏观粒子有完全不同的特点。 8.2.2 核外电子运动状态描述 一、 波函数和电子云 1.波函数 1926年,薛定谔根据波粒二象性的概念提出了一个描述微观粒子运动的基本方 程—薛定谔方程。薛定谔方程是一个二阶微分方程:

第八章原子结构 (EV)v-0 2 a2 当将这个方程用于氢原子时,求解这个方程,就能把氢原子系统的波函数和能 量E求出来。r是核与电子的距离,代入上式,得到原子轨道和电子云的分布图 波函数的空间图像。但求解过程很复杂, 下面只介绍求解得到的一些基本 概念。 2.电子云 氢原子核外只有一个电子,设想核的位置固定,而电子并不是沿固定的轨 道运动,由于不确定关系,也不可能同时测定电子的位置和速度。但我们可以 统计的方法来判断电子在核外空间某一区域出现的机会(概率)是多少。设想 有 ·高速照相机能摄取电子在某一解间的位置。然后在不同瞬间拍摄成千上 万张照片,若分别观察每一张照片,则它们的位置各不相同,似无规律可言, 但如果把所有的照片叠合在一起看,就明显地发现电子的运动具有统计规律性 电子经常出现的区域是在核外的一个球形空间。如用小黑点表示一张照片上电 子的位置,如叠合起来就如图8-2所示。离核愈近处,黑点愈密,它如同带负 电的云一样,把原子核包围起来,这种想像中的图形就叫做电子云 图(a)电于 在核附近出现的概率密度最大。概率密度随r的增加而减少。图b)是一系列的 同心球面,一个球面代表一个等密度面,在一个等密度面上概率密度相等。图 中的数字表示概率密度的相对大小,同样离核愈近,概率密度愈大,其值规定 为1。图(c)是电子云的界面图,它表示在界面内电子出现的概率(如95%以上) 概率密度代表单位体积中电子出现的概率。 二、原子轨道和电子云的图像 (a电子云 (b)等密崖面 (c)界面图 图8-2电子云和界面图 电子运动的状态由波函数业来描述,丨中|则是电子在核外空间出现的几率 密度。处于不同运动状态的电子,它们的中各不相同,其」中?也不同 在波函数中(r、0、)=Rr)()中()中,R(r)与r有关,可以用以讨论宿 向的分布;其他两个函数与电子出现在什么角度(旧和)有关,将两个函数可以 合并起来,用以讨论角度分布。 即令:e(θ)Φ()=Y(日、) Y(日、)称为角度波函数,于是波函数中可以写为
第八章原子结构 102 当将这个方程用于氢原子时,求解这个方程,就能把氢原子系统的波函数和能 量E求出来。r是核与电子的距离,代入上式,得到原子轨道和电子云的分布图 ——波函数的空间图像。但求解过程很复杂,下面只介绍求解得到的一些基本 概念。 2.电子云 氢原子核外只有一个电子,设想核的位置固定,而电子并不是沿固定的轨 道运动,由于不确定关系,也不可能同时测定电子的位置和速度。但我们可以 用统计的方法来判断电子在核外空间某一区域出现的机会(概率)是多少。设想 有一个高速照相机能摄取电子在某一瞬间的位置。然后在不同瞬间拍摄成千上 万张照片,若分别观察每一张照片,则它们的位置各不相同,似无规律可言, 但如果把所有的照片叠合在一起看,就明显地发现电子的运动具有统计规律性, 电子经常出现的区域是在核外的一个球形空间。如用小黑点表示一张照片上电 子的位置,如叠合起来就如图 8-2 所示。离核愈近处,黑点愈密,它如同带负 电的云一样,把原子核包围起来,这种想像中的图形就叫做电子云,图(a)电子 在核附近出现的概率密度最大。概率密度随 r 的增加而减少。图(b)是一系列的 同心球面,一个球面代表一个等密度面,在一个等密度面上概率密度相等。图 中的数字表示概率密度的相对大小,同样离核愈近,概率密度愈大,其值规定 为 1。图(c)是电子云的界面图,它表示在界面内电子出现的概率(如 95%以上)。 概率密度代表单位体积中电子出现的概率。 二、原子轨道和电子云的图像 图 8-2 电子云和界面图 电子运动的状态由波函数ψ来描述,|ψ| 2则是电子在核外空间出现的几率 密度。处于不同运动状态的电子,它们的ψ各不相同,其|ψ| 2 也不同。 在波函数ψ(r、、)=R(r)Θ()Φ()中,R(r)与r有关,可以用以讨论径 向的分布;其他两个函数与电子出现在什么角度(和)有关,将两个函数可以 合并起来,用以讨论角度分布。 即令:Θ()Φ()=Y(、) Y(、)称为角度波函数,于是波函数ψ可以写为 0 8 2 2 2 2 2 2 2 2 + − = + + (E V) h m x y z

第八章原子结构 中(r、0、)=R(r)Y(0、) 下面分别讨论原子轨道和电子云角度分布图。波函数中的角度部分是Y(日、) 若以Y(、)对、 作图则得到波函数的角度分布图, 若以r(、)对、◆作 图,得到电子云的 分布图(即概率密度的分布图)。 1.中的角度分布图 原子轨道的角度分布图的具体作法是:从球极坐标原点出发,引出各条方 向为0、中的直线,取它们的长度等于相应的Y(、中)值,将所有这些直线的 端点连起来, 在空间形成的曲面即为原子轨道的角度分布图。 因为(0、)只 、m有关 与n无关 2.|中的角度分布图 如前所述,把中在空间中的分布叫做电子云,它形象地表示电子在空间 出现的概率密度的大小。 把波函数的角度部分Y(日、)取平方后Y(6、中)对(6、)作图就得到电子 云角度分布图 电子云的角度分布图与相应的波函数的角度分布图是相似的,但有区别: 波函数的角度分布图中Y有正负,电子云的角度分布图Y则无正负。 而且由于Y(0、)<1,取平方后其值更小,所以电子云角度分布图稍“瘦长” 些。图8-3是5、p、d电子云的角度分布图。 图8-35、p、d电子云的角度分布图 中六 米米米 夺
第八章原子结构 103 ψ(r、、)= R(r)Y(、) 下面分别讨论原子轨道和电子云角度分布图。波函数ψ的角度部分是Y(、)。 若以Y(、)对、 ,作图则得到波函数的角度分布图,若以Y 2 (、)对、 作 图,得到电子云的分布图(即概率密度的分布图)。 1. ψ的角度分布图 原子轨道的角度分布图的具体作法是:从球极坐标原点出发,引出各条方 向为 、 的直线,取它们的长度等于相应的Y(、) 值,将所有这些直线的 端点连起来,在空间形成的曲面即为原子轨道的角度分布图。因为Y(、) 只 与l、m有关,与n无关。 2. |ψ| 2的角度分布图 如前所述,把|ψ| 2在空间中的分布叫做电子云,它形象地表示电子在空间 出现的概率密度的大小。 把波函数的角度部分Y(、)取平方后Y 2 (、)对(、) 作图就得到电子 云角度分布图。 电子云的角度分布图与相应的波函数的角度分布图是相似的,但有区别: 波函数的角度分布图中Y有正负,电子云的角度分布图Y 2则无正负。 而且由于Y(、)<1,取平方后其值更小,所以电子云角度分布图稍“瘦长” 些。图8-3是 s、p、d电子云的角度分布图。 图 8-3 s、p、d 电子云的角度分布图

第八章原子结构 三、四个量子数 要描述原子中各电子的运动状态,需用四个参数确定 1.主量子数 主量子数(住电子层数)n=1,2,3,4,5,6,7,. 电子层符号: K,L,M,N,O,P. 物理意义:主量子数是描述电子离核的远近程度的参数,电子运动的能量 主要由主量子数n来决定,n值越大,电子的能量越高。 2.角量子数1 角量子数1的取值为0,1,2,3.,(n-1), 在光谱学上分别以s,p,d,f,.表示。 意义:角量子数1是描述电子云形状。 当相同时,不同的1值(即不同的电子云形状)对能量值也稍有影响,且 与1值成正比,例如:当主量子数同为时,有如下的关系:E<E<E<E,这 是因为1值越小,电子在核附近出现的机会多,受核的引力大,能量也较低。 由于1的不同,引起能量的不同,可以理解为能量再分级或形成了亚层(或副 层)。例如,n=1的电子层,1只能取0,它只能有一个能级:当=2时,1可以 取0,1两个值,所以有2个能级(或有2个亚层):当=3时,1可以取0,1,2, 所以有3个能级(成有3个亚厚)。 3.磁量子数m 磁量子数m的量子化条件是取值0,±1,士2,士3.士1。 磁量子数表示原子轨道在空间的一种伸展方向。1=0时,m只取一个值,即 m=0,表示亚层只有一个轨道。当1=1时,m=0,土1,p、p,和p,这三种不同伸 展方向的轨道能量是相同的 4.自旋量子数 电子除绕核运动外,其自身还做自旋运动。为了描述核外电子自旋状态, 引入第四个量子数一自旋量子数m。,根据量子力学的计算规定:m只可能取+1/2 和-1/2,用以表示两种不同的自旋状态,通常用正反两个箭头↓和个来表示。 综上所述,主量子数和角量子数决定原子轨道的能量:角量子数决定原子 轨道的形状:磁量子数决定原子轨道的空间取向或原子轨道的数目自旋量子 数电子运动的自旋状态。也就是说,电子在核外运动的状态可以用四个量子数 来描 例已知核外某电子的四个量子数n=21=1m=-1m,=+1/2 则这是指第二电子层、p亚层2Px2Py轨道上自旋方向以+1/2为特征的那 个由子 §8.3多电子原子结构 8.3.1原子结构的周期性 一、屏蔽效应和钻穿效应 在原子轨道的能级图上出现能级交错的原因,来源于屏蔽效应和钻穿效应。 下面分别介绍
第八章原子结构 104 三、 四个量子数 要描述原子中各电子的运动状态,需用四个参数确定。 1.主量子数 n 主量子数 (主电子层数) n=1, 2, 3, 4, 5, 6,7,. 电子层符号: K,L,M,N,O,P. 物理意义:主量子数n是描述电子离核的远近程度的参数,电子运动的能量 主要由主量子数n来决定,n值越大,电子的能量越高。 2.角量子数 l 角量子数 l 的取值为0,1,2,3.,(n-1), 在光谱学上分别以 s,p,d,f,.表示。 意义:角量子数 l是描述电子云形状。 当n相同时 ,不同的 l 值(即不同的电子云形状)对能量值也稍有影响,且 与 l值成正比,例如:当主量子数同为n时,有如下的关系:Ens<Enp<End<Enf,这 是因为 l 值越小,电子在核附近出现的机会多,受核的引力大,能量也较低。 由于 l 的不同,引起能量的不同,可以理解为能量再分级或形成了亚层(或副 层)。例如,n=1的电子层,l 只能取0,它只能有一个能级;当n=2时,l 可以 取0,1两个值,所以有2个能级(或有2个亚层);当n=3时,l 可以取0,1,2, 所以有3个能级(或有3个亚层)。 3.磁量子数m 磁量子数m的量子化条件是取值0,±1,± 2,± 3.±l。 磁量子数表示原子轨道在空间的一种伸展方向。l=0 时,m 只取一个值,即 m=0,表示亚层只有一个轨道。当 l=1 时,m=0,± 1,px、py和 pz这三种不同伸 展方向的轨道能量是相同的 4.自旋量子数ms 电子除绕核运动外,其自身还做自旋运动。为了描述核外电子自旋状态, 引入第四个量子数—自旋量子数ms,根据量子力学的计算规定:ms只可能取+1/2 和-1/2,用以表示两种不同的自旋状态,通常用正反两个箭头和来表示。 综上所述,主量子数和角量子数决定原子轨道的能量;角量子数决定原子 轨道的形状;磁量子数决定原子轨道的空间取向或原子轨道的数目;自旋量子 数电子运动的自旋状态。也就是说,电子在核外运动的状态可以用四个量子数 来描述。 例已知核外某电子的四个量子数n=2 l=1 m=-1 ms=+1/2 则这是指第二电子层、p亚层2Px 2Py轨道上自旋方向以+1/2为特征的那一 个电子。 §8.3 多电子原子结构 8.3.1原子结构的周期性 一 、屏蔽效应和钻穿效应 在原子轨道的能级图上出现能级交错的原因,来源于屏蔽效应和钻穿效应。 下面分别介绍

第八章原子结构 1.屏蔽效应 安原子核从只有1个由子,这个由子仅受到原子核的作用。句原子的波动 程可精确求解。但是在多电子原子中,每 一个由子不仅到 带Z个电荷的原子 的吸引,而且还受到(亿-)个电子的排斥。故至今尚未能对除氢原子或类氢原手 以外的微观粒子运动方程精确求解,因此对多电子原子系统是采取近似的方法 在多电子原子中,核电荷对某个电子的吸引力,因其它电子对该电子的排 后而被到弱的作用称为屏被效应 7,=7 01 其中乙'是有效核电荷数。σ:为屏蔽常数 G就是电子1受其他电子排斥而在核的吸引上要把核的正电荷扣除的部分。 2.钻穿效应 由图8-4中可知不同电子在离核r处球面上出现的概率大小不同。对于较大 的电子(例如3s,3即电子),出现概率最大的地方离核较远,但在离核较近的地 方有小峰,表明在离核较近的地方电子也有出现的可能.也就是说外层电子可 能钻到内层出现在离核较近的地方,这种现象叫做钻穿效应 3d 图8-44s,3d电子云的径向分布图 二.核外电子排布原理 根据光谱实验数据以及对元素性质周期律的分析,归纳出多电子原子中的 电子在核外的排布应遵从以下三条原则,即泡利(Pauli)不相容原理、能量最低 原理和洪特(und)规则。 1.泡利不相容原理 泡利指出:在同一原子中不可能有四个量子数完全相同的2个电子同时存 在,称为泡利不相容原理。换言之,每一种运动状态的电于只能有1个,在同 轨道上最多只能 纳自旋方向相反的2 个电于 。由于每个电子层中原子轨道 的总数是n2个,因此各电子层中电子的最大容量是2n个。 2.能量最低原理 在不违背泡利不相容原理的前提下电子在个轨道上的排布方式应使整个原 子能量处于最低状态,即多电子原子在基态时核外电子总是尽可能地先占据能 量最低的轨道,称为能量最低原理 3.洪特规则 电子在能量相同的轨道(即等价轨道)上排布时,总是尽可能以自旋相同的 方向分占不同的轨道,因为这样的排布方式总能量最低,称为洪特规则。 洪特规则特例:对于同一电子亚层,当电子分布为半充满(’、°、)、全 态0、少和全空(、时,电子云分布是球子结酸
第八章原子结构 105 1.屏蔽效应 氢原子核外只有1个电子,这个电子仅受到原子核的作用,氢原子的波动方 程可精确求解。但是在多电子原子中,每一个电子不仅受到带Z个电荷的原子核 的吸引,而且还受到(Z-1)个电子的排斥。故至今尚未能对除氢原子或类氢原子 以外的微观粒子运动方程精确求解,因此对多电子原子系统是采取近似的方法。 在多电子原子中,核电荷对某个电子的吸引力,因其它电子对该电子的排 斥而被削弱的作用称为屏蔽效应 令 Z’=Z - i,其中Z’是有效核电荷数。i 为屏蔽常数。 i 就是电子i受其他电子排斥而在核的吸引上要把核的正电荷扣除的部分。 2.钻穿效应 由图8-4中可知不同电子在离核r处球面上出现的概率大小不同。对于n较大 的电子(例如3s,3p电子),出现概率最大的地方离核较远,但在离核较近的地 方有小峰,表明在离核较近的地方电子也有出现的可能.也就是说外层电子可 能钻到内层出现在离核较近的地方,这种现象叫做钻穿效应。 图8-4 4s,3d电子云的径向分布图 二. 核外电子排布原理 根据光谱实验数据以及对元素性质周期律的分析,归纳出多电子原子中的 电子在核外的排布应遵从以下三条原则,即泡利(Pauli)不相容原理、能量最低 原理和洪特(Hund)规则。 1.泡利不相容原理 泡利指出:在同一原子中不可能有四个量子数完全相同的 2 个电子同时存 在,称为泡利不相容原理。换言之,每一种运动状态的电于只能有 1 个,在同 一轨道上最多只能容纳自旋方向相反的 2 个电子。由于每个电子层中原子轨道 的总数是 n 2个,因此各电子层中电子的最大容量是 2n2个。 2.能量最低原理 在不违背泡利不相容原理的前提下电子在个轨道上的排布方式应使整个原 子能量处于最低状态,即多电子原子在基态时核外电子总是尽可能地先占据能 量最低的轨道,称为能量最低原理。 3.洪特规则 电子在能量相同的轨道(即等价轨道)上排布时,总是尽可能以自旋相同的 方向分占不同的轨道,因为这样的排布方式总能量最低,称为洪特规则。 洪特规则特例:对于同一电子亚层,当电子分布为半充满(p 3、d 5、f 7)、全 充满(p 6、d 10、f 1 4)和全空(p 0、d 0、f 0)时,电子云分布呈球状,原子结构较 稳定
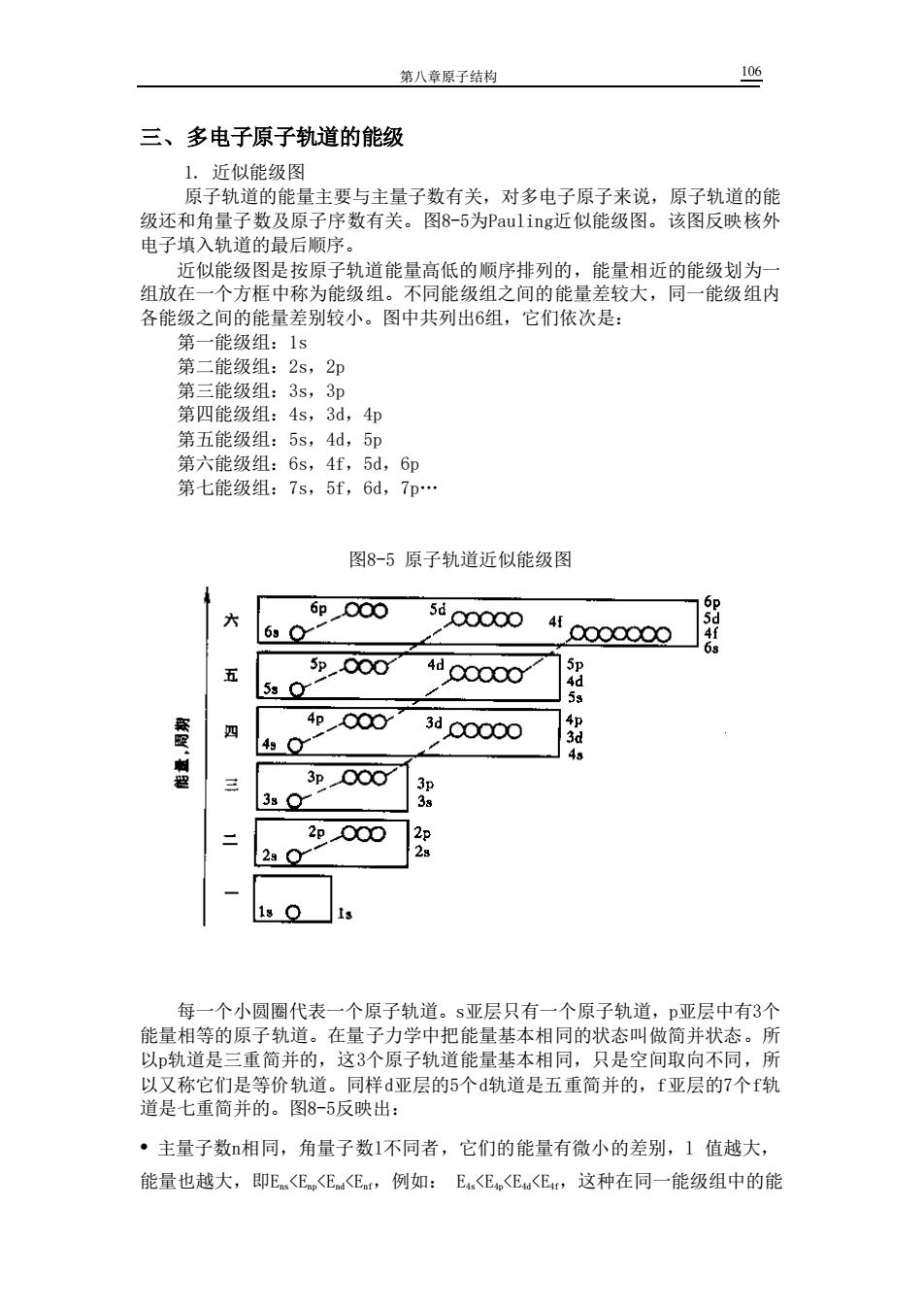
第八章原子结构 106 三、多电子原子轨道的能级 近似能级图 原 轨道的能量主要与主量子数有关,对多电子原子来说,原子轨道的能 级还和角量子数及原子序数有关。图8-5为Paulingi近似能级图。该图反映核匀 电子填入轨道的最后顺序。 近似能级图是按原子轨道能量高低的顺序排列的,能量相近的能级划为 组放在一个方框中称为能级组。不同能级组之间的能量差较大,同一能级组内 各能级之间的能量差别较小。图中共列出6组 它们依次是 第一能级组:1s 第二能级组:2s,2p 第三能级组:35,3p 第四能级组:4s,3d,4p 第五能级组:5s,4d,5 第六能级组 65,4f,5d,6p 第七能级组:7s,5f,6d,7p. 图8-5原子轨道近似能级图 6p00∞ 6g● 5d00000 4f0000000 6 5p,Q00 4d00000 5s or 四 4p00 4s O 3d00000 三 3p000 3s o 阳 p000 2g0y1 1s O 1s 每一个小圆圈代表一个原子轨道。s亚层只有一个原子轨道,p亚层中有3个 能量相等的原子轨道。在量子力学中把能量基本相同的状态叫做简并状态。所 以轨道是三重简并的,这3个原子轨道能量基本相同,只是空间取向不同,所 ·主量子数相同,角量子数1不同者,它们的能量有微小的差别,1值越大, 能量也越大,即E<E<E<E,例如:E<E<Eu<EH,这种在同一能级组中的能
第八章原子结构 106 三、多电子原子轨道的能级 1. 近似能级图 原子轨道的能量主要与主量子数有关,对多电子原子来说,原子轨道的能 级还和角量子数及原子序数有关。图8-5为Pauling近似能级图。该图反映核外 电子填入轨道的最后顺序。 近似能级图是按原子轨道能量高低的顺序排列的,能量相近的能级划为一 组放在一个方框中称为能级组。不同能级组之间的能量差较大,同一能级组内 各能级之间的能量差别较小。图中共列出6组,它们依次是: 第一能级组:1s 第二能级组:2s,2p 第三能级组:3s,3p 第四能级组:4s,3d,4p 第五能级组:5s,4d,5p 第六能级组:6s,4f,5d,6p 第七能级组:7s,5f,6d,7p. 图8-5 原子轨道近似能级图 每一个小圆圈代表一个原子轨道。s亚层只有一个原子轨道,p亚层中有3个 能量相等的原子轨道。在量子力学中把能量基本相同的状态叫做简并状态。所 以p轨道是三重简并的,这3个原子轨道能量基本相同,只是空间取向不同,所 以又称它们是等价轨道。同样d亚层的5个d轨道是五重简并的,f亚层的7个f轨 道是七重简并的。图8-5反映出: • 主量子数n相同,角量子数l不同者,它们的能量有微小的差别,l 值越大, 能量也越大,即Ens<Enp<End<Enf,例如: E4s<E4p<E4d<E4f,这种在同一能级组中的能
第八章原子结构 1 量差别称为能组分裂。 ·若角量子数相同,其能级次序则由主量子数决定,越大能量越高,例:如 Ea<Ep<Ee。 ·若主量子数和和角量子数】同时变动时,能量次序就比较复杂。这种情况常 发生在第三层以上的电子层中,如E,<E<E,等。这种现象称为能级交错。 ·核外电子的能级次序,直接关系到核外电子的排布次序,因此引起许多学者 的关注。我国化学家徐光宪教授总结归纳出一个近似公式,利用(+0.71)值的 大小,来计算各原于轨道的相对次序,并将所得值的整数部分相同者,作为 个能级组。 •必须指出,Pauling的近似能级图,只是基本上反映了多电子原子核外电子的 能级填充次序,如果忽略了不同元素的原子的个性,认为所有元素的原子都能 满足近似能级图,显然是不现实的。后来的光谱实验和量子力学的理论证明, 随着元素原子序数的增加,核对电子的引力增加,轨道的能量都有所下降,由 于下降的程度不同,所以能级的相对位置就随之而变。 2.原子轨道能级与原子序数的关系 50 75 原子作数z 图8-6原子轨道能级与原子序数的关系图 当代的美国无机化学家科顿(Cotton)指出:原子轨道的能级在很大程度上取 决于原子序数。他根据有关数据画出了原子轨道能量随原子序数而变化的图,称
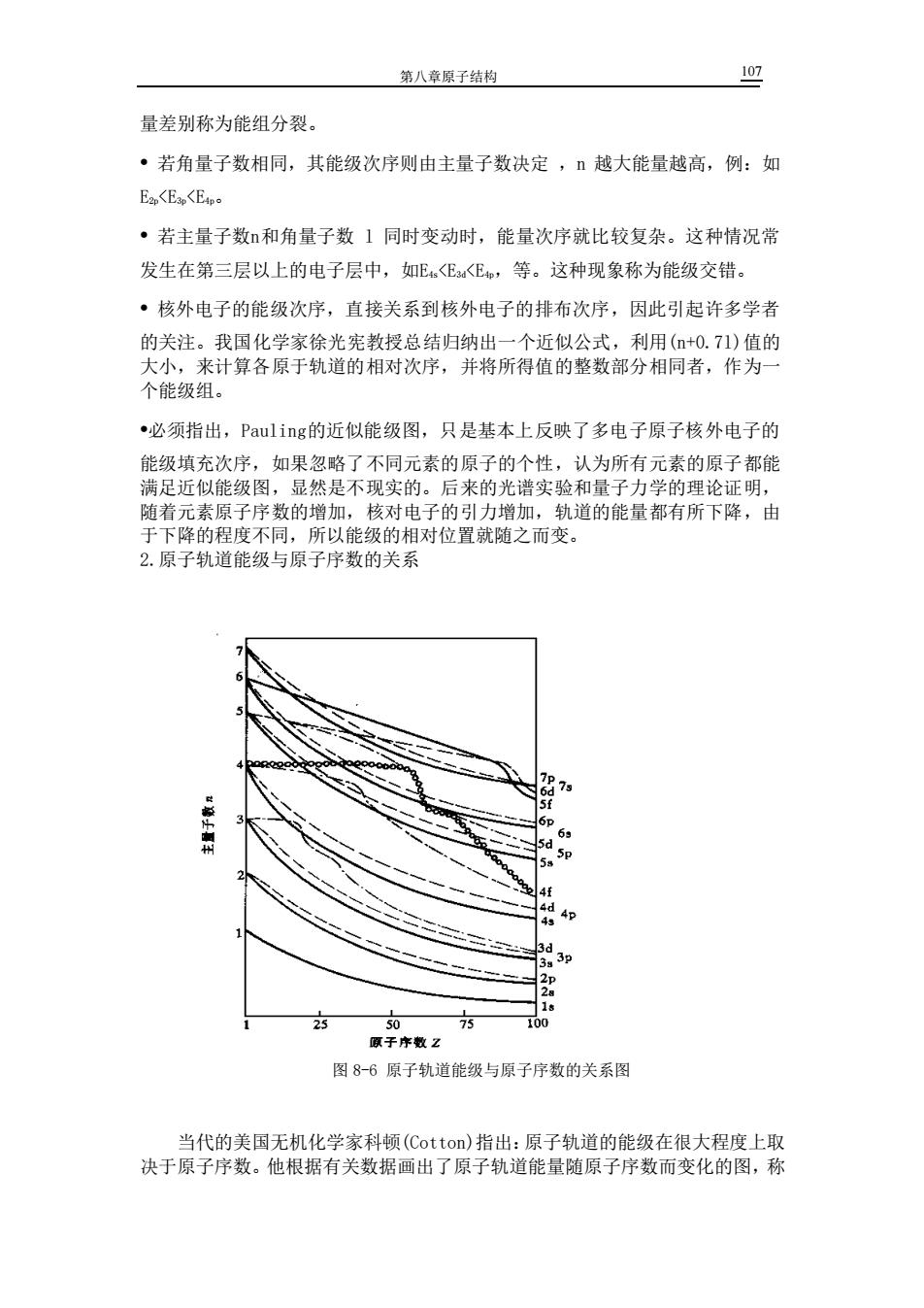
第八章原子结构 107 量差别称为能组分裂。 • 若角量子数相同,其能级次序则由主量子数决定 ,n 越大能量越高,例:如 E2p<E3p<E4p。 • 若主量子数n和角量子数 l 同时变动时,能量次序就比较复杂。这种情况常 发生在第三层以上的电子层中,如E4s<E3d<E4p,等。这种现象称为能级交错。 • 核外电子的能级次序,直接关系到核外电子的排布次序,因此引起许多学者 的关注。我国化学家徐光宪教授总结归纳出一个近似公式,利用(n+0.7l)值的 大小,来计算各原于轨道的相对次序,并将所得值的整数部分相同者,作为一 个能级组。 •必须指出,Pauling的近似能级图,只是基本上反映了多电子原子核外电子的 能级填充次序,如果忽略了不同元素的原子的个性,认为所有元素的原子都能 满足近似能级图,显然是不现实的。后来的光谱实验和量子力学的理论证明, 随着元素原子序数的增加,核对电子的引力增加,轨道的能量都有所下降,由 于下降的程度不同,所以能级的相对位置就随之而变。 2.原子轨道能级与原子序数的关系 图 8-6 原子轨道能级与原子序数的关系图 当代的美国无机化学家科顿(Cotton)指出:原子轨道的能级在很大程度上取 决于原子序数。他根据有关数据画出了原子轨道能量随原子序数而变化的图,称

第八章原子结构 为Cottor能级图。从图8-6中可知:随着原子序数的增加,各原子轨道能量都 逐渐降低,由于下降的程度不同,因而发生能级交错。例如,当原子序数大于 21时,3d的能级就低于4s能级。Cotton能级图更能反映原子核外电子的实阿 情况。 四、电子分布式和电子构型 应用Pam1in析似能级图和核外由子填充规则,110种元素中可以准确写出91种 原子的核外电子分布式,只有19种元素原子外层电子的分布情况稍有例外,我 们主要要求主族、过渡元素中符合上述规律的元素核外电子的排布(不包括放射 性元素)。 1.电子分布式(电子构型、电子组态): 原子实:为避免电子分布式书写过繁,可用该元素前一周期稀有气体元素符号 外加方括号表示。 价电子构型:决定元素化学性质的主要是原子的外层电子,所以主族元素只写 出nsp轨道的电子分布式,副族元素只写出(n-1)dns轨道的电子分布式。 核外电子填充实例和表示方法: 例1:P电子分布式:1s22s22p3s3p 原子实表示Ne]3s3p 例 Cr [Ar]4s'3d 3是半满状态稳定,所以4s的一个电 子排在3d轨道上 以上是电子填充顺序(能级交错),电子分布式按的大小顺序写。 即:Cr[Ar]3d4s 例3:Cu[Ar]3d4s' 原因同上。 例4:P由子填东顺字 或:@Pb[Xe]6s5d4f6p 电子分布式:Pb[Xe]4f“5d6s6p 2.离子的电子构型实例: 原子失去申子后使成为离子,离子的电子排布取决于电子从何轨道中失去 电子失去顺序,按照徐光宪的+0.41规则,值大的先失去。失电子顺序为: ns (n-1)d+(n-2)f 基态原子外层电子填充顺序为: →ns→(n-2)f→(n-1)d→np 例:sFe2[Ar]3d4s°而Fe[Ar]3d4s2 aFe"[Ar]3d'4s ·小结: (1)原子的最外电子层最多只能容纳8个电子(第一电子层只能容纳2个电子)。 (2)次外电子层最多只能容纳18个电子(若次外层=1或2,则最多只能有2或8个 电子 (3)原子的外数第三层最多只有32个电子(若该层的=1,2,3,则最多只能有2, 8,18个电子)
第八章原子结构 108 为 Cotton 能级图。从图 8-6 中可知:随着原子序数的增加,各原子轨道能量都 逐渐降低,由于下降的程度不同,因而发生能级交错。例如,当原子序数大于 21 时,3d 的能级就低于 4s 能级。Cotton 能级图更能反映原子核外电子的实际 情况。 四、电子分布式和电子构型 应用Pauling近似能级图和核外电子填充规则,110种元素中可以准确写出91种 原子的核外电子分布式,只有19种元素原子外层电子的分布情况稍有例外,我 们主要要求主族、过渡元素中符合上述规律的元素核外电子的排布(不包括放射 性元素)。 1.电子分布式(电子构型、电子组态): 原子实:为避免电子分布式书写过繁,可用该元素前一周期稀有气体元素符号 外加方括号表示。 价电子构型:决定元素化学性质的主要是原子的外层电子,所以主族元素只写 出ns np轨道的电子分布式,副族元素只写出(n-1)d ns 轨道的电子分布式。 核外电子填充实例和表示方法: 例 1:15P 电子分布式:1s2 2s2 2p6 3s2 3p3 原子实表示 [Ne] 3s2 3p3 例2: 24Cr [Ar] 4s1 3d5 3d5是半满状态稳定,所以4s的一个电 子排在3d轨道上。 以上是电子填充顺序(能级交错),电子分布式按n的大小顺序写。 即: 24Cr [Ar] 3d5 4s1 例3:29Cu [Ar] 3d104s1 原因同上。 例4:82Pb 电子填充顺序 1s2 2s2 2p6 3s2 3p6 4s2 3d104p6 5s2 4d105p6 6s2 5d104f146p2 或: 82Pb [Xe]6s2 5d104f146p2 电子分布式:82Pb [Xe] 4f145d106s2 6p2 2.离子的电子构型实例: 原子失去电子后便成为离子,离子的电子排布取决于电子从何轨道中失去。 电子失去顺序,按照徐光宪的 n+0.4l 规则,值大的先失去。失电子顺序为: np ns (n-1)d (n-2)f 基态原子外层电子填充顺序为:: ns (n-2)f (n-1)d np 例:26Fe2+ [Ar]3d6 4s0 而26Fe[Ar]3d6 4s2 26Fe3+ [Ar]3d5 4s0 •小结: (1)原子的最外电子层最多只能容纳8个电子(第一电子层只能容纳2个电子)。 (2)次外电子层最多只能容纳18个电子(若次外层n=1或2,则最多只能有2或8个 电子)。 (3)原子的外数第三层最多只有32个电子(若该层的n=1,2,3,则最多只能有2, 8,18个电子)

第八章原子结构 109 8.3.2元素周期律 根据元素性质的周期性,建立了长式周期表,原子核外电子排布的周期性 规律是元素周期律的本质。 、 周期与能级组 从各元素原子的电子层结构可知,当主量子数依次增加时,n每增加1个数 值就增加 能级细 个新的电子层 而每 能级组就相当于周 期表中的一个周期。从长式周期表上可知:在第四周期中, 从21号元素Sc到3( 号元素Z,它们新增的电子都是填充到3d轨道上,这10种元素称为第四周期的 过渡元素。从39号元素Y到48号元素Cd,新增的电子都是填充到4d轨道上,这10 种元素称为第五周期的过渡元素。在第六周期中,从57号元素La到71号元素Lu, 新增的电子都是依次填充在4轨道上,这14种元素习惯上称为镧系元素。从72 号元素世到S 号元素g,新增加的电子则依次填充到5d轨道} 这也是过渡元 素。第七周期,从87号元素下r到112号元素ub,共25种元素是不完全周期,可 以预计这一周期也应有32种元素,其中从89号元素Ac到103号元素Lu,称为钢系 元素。 每当主量子数增加1时,相应的在周期表上就出现一个新的周期。这就是元素 性质呈周期性变化的根本原因,换言之,周期的本质是按能级组的不同对元素 进行分类。能级组和周期性的关系可参阅表8-1。 表8-1能级组与周期的关系 能级组内各亚层电子填充次宇 周期和周期名称能级组 起止元素所含元素的个数 (反肤核外电子构显的变化) 1.特短周期 He 1 2.细用期 Li→e 8 3→2过6 3.短周期 In一wh 3的-2→3p4 4.长周期 18 4g +3d04p6 5.长别 nR一是 R 5-2→4d10→5p6 6,特长测期 4Cs-8Rn 32 6g2→4f14一→5-→6p6 1,未完周期 【nr→未完 二、外层电子构型与元素分区、分族 1.周期表中的族 ●主族:周期表中共有7个主族,IA一WA,凡最后1个电子填入ns或p亚层上的 都是主族元素,价电子的总数等于其族数。例如元素S核外电子排布是 1s22s22p3s23p,最后填入3p亚层,价电子构型为3s23p,故为VIA族。 ·副族:周期中共有IB一WB7个副族。凡最后1个电子填人(血一1)d或(n一2)f
第八章原子结构 109 8.3.2元素周期律 根据元素性质的周期性,建立了长式周期表,原子核外电子排布的周期性 规律是元素周期律的本质。 一、 周期与能级组 从各元素原子的电子层结构可知,当主量子数n依次增加时,n每增加1个数 值就增加一个能级组,也就增加一个新的电子层,而每一个能级组就相当于周 期表中的一个周期。从长式周期表上可知:在第四周期中,从21号元素Sc到30 号元素Zn,它们新增的电子都是填充到3d轨道上,这10种元素称为第四周期的 过渡元素。从39号元素Y到48号元素Cd,新增的电子都是填充到4d轨道上,这10 种元素称为第五周期的过渡元素。在第六周期中,从57号元素La到71号元素Lu, 新增的电子都是依次填充在4f轨道上,这14种元素习惯上称为镧系元素。从72 号元素Hf到80号元素Hg,新增加的电子则依次填充到5d轨道上,这也是过渡元 素。第七周期,从87号元素Fr到112号元素Uub,共25种元素是不完全周期,可 以预计这一周期也应有32种元素,其中从89号元素Ac到103号元素Lu,称为锕系 元素。 每当主量子数增加1时,相应的在周期表上就出现一个新的周期。这就是 元素 性质呈周期性变化的根本原因,换言之,周期的本质是按能级组的不同对元素 进行分类。能级组和周期性的关系可参阅表8-1。 表 8-1 能级组与周期的关系 二、外层电子构型与元素分区、分族 1.周期表中的族 • 主族:周期表中共有7个主族,IA一ⅦA,凡最后1个电子填入ns或np亚层上的, 都是主族元素,价电子的总数等于其族数。例如元素16S核外电子排布是 1s2 2s2 2p6 3s2 3p4,最后填入3p亚层,价电子构型为3s2 3p4,故为ⅥA族。 • 副族:周期中共有IB一ⅦB 7个副族。凡最后1个电子填人(n—1)d或(n—2)f