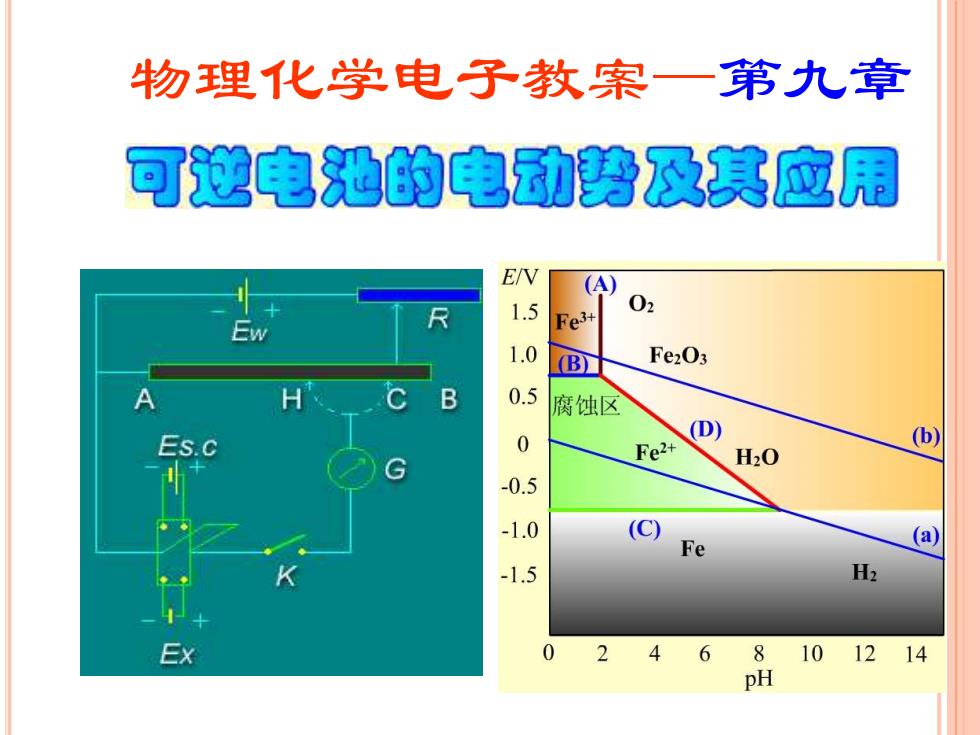
物理化学电子教案一第九章 可逆电池的电动势及其应用 ENV (A) 1.5 02 Fe3+ 1.0 B Fe2O3 B 0.5 腐蚀区 0 (D) Fe2+ H20 (b) -0.5 -1.0 (C)Fe (a) -1.5 H2 Ex 02 46 8 101214 pH
物理化学电子教案—第九章

第九章可逆电池的电动势及其应用 §9.1可逆电池和可逆电极 §9.2电动势的测定 §9.3可逆电池的书写方法及电动势的取号 §9.4可逆电池的热力学 §9.5电动势产生的机理 §9.6电极电势和电池的电动势 §9.7电动势测定的应用 §9.8内电位、外电位和电化学势
第九章 可逆电池的电动势及其应用 §9.1 可逆电池和可逆电极 §9.2 电动势的测定 §9.3 可逆电池的书写方法及电动势的取号 §9.4 可逆电池的热力学 §9.5 电动势产生的机理 §9.6 电极电势和电池的电动势 §9.7 电动势测定的应用 §9.8 内电位、外电位和电化学势

§9.1可逆电池和可逆电极 可逆电池 可逆电极和电极反应
§9.1 可逆电池和可逆电极 可逆电池 可逆电极和电极反应

电化学与热力学的联系 热力学 △rG1ER 电化学 (A,Ga)r.pA= =-27 重要公式: (△,G)n,nR=Wmax=-nEF
重要公式: r , , f,max ( ) = = − G W nEF T p R 电化学与热力学的联系 r m , , ( )T p R nEF G zEF = − = −

如何把化学反应转变成电能? 1。该化学反应是氧化还原反应,或包含有氧化 还原的过程 2。有适当的装置,使化学反应分别通过在电极 上的反应来完成 3。有两个电极和与电极建立电化学平衡的相应 电解质 4。有其他附属设备,组成一个完整的电路
如何把化学反应转变成电能? 1。该化学反应是氧化还原反应,或包含有氧化 还原的过程 2。有适当的装置,使化学反应分别通过在电极 上的反应来完成 3。有两个电极和与电极建立电化学平衡的相应 电解质 4。有其他附属设备,组成一个完整的电路
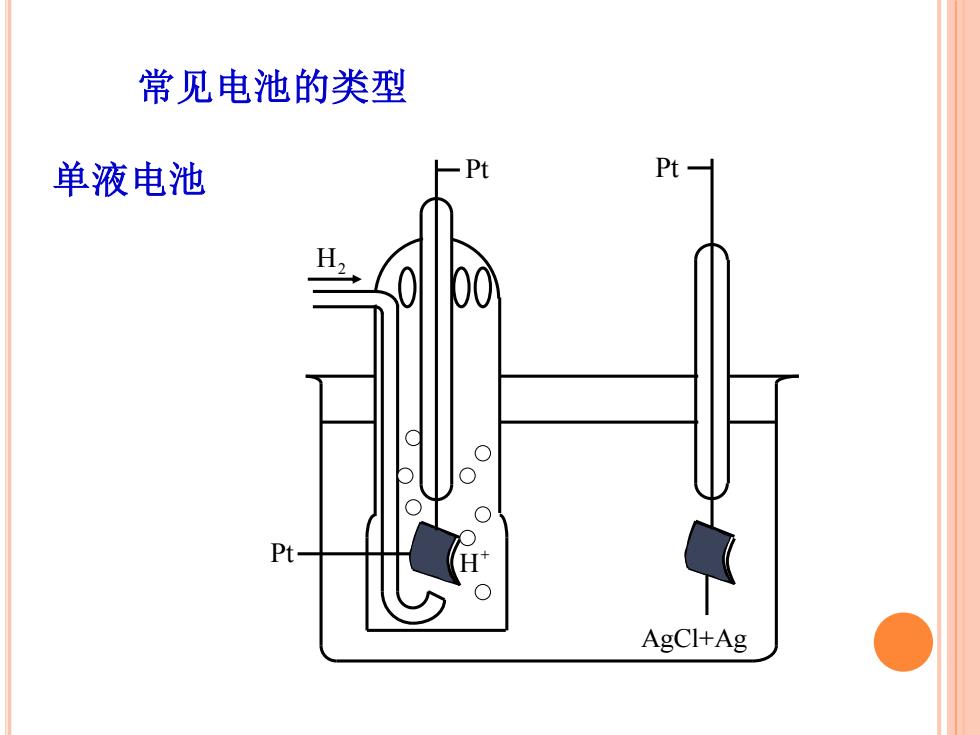
常见电池的类型 单液电池 Pt- Pt- AgCl+Ag
常见电池的类型 单液电池 H2 Pt+ H Pt Pt AgCl+Ag
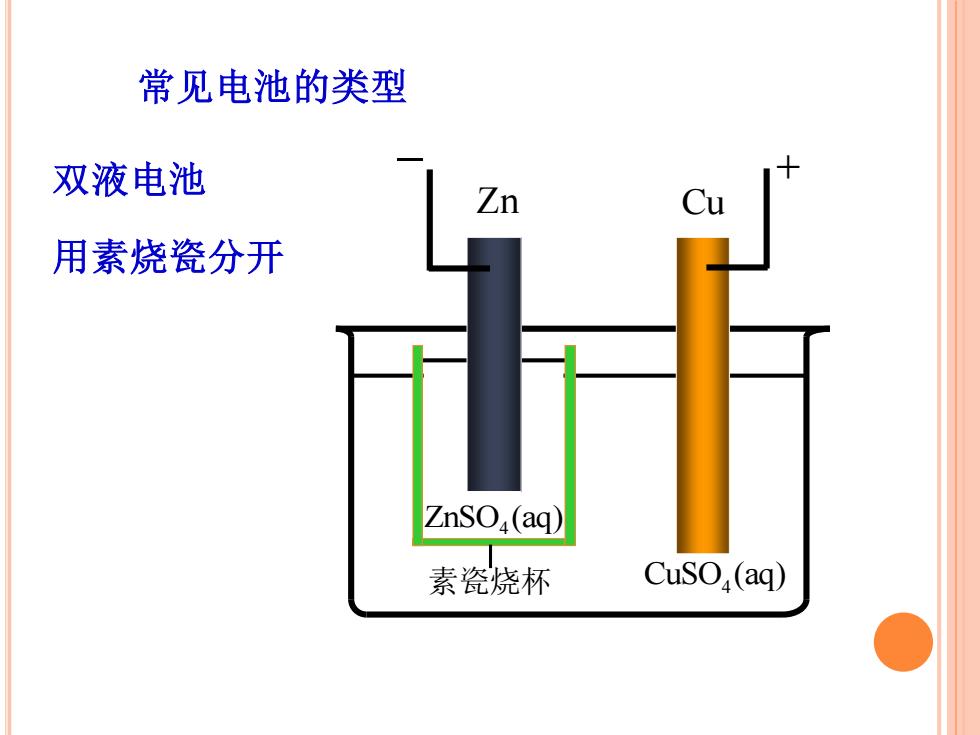
常见电池的类型 双液电池 Zn 用素烧瓷分开 ZnSO(aq) 素瓷烧杯 CusO,(aq)
常见电池的类型 双液电池 用素烧瓷分开 Zn Cu − + CuSO (aq) 4 ZnSO (aq) 4 素瓷烧杯
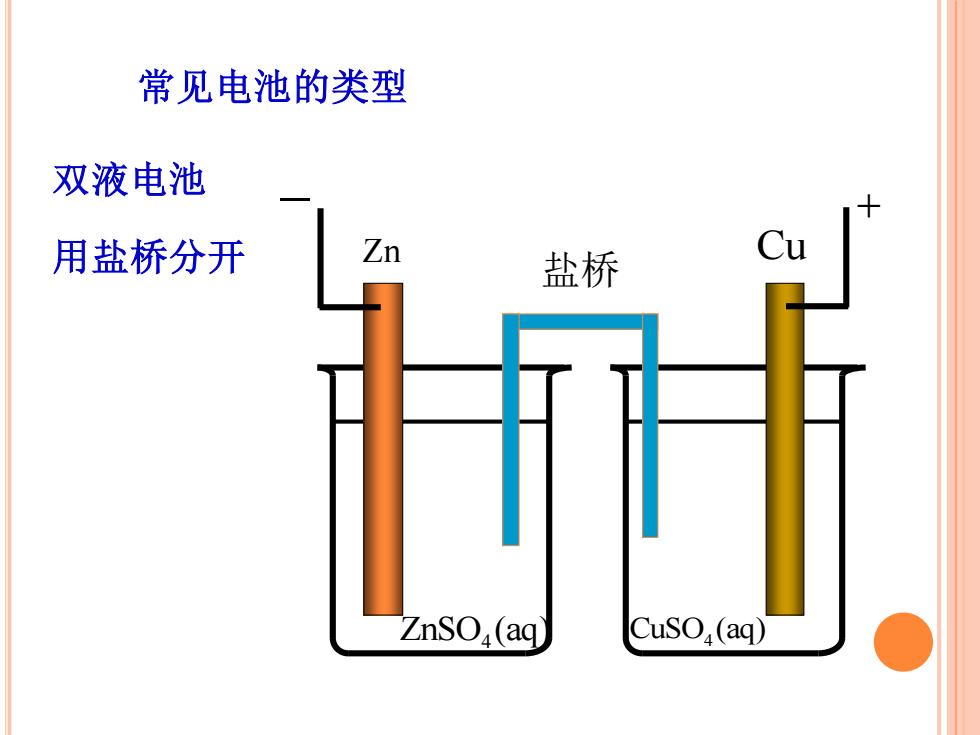
常见电池的类型 双液电池 用盐桥分开 Zn 盐桥 ZnSO(aq CusO,(aq)
常见电池的类型 双液电池 用盐桥分开 ZnSO (aq) 4 CuSO (aq) 4 Zn Cu − + 盐桥
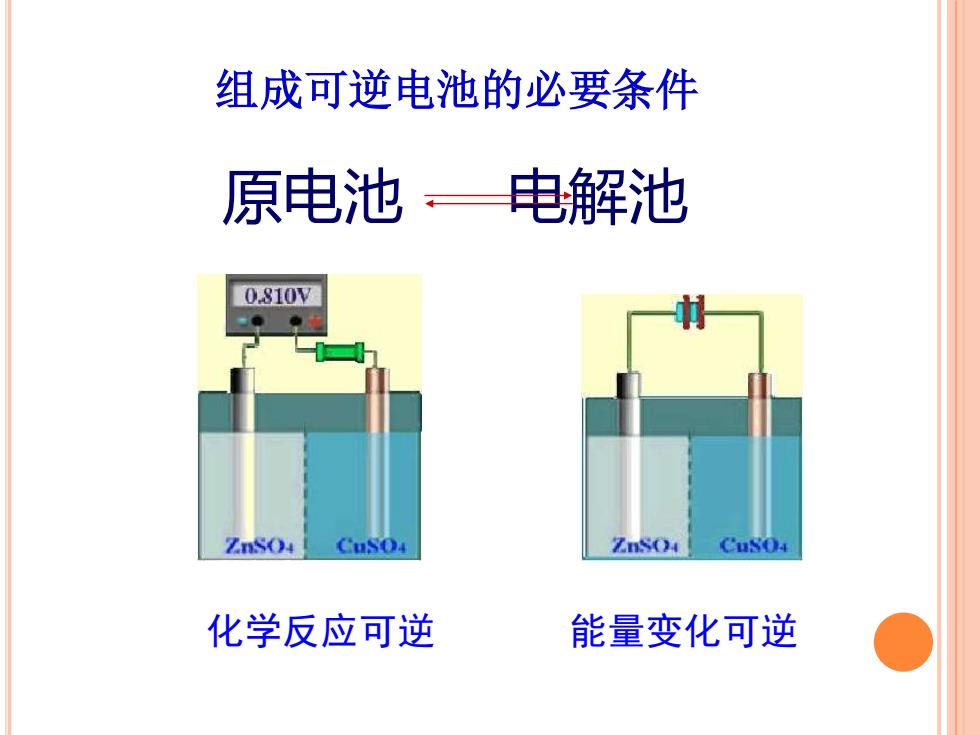
组成可逆电池的必要条件 原电池电解池 0.810V ZnSo4 CuSO4 Cuso 化学反应可逆 能量变化可逆
化学反应可逆 原电池 电解池 组成可逆电池的必要条件 能量变化可逆

组成可逆电池的必要条件 将化学能转化为电能的装置称为电池,若此转化是 以热力学可逆方式进行的,则称为“可逆电池”。 在可逆电池中(△,Gm)zpW,=-nFE 其中E:电池两电极间的电势差,在可逆条件下,达 最大值,称为电池的电动势。 1.可逆电池充放电时的反应必须互为逆反应一物质 的转变可逆; 见下列两例 2.可逆电池中所通过的电流必须为无限小一能 量的转变可逆。 可逆电池必须同时满足上述两个条件
组成可逆电池的必要条件 1. 可逆电池充放电时的反应必须互为逆反应──物质 的转变可逆; 2.可逆电池中所通过的电流必须为无限小──能 量的转变可逆。 可逆电池必须同时满足上述两个条件. 见下列两例 将化学能转化为电能的装置称为电池,若此转化是 以热力学可逆方式进行的,则称为“可逆电池”。 在可逆电池中 (ΔrGm)T,p=Wr ’ =-nFE 其中E: 电池两电极间的电势差,在可逆条件下,达 最大值,称为电池的电动势