正在加载图片...
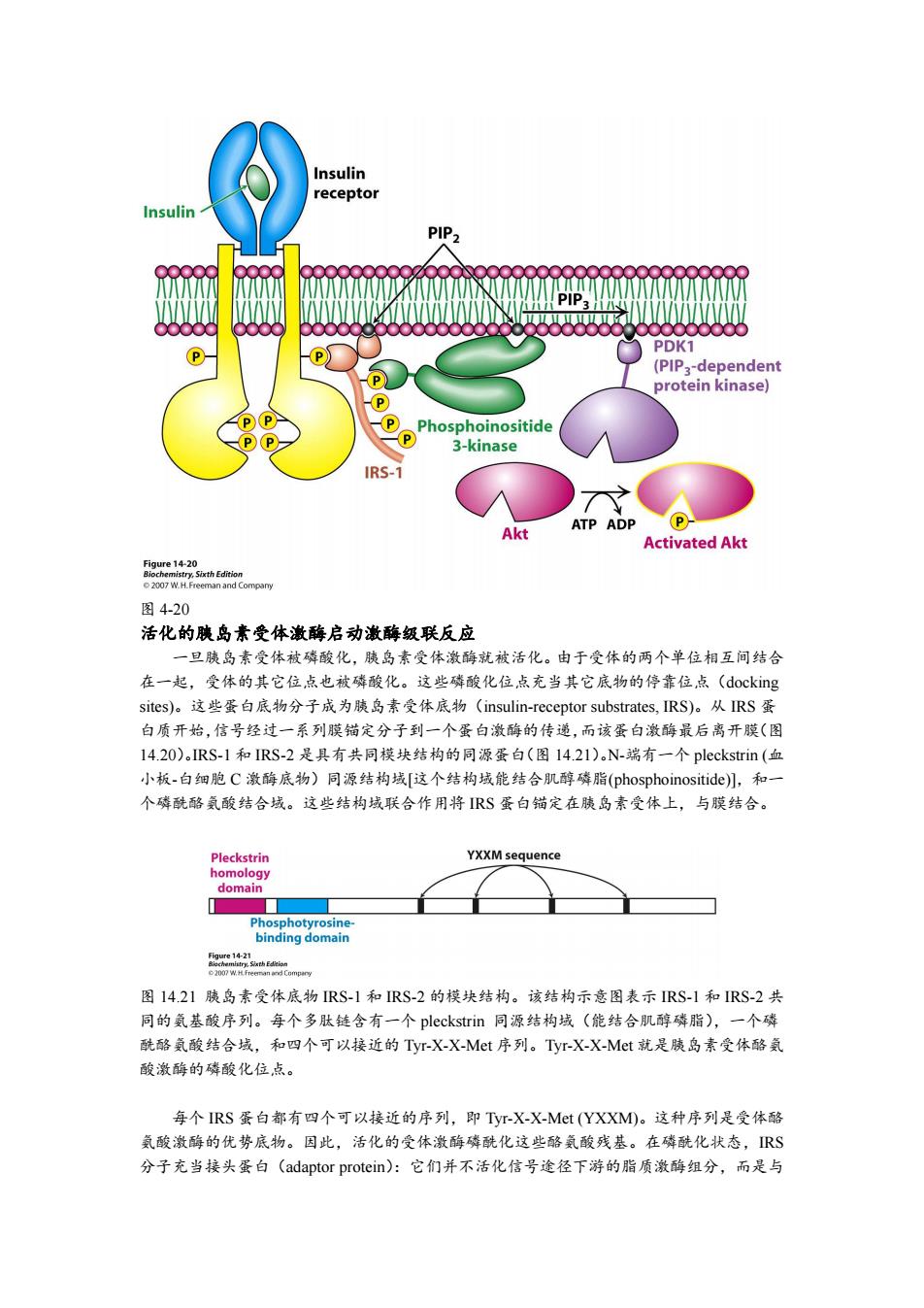
Insulin receptor Insulin PIP2 PDK1 (PIP3-dependent protein kinase) P P Phosphoinositide P 3-kinase IRS-1 ATP ADP Akt Activated Akt 58ecl420hEHnon 2007 W.H.Freeman and Company 图4-20 活化的胰岛素受体激酶启动激酶级联反应 一旦胰岛素受体被磷酸化,胰岛素受体激酶就被活化。由于受体的两个单位相互间结合 在一起,受体的其它位点也被磷酸化。这些磷酸化位点充当其它底物的停靠位点(docking sites))。这些蛋白底物分子成为胰岛素受体底物(insulin-receptor substrates,IRS)。从IRS蛋 白质开始,信号经过一系列膜锚定分子到一个蛋白激酶的传递,而该蛋白激酶最后离开膜(图 14.20)。RS-1和IRS-2是具有共同模块结构的同源蛋白(图14.21).N-端有一个pleckstrin(血 小板-白细胞C激酶底物)同源结构域[这个结构域能结合肌醇磷脂(phosphoinositide)儿,和一 个磷酰酪氨酸结合域。这些结构域联合作用将RS蛋白锚定在胰岛素受体上,与膜结合。 Pleckstrin YXXM sequence homology domain Phosphotyrosine- binding domain 图14.21胰岛素受体底物RS-1和IRS-2的模块结构。该结构示意图表示RS-1和IRS-2共 同的氨基酸序列。每个多肽链含有一个pleckstrin同源结构域(能结合肌醇磷脂),一个磷 酰酪氨酸结合域,和四个可以接近的Tyr-X-X-Mt序列。Tyr-X-X-Met就是胰岛素受体酪氨 酸激酶的磷酸化位,点。 每个IRS蛋白都有四个可以接近的序列,即Tyr-X-X-Mt(YXXM)。这种序列是受体酪 氨酸激酶的优势底物。因此,活化的受体激酶磷酰化这些酪氨酸残基。在磷酰化状态,RS 分子充当接头蛋白(adaptor protein):它们并不活化信号途径下游的脂质激酶组分,而是与图 4-20 活化的胰岛素受体激酶启动激酶级联反应 一旦胰岛素受体被磷酸化,胰岛素受体激酶就被活化。由于受体的两个单位相互间结合 在一起,受体的其它位点也被磷酸化。这些磷酸化位点充当其它底物的停靠位点(docking sites)。这些蛋白底物分子成为胰岛素受体底物(insulin-receptor substrates, IRS)。从 IRS 蛋 白质开始,信号经过一系列膜锚定分子到一个蛋白激酶的传递,而该蛋白激酶最后离开膜(图 14.20)。IRS-1 和 IRS-2 是具有共同模块结构的同源蛋白(图 14.21)。N-端有一个 pleckstrin (血 小板-白细胞 C 激酶底物)同源结构域[这个结构域能结合肌醇磷脂(phosphoinositide)],和一 个磷酰酪氨酸结合域。这些结构域联合作用将 IRS 蛋白锚定在胰岛素受体上,与膜结合。 图 14.21 胰岛素受体底物 IRS-1 和 IRS-2 的模块结构。该结构示意图表示 IRS-1 和 IRS-2 共 同的氨基酸序列。每个多肽链含有一个 pleckstrin 同源结构域(能结合肌醇磷脂),一个磷 酰酪氨酸结合域,和四个可以接近的 Tyr-X-X-Met 序列。Tyr-X-X-Met 就是胰岛素受体酪氨 酸激酶的磷酸化位点。 每个 IRS 蛋白都有四个可以接近的序列,即 Tyr-X-X-Met (YXXM)。这种序列是受体酪 氨酸激酶的优势底物。因此,活化的受体激酶磷酰化这些酪氨酸残基。在磷酰化状态,IRS 分子充当接头蛋白(adaptor protein):它们并不活化信号途径下游的脂质激酶组分,而是与