正在加载图片...
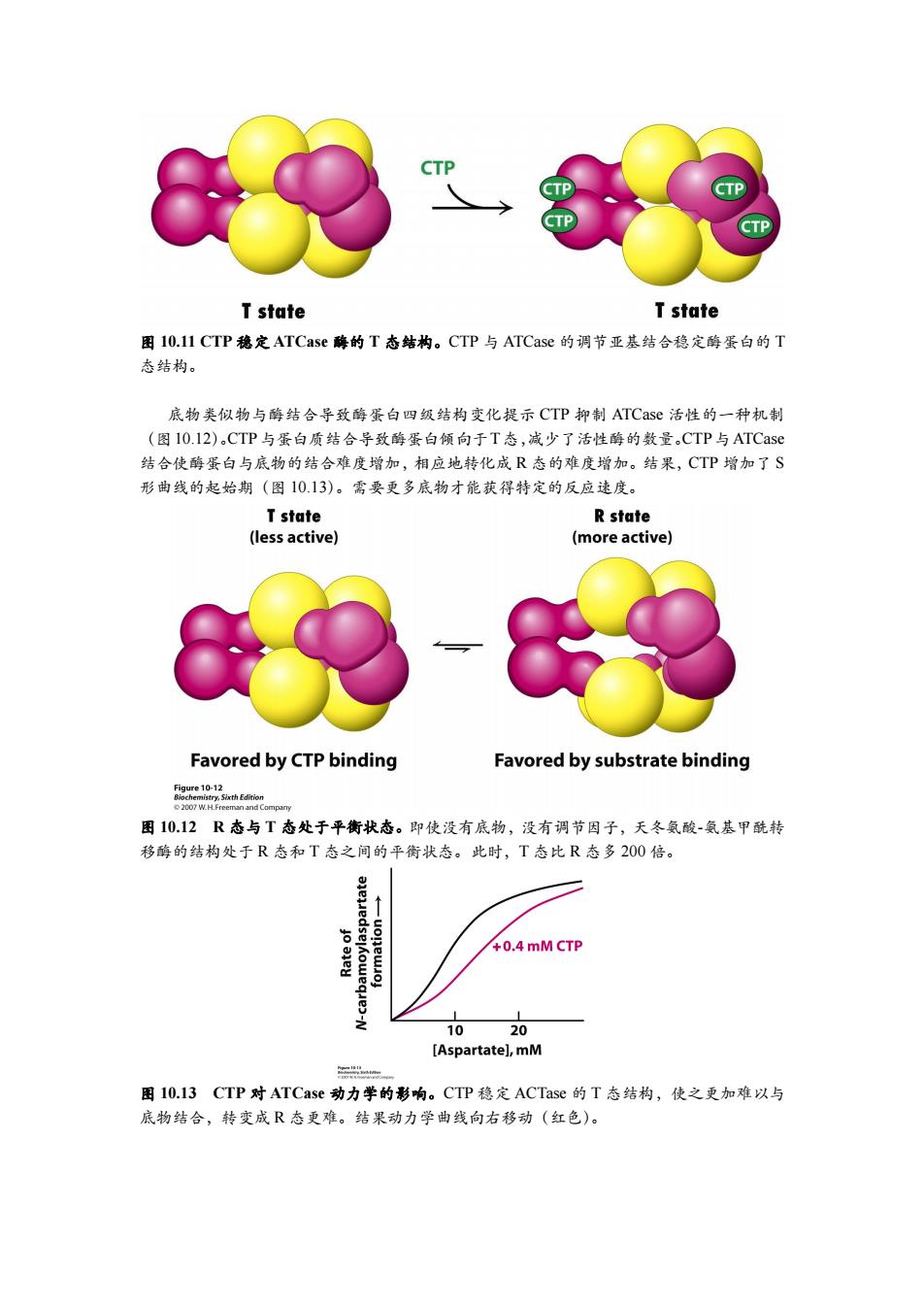
CTP CTP T state T state 图I0.11CTP稳定ATCase酶的T态结构。CTP与ATCase的调节亚基结合稳定酶蛋白的T 态结构。 底物类似物与酶结合导致酶蛋白四级结构变化提示CTP抑制ATCase活性的一种机制 (图10.12).CTP与蛋白质结合导致酶蛋白倾向于T态,减少了活性酶的数量CTP与ATCase 结合使酶蛋白与底物的结合难度增加,相应地转化成R态的难度增加。结果,CTP增加了S 形曲线的起始期(图10.13)。需要更多底物才能获得特定的反应速度。 T state R state (less active) (more active) Favored by CTP binding Favored by substrate binding fge10nhn 2007 W.H.Freeman and Company 图1012R态与T态处于平衡状态。即使没有底物,没有调节因子,天冬氨酸-氨基甲酰转 移酶的结构处于R态和T态之间的平衡状态。此时,T态比R态多200倍。 6 +0.4 mM CTP 1020 [Aspartate],mM 图10.l3CTP对ATCase动力学的彩响。CTP稳定ACTase的T态结构,使之更加难以与 底物结合,转变成R态更难。结果动力学曲线向右移动(红色)。图 10.11 CTP 稳定 ATCase 酶的 T 态结构。CTP 与 ATCase 的调节亚基结合稳定酶蛋白的 T 态结构。 底物类似物与酶结合导致酶蛋白四级结构变化提示 CTP 抑制 ATCase 活性的一种机制 (图10.12)。CTP与蛋白质结合导致酶蛋白倾向于T态,减少了活性酶的数量。CTP与ATCase 结合使酶蛋白与底物的结合难度增加,相应地转化成 R 态的难度增加。结果,CTP 增加了 S 形曲线的起始期(图 10.13)。需要更多底物才能获得特定的反应速度。 图 10.12 R 态与 T 态处于平衡状态。即使没有底物,没有调节因子,天冬氨酸-氨基甲酰转 移酶的结构处于 R 态和 T 态之间的平衡状态。此时,T 态比 R 态多 200 倍。 图 10.13 CTP 对 ATCase 动力学的影响。CTP 稳定 ACTase 的 T 态结构,使之更加难以与 底物结合,转变成 R 态更难。结果动力学曲线向右移动(红色)