正在加载图片...
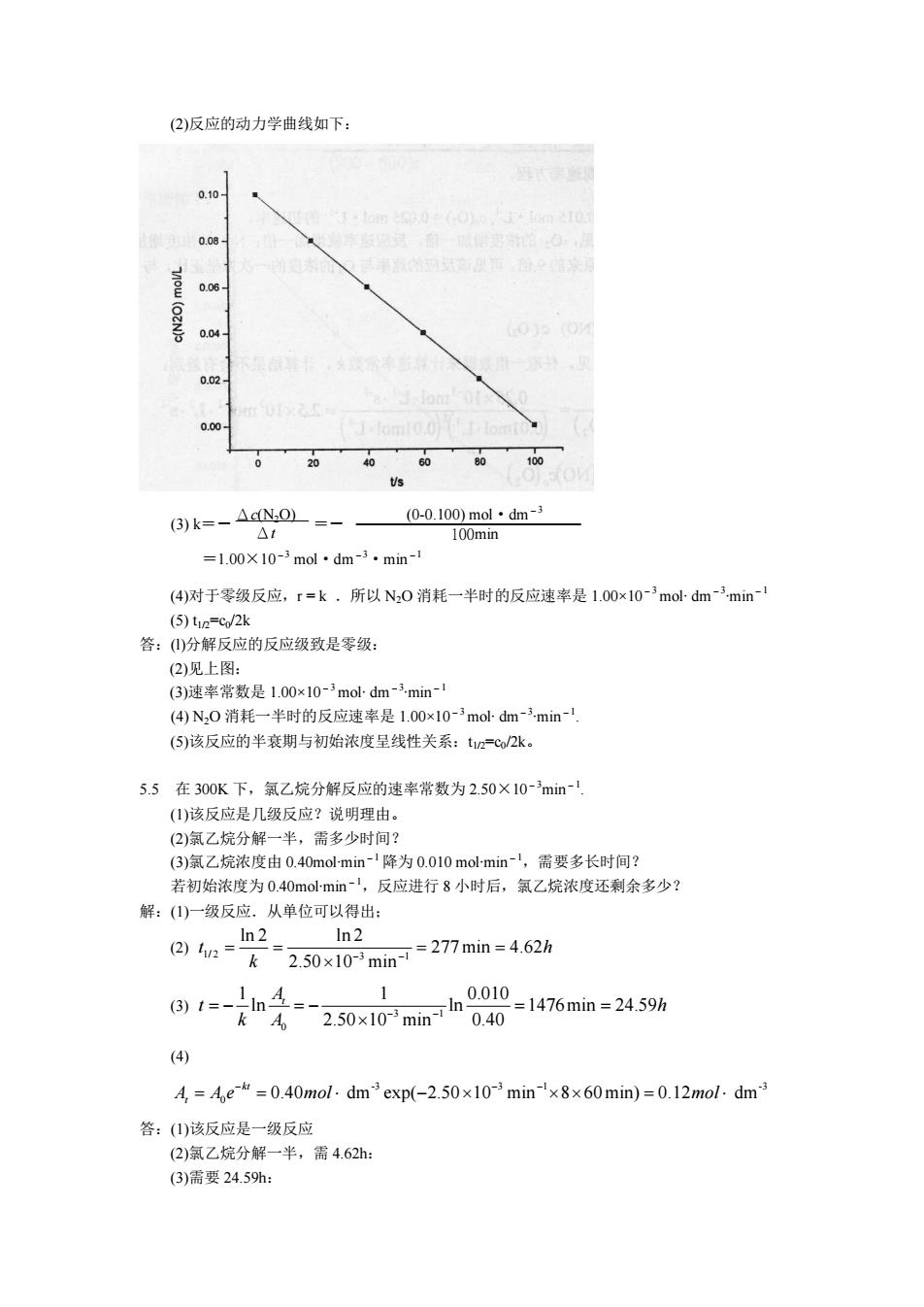
(2)反应的动力学曲线如下: 006 o4 002 0.00 0 (3)k=-△cN.0 0-0.100)mol·dm-3 100mn =1.00X 10-mol dm-3.min-1 (4)对于零级反应,r=k所以N,0消耗一半时的反应速率是1.00x10-mol-dm-min (5)t2c/2k 答:(分解反应的反应级致是零级: (2)见上图: (3)速率常数是100x10-3mo-dm-3min-1 (④N,0消耗一半时的反应速率是100x10-3modm-min (⑤)该反应的半衰期与初始浓度呈线性关系:t1=c/2k。 5.5在300K下,氯乙烷分解反应的速率常数为2.50×10-min- 1该反应是几级反应?说明理由」 (2)氣乙烷分解一半,需多少时间 (3)氯乙烷浓度由0.40m0l-min 降为0.010mol-min,需要多长时间 若初始浓度为0.40 mol-min-1,反应进行8小时后,氯乙烷浓度还剩余多少? 解:()一级反应.从单位可以得出: 2)a=ln2=250x10min=27min=4625 1 8,e_n年=产250x10rmin040=1476mn=2459% A 0.40 (4) =e=0.40mol.dm exp(-2.)=0.12mol.dm 答:(山)该反应是一级反应 (2)氯乙烷分解一半,需4.62h: (3)需要24.59h: (2)反应的动力学曲线如下: (3) k=- =- =1.00×10-3 mol·dm-3·min-1 (4)对于零级反应,r = k .所以 N2O 消耗一半时的反应速率是 1.00×10-3mol∙ dm-3 ∙min-1 (5) t1/2=c0/2k 答:(l)分解反应的反应级致是零级: (2)见上图: (3)速率常数是 1.00×10-3mol∙ dm-3 ∙min-1 (4) N2O 消耗一半时的反应速率是 1.00×10-3mol∙ dm -3 ∙min-1 . (5)该反应的半衰期与初始浓度呈线性关系:t1/2=c0/2k。 5.5 在 300K 下,氯乙烷分解反应的速率常数为 2.50×10-3min-1 . (1)该反应是几级反应?说明理由。 (2)氯乙烷分解一半,需多少时间? (3)氯乙烷浓度由 0.40mol∙min-1 降为 0.010 mol∙min-1,需要多长时间? 若初始浓度为 0.40mol∙min-1,反应进行 8 小时后,氯乙烷浓度还剩余多少? 解:(1)一级反应.从单位可以得出; (2) 1/ 2 3 1 ln 2 ln 2 277min 4.62 2.50 10 min t h k - - = = = = ¥ (3) 3 1 0 1 1 0.010 ln ln 1476min 24.59 2.50 10 min 0.40 At t h k A - - = - = - = = ¥ (4) 3 3 1 3 0 0.40 dm exp( 2.50 10 min 8 60min) 0.12 dm kt At A e mol mol - - - = = × - ¥ ¥ ¥ = × 答:(1)该反应是一级反应 (2)氯乙烷分解一半,需 4.62h: (3)需要 24.59h: Δc(N2O) Δt (00.100) mol·dm -3 100min