正在加载图片...
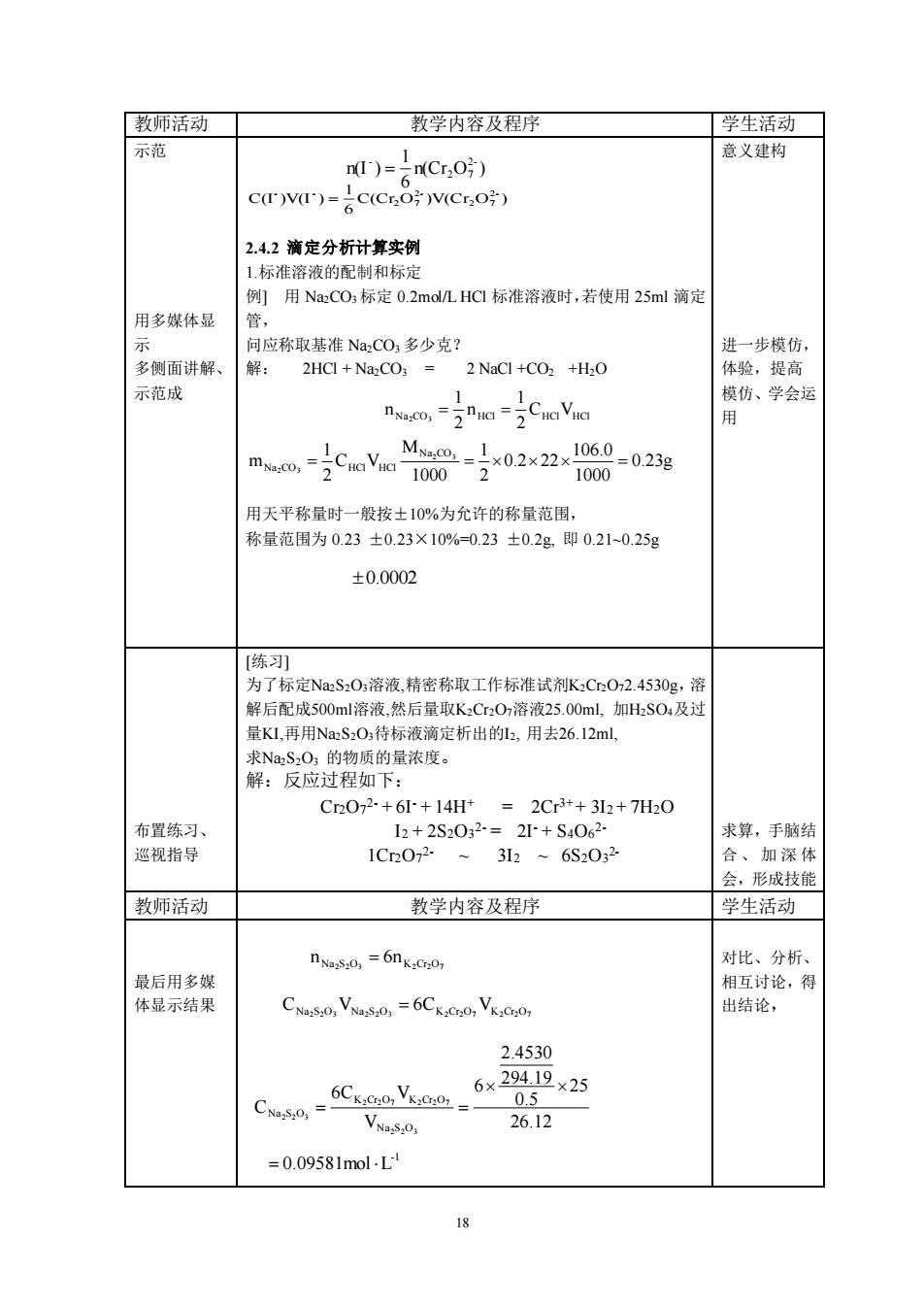
「教师活动丁 教学内容及程序 学生活动☐ 示范 n)=2C,0 意义建构 c)v)=c(COV(Cr 2.4.2滴定分析计算实例 1标准溶液的配制和标定 例]用Na:CO标定0.2 mol/L.HCl标准溶液时,若使用25ml滴定 用多媒体显 官, 问应称取基准NCO多少克? 进一步模仿, 多侧面讲解、 解: 2HCI+NazCO;2 NaCl +CO2 +H2O 体验,提高 示范成 模仿、学会运 用 1000 用天平称量时一般按+10%。为允许的称量范围 称量范围为0.23±0.23×10%-0.23±0.2g即0.210.25g ±0.0002 [练列 为了标定NaS20溶液,精密称取工作标准试剂K3CO2.4530g,溶 解后配成500ml溶液,然后量取K,Cr,0,溶液25.00ml,加HS0:及过 量K1,再用NaS2O5待标液滴定析出的2,用去26.12ml, 求Na,S,O1的物质的量浓度。 解:反应过程如下: C2072-+6+14H=2Cr3+32+7H30 布置练习、 12+2S2032=2+S4062 求算,手脑结 巡视指导 1C2072.~ 32~6S2032 合、加深体 会,形成技能 教师活动 教学内容及程序 学生活动 nas0,=6nK,00, 对比、分析 相互讨论,得 CNV=6CKCO,VKCo 出结论, 2.4530 CNa,= 6CK:0e0,Vx:e0」 6×29419×25 0.5 26.12 =0.09581mol-L18 教师活动 教学内容及程序 学生活动 示范 意义建构 用多媒体显 示 多侧面讲解、 示范成 2.4.2 滴定分析计算实例 1.标准溶液的配制和标定 例] 用 Na2CO3 标定 0.2mol/L HCl 标准溶液时,若使用 25ml 滴定 管, 问应称取基准 Na2CO3 多少克? 解: 2HCl + Na2CO3 = 2 NaCl +CO2 +H2O 用天平称量时一般按±10%为允许的称量范围, 称量范围为 0.23 ±0.23×10%=0.23 ±0.2g, 即 0.21~0.25g 进一步模仿, 体验,提高 模仿、学会运 用 布置练习、 巡视指导 [练习] 为了标定Na2S2O3溶液,精密称取工作标准试剂K2Cr2O72.4530g,溶 解后配成500ml溶液,然后量取K2Cr2O7溶液25.00ml, 加H2SO4及过 量KI,再用Na2S2O3待标液滴定析出的I2, 用去26.12ml, 求Na2S2O3 的物质的量浓度。 解:反应过程如下: Cr2O7 2- + 6I- + 14H+ = 2Cr3+ + 3I2 + 7H2O I2 + 2S2O3 2- = 2I- + S4O6 2- 1Cr2O7 2- ~ 3I2 ~ 6S2O3 2- 求算,手脑结 合、加深体 会,形成技能 教师活动 教学内容及程序 学生活动 最后用多媒 体显示结果 对比、分析、 相互讨论,得 出结论, n(Cr O ) 6 1 n(I ) 2- 2 7 - = C(Cr O )V(Cr O ) 6 1 C(I )V(I ) 2- 2 7 2- 2 7 - - = 0.23g 1000 106.0 0.2 22 2 1 1000 M C V 2 1 m 2 3 2 3 Na CO Na CO = HCl HCl = = Na CO HCl CHClVHCl 2 1 n 2 1 n 2 3 = = 0.0002 Na2S2O3 K2Cr2O7 n = 6n Na2S2O3 Na2S2O3 K2Cr2O7 K2Cr2O7 C V = 6C V 26.12 25 0.5 294.19 2.4530 6 V 6C V C 2 2 3 2 2 7 2 2 7 2 2 3 Na S O K Cr O K Cr O Na S O = = -1 = 0.09581mol L