正在加载图片...
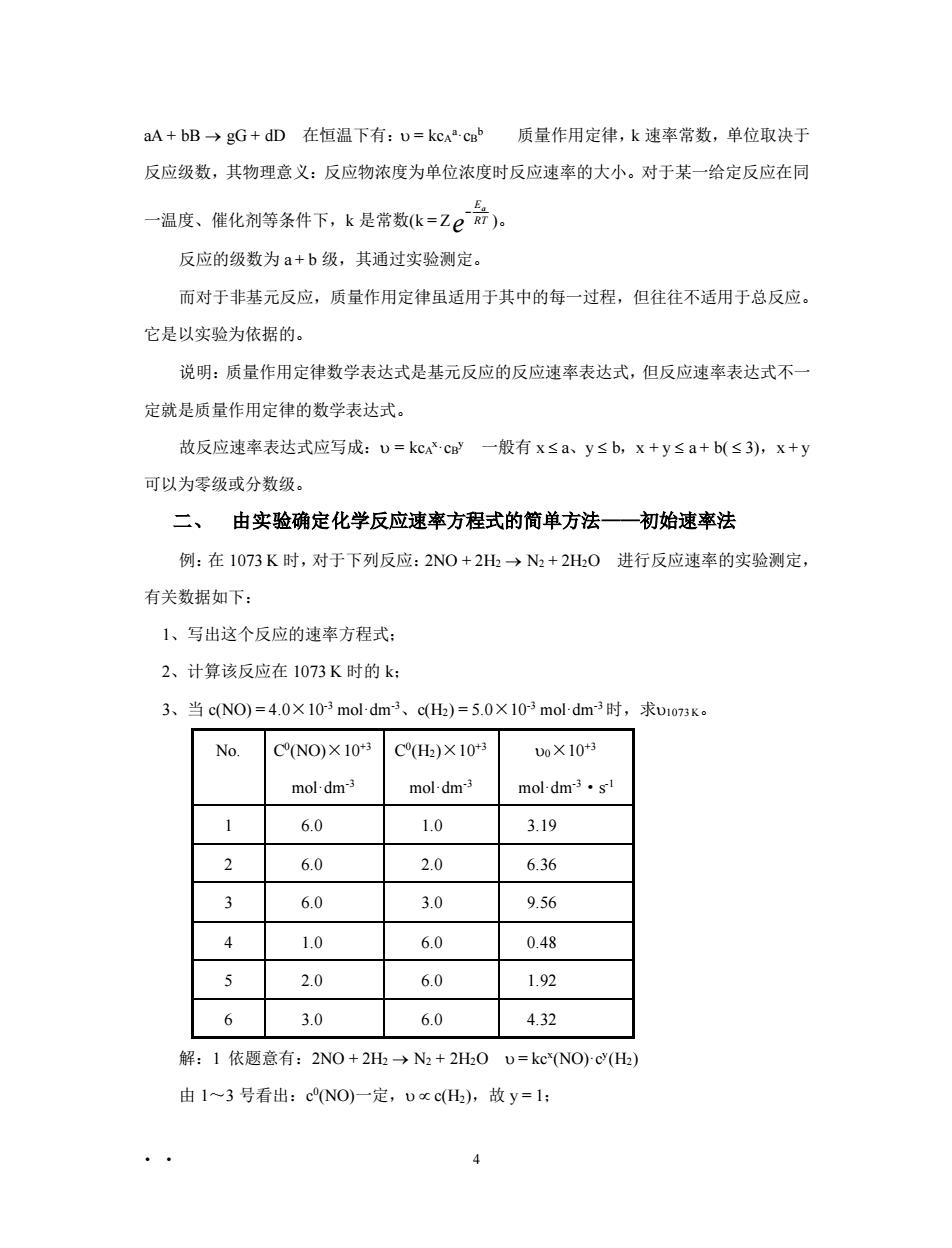
aA+bB→gG+dD在恒温下有:U=kcc质量作用定律,k速率常数,单位取决于 反应级数,其物理意义:反应物浓度为单位浓度时反应速率的大小。对于某一给定反应在同 一温度、催化剂等条件下,k是常数k=Ze:)。 反应的级数为a+b级,其通过实验测定。 而对于非基元反应,质量作用定律虽适用于其中的每一过程,但往往不适用于总反应。 它是以实验为依据的。 说明:质量作用定律数学表达式是基元反应的反应速率表达式,但反应速率表达式不一 定就是质量作用定律的数学表达式。 故反应速率表达式应写成:U=kcx.cB一般有x≤a、y≤b,x+y≤a+b(≤3),x+y 可以为零级或分数级。 二、由实验确定化学反应速率方程式的简单方法一初始速率法 例:在1073K时,对于下列反应:2N0+2H→N+2H0进行反应速率的实验测定, 有关数据如下: 1、写出这个反应的速率方程式: 2、计算该反应在1073K时的k 3、当cN0)=4.0×103 mol-dm3、cH)=5.0×103 moldm3时,求u1o73k。 No. CNO)×10 CH)×10 0X10+ mol-dm3 mol-dm3 mol-dm3.s 1 6.0 1.0 3.19 2 6.0 2.0 6.36 3 60 3.0 9.56 4 1.0 6.0 0.48 5 2.0 6.0 1.92 6 3.0 6.0 4.32 解:1依题意有:2NO+2H→N2+2H0D=kc*NOc(H) 由1~3号看出:cNO) 定,cH),故y=1: 4• • 4 aA + bB → gG + dD 在恒温下有: = kcA a·cB b 质量作用定律,k 速率常数,单位取决于 反应级数,其物理意义:反应物浓度为单位浓度时反应速率的大小。对于某一给定反应在同 一温度、催化剂等条件下,k 是常数(k = Z − E RT a e )。 反应的级数为 a + b 级,其通过实验测定。 而对于非基元反应,质量作用定律虽适用于其中的每一过程,但往往不适用于总反应。 它是以实验为依据的。 说明:质量作用定律数学表达式是基元反应的反应速率表达式,但反应速率表达式不一 定就是质量作用定律的数学表达式。 故反应速率表达式应写成: = kcA x·cB y 一般有 x a、y b,x + y a + b( 3),x + y 可以为零级或分数级。 二、 由实验确定化学反应速率方程式的简单方法——初始速率法 例:在 1073 K 时,对于下列反应:2NO + 2H2 → N2 + 2H2O 进行反应速率的实验测定, 有关数据如下: 1、写出这个反应的速率方程式; 2、计算该反应在 1073 K 时的 k; 3、当 c(NO) = 4.0×10-3 mol·dm-3、c(H2) = 5.0×10-3 mol·dm-3 时,求1073 K。 No. C 0 (NO)×10+3 mol·dm-3 C 0 (H2)×10+3 mol·dm-3 0×10+3 mol·dm-3·s -1 1 6.0 1.0 3.19 2 6.0 2.0 6.36 3 6.0 3.0 9.56 4 1.0 6.0 0.48 5 2.0 6.0 1.92 6 3.0 6.0 4.32 解:1 依题意有:2NO + 2H2 → N2 + 2H2O = kcx (NO)·cy (H2) 由 1~3 号看出:c 0 (NO)一定, c(H2),故 y = 1;