正在加载图片...
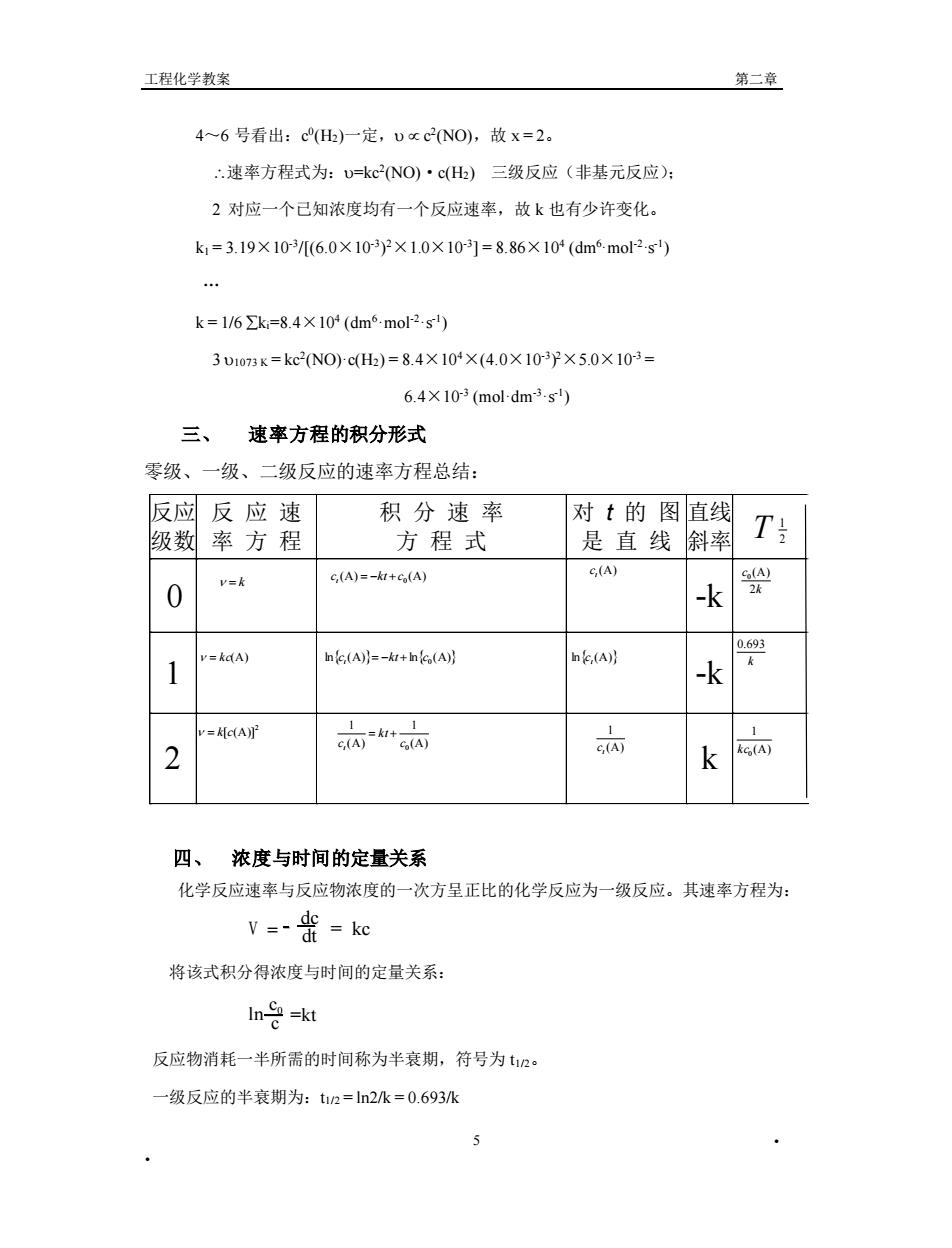
工程化学教案 第二章 4~6号看出:cH)一定,Uxc2N0,故x=2。 “速率方程式为:U=kcNO)·c()三级反应(非基元反应): 2对应一个已知浓度均有一个反应速率,故k也有少许变化。 k=3.19×103[(6.0×103y×1.0×10r3]=8.86×10(dm6mo2-s … k=1/6∑k=8.4×10(dm6-mol2s) 3U1073K=kc2NOcH)=8.4×10×(4.0×103y×5.0X103= 6.4×10r3(mol.dm3.s) 三、速率方程的积分形式 零级、一级、二级反应的速率方程总结: 反应反应速 积分速率 对t的图直线 级数率方程 方程式 是直线斜率 T c(A)=-k+5(A) C(A) 0 v= -k 尖 v=kdA) ne(A)}=-+n(A)月 h.(A)】 1 -k =kc(A 2 + 而 k 四、浓度与时间的定量关系 化学反应速率与反应物浓度的一次方呈正比的化学反应为一级反应。其速率方程为: V=-=ke 将该式积分得浓度与时间的定量关系: In o=kt 反应物消耗一半所需的时间称为半衰期,符号为t2。 一级反应的半衰期为:t2=ln2k=0.693/k 工程化学教案 第二章 • • 5 4~6 号看出:c 0 (H2)一定, c 2 (NO),故 x = 2。 速率方程式为:=kc2 (NO)·c(H2) 三级反应(非基元反应); 2 对应一个已知浓度均有一个反应速率,故 k 也有少许变化。 k1 = 3.19×10-3 /[(6.0×10-3 ) 2×1.0×10-3 ] = 8.86×104 (dm6·mol-2·s-1 ) … k = 1/6 ki=8.4×104 (dm6·mol-2·s-1 ) 3 1073 K = kc2 (NO)·c(H2) = 8.4×104×(4.0×10-3 ) 2×5.0×10-3 = 6.4×10-3 (mol·dm-3·s-1 ) 三、 速率方程的积分形式 零级、一级、二级反应的速率方程总结: 四、 浓度与时间的定量关系 化学反应速率与反应物浓度的一次方呈正比的化学反应为一级反应。其速率方程为: V = dc dt = kc 将该式积分得浓度与时间的定量关系: ln =kt c0 c 反应物消耗一半所需的时间称为半衰期,符号为 t1/2。 一级反应的半衰期为:t1/2 = ln2/k = 0.693/k 反应 级数 反 应 速 率 方 程 积 分 速 率 方 程 式 对 t 的 图 是 直 线 直线 斜率 T 0 -k 1 -k 2 k 2 1 = k = kc(A) 2 = k[c(A)] (A) 1 (A) 1 0 c kt ct = + (A) (A) 0 c kt c t = − + lnct(A)= −kt + lnc0 (A) (A) t c lnct(A) (A) 1 t c k c 2 (A) 0 k 0.693 (A) 1 0 kc