
工程化学教案 第二章 工程化学教案一第二章化学动力学基础 主讲教师:董文魁、许力、李静萍等 使用教材:许力等编著,《工程化学》,兰州大学出版社 授课对象:非化学类各专业学生
工程化学教案 第二章 • • 1 工程化学教案——第二章 化学动力学基础 主讲教师:董文魁、许力、李静萍等 使用教材:许力等编著,《工程化学》,兰州大学出版社 授课对象:非化学类各专业学生

第二章化学动力学基础(讲授时数:6学时) 一.学习目的和要求 1.掌握化学反应速率的概念。 2.掌握浓度对化学反应速率的影响。 3.掌握温度对化学反应速率的影响。 4.掌握反应速率理论。 5.掌握催化与催化作用 6.了解多相催化与酶催化作用。 二. 本章节重点、难点 化学反应速率的概念(平均速率与瞬时速率)、浓度对化学反应速率的影响、温度对化 学反应速率的影响、反应速率理论(碰撞理论与活化络合物理论)、催化与催化作用(催化 剂与催化作用)。 三.学时分配 1.掌握化学反应速率的概念(1学时)。 2.掌握浓度对化学反应速率的影响(1.5学时)。 3.掌握温度对化学反应速率的影响(1.5学时)。 4.掌握反应速率理论(1学时)。 5.掌握催化与催化作用(1学时)。 四.教学内容: 第一节化学反应速率的概念 化学动力学是研究化学反应速率和机理的学科。影响化学反应速率的因素可概括为三 类:一是反应物的本性,二是反应物的浓度和系统的温度,压力,催化剂等宏观量,三是光, 电,磁等外场。各种化学反应的速率极不相同,有些反应进行得很快,如爆炸反应:有些反 应进行得很慢,如常温下氢、氧混合几十年都不会生成一滴水。故对化学反应速率的研究极 其重要。一个很理想的化学反应,往往由于反应太慢而不能加以应用,这时我们就要集中力 2
• • 2 第二章 化学动力学基础(讲授时数: 6 学时) 一. 学习目的和要求 1. 掌握化学反应速率的概念。 2. 掌握浓度对化学反应速率的影响。 3. 掌握温度对化学反应速率的影响。 4. 掌握反应速率理论。 5. 掌握催化与催化作用。 6. 了解多相催化与酶催化作用。 二. 本章节重点、难点 化学反应速率的概念(平均速率与瞬时速率)、浓度对化学反应速率的影响、温度对化 学反应速率的影响、反应速率理论(碰撞理论与活化络合物理论)、催化与催化作用(催化 剂与催化作用)。 三. 学时分配 1. 掌握化学反应速率的概念(1 学时)。 2. 掌握浓度对化学反应速率的影响(1.5 学时)。 3. 掌握温度对化学反应速率的影响(1.5 学时)。 4. 掌握反应速率理论(1 学时)。 5. 掌握催化与催化作用(1 学时)。 四. 教学内容: 第一节 化学反应速率的概念 化学动力学是研究化学反应速率和机理的学科。影响化学反应速率的因素可概括为三 类:一是反应物的本性,二是反应物的浓度和系统的温度,压力,催化剂等宏观量,三是光, 电,磁等外场。各种化学反应的速率极不相同,有些反应进行得很快,如爆炸反应;有些反 应进行得很慢,如常温下氢、氧混合几十年都不会生成一滴水。故对化学反应速率的研究极 其重要。一个很理想的化学反应,往往由于反应太慢而不能加以应用,这时我们就要集中力

工程化学教案 第二章 量解决提高反应速率的问题:另一方面,对于那些危险甚大的化学变化,如橡胶的老化(变 脆、变硬)、金属的腐蚀等,总希望越慢越好,即有效地控制反应的快慢。 一、 化学反应的化学反应速率 反应速率是指给定条件下反应物通过化学反应转化为产物的速率,用单位时间单位体积 内发生的反应进度来表示。 V=1 den vB dt 用此定义反应速率的优点是其数值与研究反应中物质B的选择无关。 例如:反应2+3出=2NH其反应速率为: VΨ-a21c dt 3 dt 反应速率的SI单位为mol·dm3,s,时间单位也可用min、h、d、a(年)等表示。 注意:说化学反应速率时必须和相应化学反应方程式相联系。 二、平均和瞬时化学反应速率 通常用单位时间内反应物或生成物浓度的变化量来表示化学反应速率,简称反应速率。 通式恒容反应:aA+bB→gG+dD随着反应的进行,反应物浓度减少,生成物浓度 增加,而反应速率又无负值,故DA=-△CA△t、DG=△cG△t等等,即各物质的平均反应速率 均不相同,故以来描述一个整体反应的平均反应速率。D=-l/a△ca/△t=…=1d△cD△t 实际工作中是选择其浓度变化易于测定的那种物质。 对于大多数化学反应而言,反应开始后,各物质的浓度每时每刻都在变化着,即真实的 化学反应速率指在某一瞬间的反应速率,即瞬时反应速率,U=-l/adcA/dt==ld·dcpd。 第三节速率方程的积分形式 一、 化学反应速率方程式 化学反应速率方程有固定的形式,对于aA+bB→gG+dD,化学反应速率方程为: V=k·CCg 对于基元反应(一步完成或进行的反应,成为简并反应或简单反应,符合动力学的反应)
工程化学教案 第二章 • • 3 量解决提高反应速率的问题;另一方面,对于那些危险甚大的化学变化,如橡胶的老化(变 脆、变硬)、金属的腐蚀等,总希望越慢越好,即有效地控制反应的快慢。 一、 化学反应的化学反应速率 反应速率是指给定条件下反应物通过化学反应转化为产物的速率,用单位时间单位体积 内发生的反应进度来表示。 V = 1 dcB dt 用此定义反应速率的优点是其数值与研究反应中物质 B 的选择无关。 例如:反应 N2 +3 H2 = 2NH3 其反应速率为: V = 1 dc(NH3) dt 1 3 = dc(N2) dt = dc(H2) dt 反应速率的SI单位为 mol·dm-3·s -1, 时间单位也可用min、h、d、a(年)等表示。 注意:说化学反应速率时必须和相应化学反应方程式相联系。 二、 平均和瞬时化学反应速率 通常用单位时间内反应物或生成物浓度的变化量来表示化学反应速率,简称反应速率。 通式恒容反应:aA + bB → gG + dD 随着反应的进行,反应物浓度减少,生成物浓度 增加,而反应速率又无负值,故 A = -cA/t、 G = cG/t 等等,即各物质的平均反应速率 均不相同,故以来描述一个整体反应的平均反应速率。 = -1/a cA/t = … = 1/d cD/t 实际工作中是选择其浓度变化易于测定的那种物质。 对于大多数化学反应而言,反应开始后,各物质的浓度每时每刻都在变化着,即真实的 化学反应速率指在某一瞬间的反应速率,即瞬时反应速率, = -1/a dcA/dt = … = 1/d ·dcD/dt。 第三节 速率方程的积分形式 一、 化学反应速率方程式 化学反应速率方程有固定的形式,对于 aA + bB → gG + dD,化学反应速率方程为: V = k·CA x·CB y 对于基元反应(一步完成或进行的反应,成为简并反应或简单反应,符合动力学的反应)
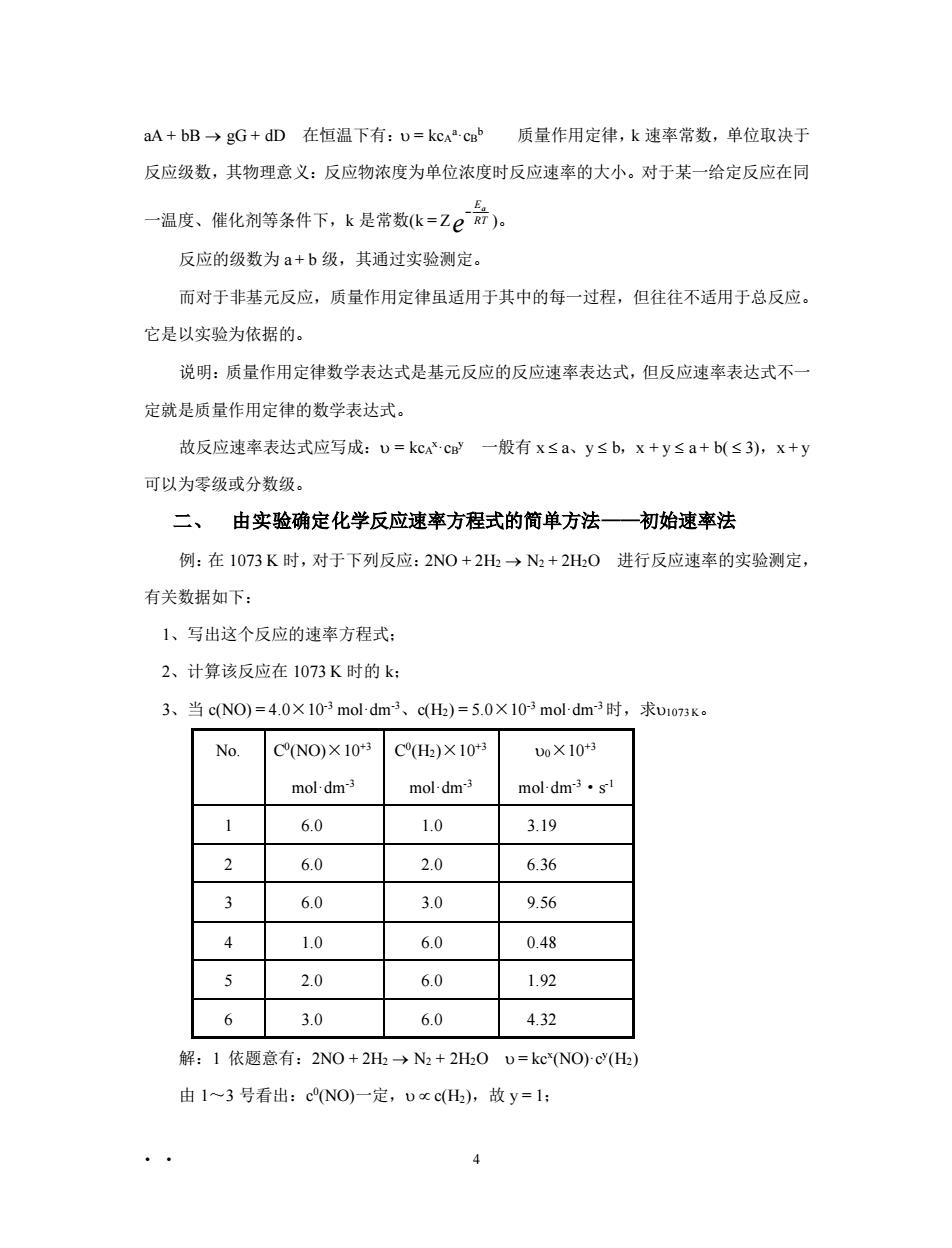
aA+bB→gG+dD在恒温下有:U=kcc质量作用定律,k速率常数,单位取决于 反应级数,其物理意义:反应物浓度为单位浓度时反应速率的大小。对于某一给定反应在同 一温度、催化剂等条件下,k是常数k=Ze:)。 反应的级数为a+b级,其通过实验测定。 而对于非基元反应,质量作用定律虽适用于其中的每一过程,但往往不适用于总反应。 它是以实验为依据的。 说明:质量作用定律数学表达式是基元反应的反应速率表达式,但反应速率表达式不一 定就是质量作用定律的数学表达式。 故反应速率表达式应写成:U=kcx.cB一般有x≤a、y≤b,x+y≤a+b(≤3),x+y 可以为零级或分数级。 二、由实验确定化学反应速率方程式的简单方法一初始速率法 例:在1073K时,对于下列反应:2N0+2H→N+2H0进行反应速率的实验测定, 有关数据如下: 1、写出这个反应的速率方程式: 2、计算该反应在1073K时的k 3、当cN0)=4.0×103 mol-dm3、cH)=5.0×103 moldm3时,求u1o73k。 No. CNO)×10 CH)×10 0X10+ mol-dm3 mol-dm3 mol-dm3.s 1 6.0 1.0 3.19 2 6.0 2.0 6.36 3 60 3.0 9.56 4 1.0 6.0 0.48 5 2.0 6.0 1.92 6 3.0 6.0 4.32 解:1依题意有:2NO+2H→N2+2H0D=kc*NOc(H) 由1~3号看出:cNO) 定,cH),故y=1: 4
• • 4 aA + bB → gG + dD 在恒温下有: = kcA a·cB b 质量作用定律,k 速率常数,单位取决于 反应级数,其物理意义:反应物浓度为单位浓度时反应速率的大小。对于某一给定反应在同 一温度、催化剂等条件下,k 是常数(k = Z − E RT a e )。 反应的级数为 a + b 级,其通过实验测定。 而对于非基元反应,质量作用定律虽适用于其中的每一过程,但往往不适用于总反应。 它是以实验为依据的。 说明:质量作用定律数学表达式是基元反应的反应速率表达式,但反应速率表达式不一 定就是质量作用定律的数学表达式。 故反应速率表达式应写成: = kcA x·cB y 一般有 x a、y b,x + y a + b( 3),x + y 可以为零级或分数级。 二、 由实验确定化学反应速率方程式的简单方法——初始速率法 例:在 1073 K 时,对于下列反应:2NO + 2H2 → N2 + 2H2O 进行反应速率的实验测定, 有关数据如下: 1、写出这个反应的速率方程式; 2、计算该反应在 1073 K 时的 k; 3、当 c(NO) = 4.0×10-3 mol·dm-3、c(H2) = 5.0×10-3 mol·dm-3 时,求1073 K。 No. C 0 (NO)×10+3 mol·dm-3 C 0 (H2)×10+3 mol·dm-3 0×10+3 mol·dm-3·s -1 1 6.0 1.0 3.19 2 6.0 2.0 6.36 3 6.0 3.0 9.56 4 1.0 6.0 0.48 5 2.0 6.0 1.92 6 3.0 6.0 4.32 解:1 依题意有:2NO + 2H2 → N2 + 2H2O = kcx (NO)·cy (H2) 由 1~3 号看出:c 0 (NO)一定, c(H2),故 y = 1;
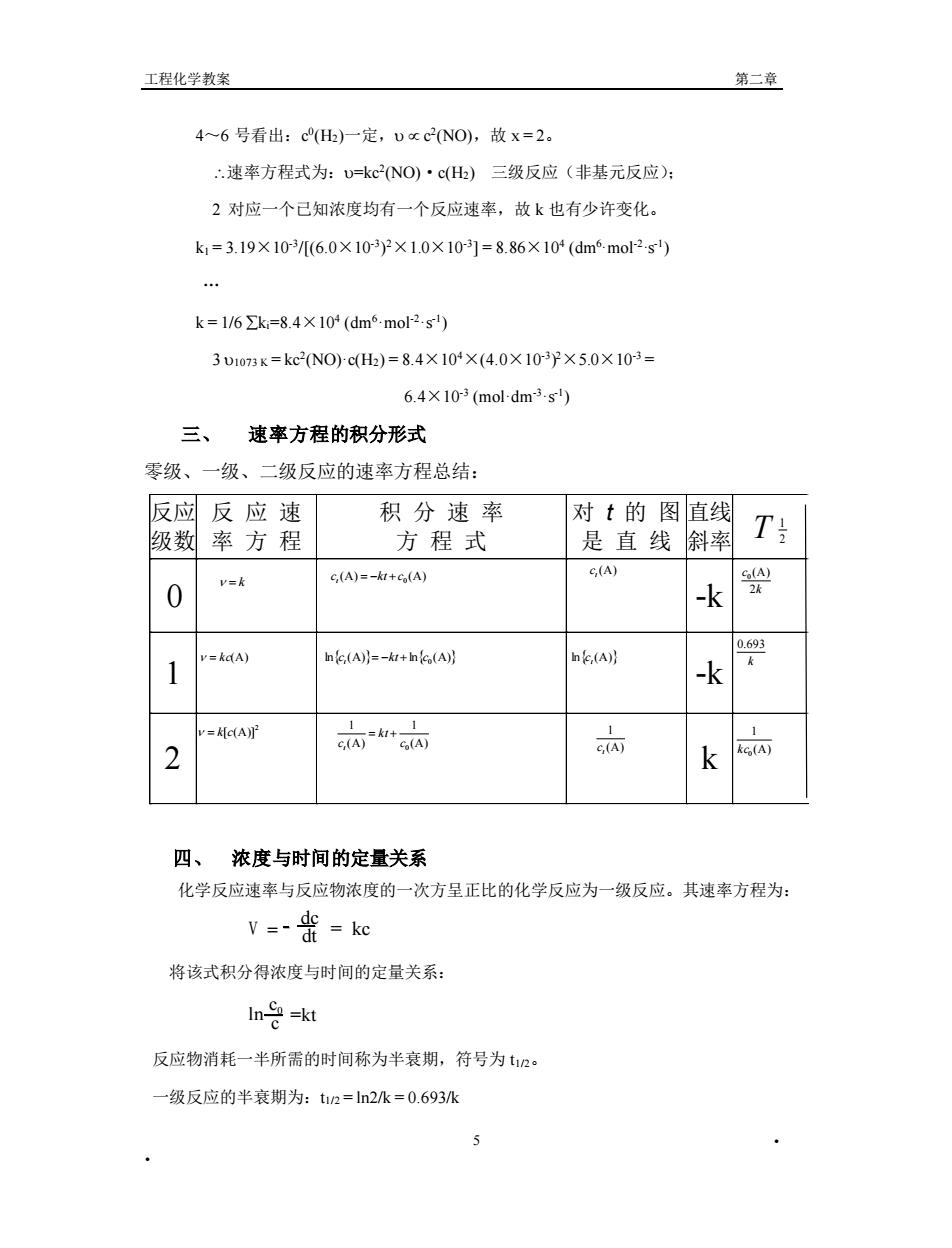
工程化学教案 第二章 4~6号看出:cH)一定,Uxc2N0,故x=2。 “速率方程式为:U=kcNO)·c()三级反应(非基元反应): 2对应一个已知浓度均有一个反应速率,故k也有少许变化。 k=3.19×103[(6.0×103y×1.0×10r3]=8.86×10(dm6mo2-s … k=1/6∑k=8.4×10(dm6-mol2s) 3U1073K=kc2NOcH)=8.4×10×(4.0×103y×5.0X103= 6.4×10r3(mol.dm3.s) 三、速率方程的积分形式 零级、一级、二级反应的速率方程总结: 反应反应速 积分速率 对t的图直线 级数率方程 方程式 是直线斜率 T c(A)=-k+5(A) C(A) 0 v= -k 尖 v=kdA) ne(A)}=-+n(A)月 h.(A)】 1 -k =kc(A 2 + 而 k 四、浓度与时间的定量关系 化学反应速率与反应物浓度的一次方呈正比的化学反应为一级反应。其速率方程为: V=-=ke 将该式积分得浓度与时间的定量关系: In o=kt 反应物消耗一半所需的时间称为半衰期,符号为t2。 一级反应的半衰期为:t2=ln2k=0.693/k
工程化学教案 第二章 • • 5 4~6 号看出:c 0 (H2)一定, c 2 (NO),故 x = 2。 速率方程式为:=kc2 (NO)·c(H2) 三级反应(非基元反应); 2 对应一个已知浓度均有一个反应速率,故 k 也有少许变化。 k1 = 3.19×10-3 /[(6.0×10-3 ) 2×1.0×10-3 ] = 8.86×104 (dm6·mol-2·s-1 ) … k = 1/6 ki=8.4×104 (dm6·mol-2·s-1 ) 3 1073 K = kc2 (NO)·c(H2) = 8.4×104×(4.0×10-3 ) 2×5.0×10-3 = 6.4×10-3 (mol·dm-3·s-1 ) 三、 速率方程的积分形式 零级、一级、二级反应的速率方程总结: 四、 浓度与时间的定量关系 化学反应速率与反应物浓度的一次方呈正比的化学反应为一级反应。其速率方程为: V = dc dt = kc 将该式积分得浓度与时间的定量关系: ln =kt c0 c 反应物消耗一半所需的时间称为半衰期,符号为 t1/2。 一级反应的半衰期为:t1/2 = ln2/k = 0.693/k 反应 级数 反 应 速 率 方 程 积 分 速 率 方 程 式 对 t 的 图 是 直 线 直线 斜率 T 0 -k 1 -k 2 k 2 1 = k = kc(A) 2 = k[c(A)] (A) 1 (A) 1 0 c kt ct = + (A) (A) 0 c kt c t = − + lnct(A)= −kt + lnc0 (A) (A) t c lnct(A) (A) 1 t c k c 2 (A) 0 k 0.693 (A) 1 0 kc

一级反应的三个特征: (1)ln{c对t作图得一直线(斜率为-k) (2)半衰期t2与反应的起始浓度无关。(当温度一定时,tn是与k成反比的一个常数) (3)速奉常数k具有(时间)的量纲(其SI单位为s) 第四节温度对化学反应速率的影响一Arrhenius方程式 一、 Arrhenius方程式 一般:T上升,kE、k芝、bE、U均上升。一般有:U410/UT=k10/k灯=V=2~4温度 系数v。 例:如果温度每升高10K,反应速率增大一倍(v=2~4)。在55℃时,反应速率比25℃ 快多少?100℃时又比25℃快多少? 解:当浓度不变时,U(T)/u(T)=kT2)/k(T)=TI0(经验公式) 准确为(T)/(T)=k(T)/k(T)=aI0T1T D5025=25-2510=23=8(f倍)、U100025=210-2910=275=181(f倍) 1889年,阿仑尼乌斯提出了反应速度常数与温度间关系式: k=A e RT hknA-导 lgk=lgA-2303RT Ea 1 ‘230s-lge) 其中,A:总碰撞频率因子(为常数) Ea:活化能 K:反应速度常数 R:气体常数 若时,速度常数K1,T2时为K2,则: 1gK,=lgA-2303R7 E。 相减得: 1gK=lg4-2303R7 E 6
• • 6 一级反应的三个特征: (1) ln{c}对 t 作图得一直线(斜率为-k) (2)半衰期 t1/2 与反应的起始浓度无关。(当温度一定时,t1/2 是与 k 成反比的一个常数) (3) 速率常数 k 具有(时间)-1 的量纲(其 SI 单位为 s -1) 第四节 温度对化学反应速率的影响——Arrhenius 方程式 一、 Arrhenius 方程式 一般:T 上升,k 正、k 逆、正、逆均上升。一般有:T+10 / T = kT+10 / kT = = 2~4 温度 系数。 例:如果温度每升高 10 K,反应速率增大一倍( = 2~4)。在 55℃时,反应速率比 25℃ 快多少?100℃时又比 25℃快多少? 解:当浓度不变时,(T2) / (T1) = k(T2) / k(T1) = T/10(经验公式) 准确为(T2) / (T1) = k(T2) / k(T1) = (T/10)(T1 +10/T2 ) 55 /25 = 2 (55-25) /10 = 2 3 = 8(倍)、100 /25 = 2 (100-25) /10 = 2 7.5 = 181(倍) 1889 年,阿仑尼乌斯提出了反应速度常数与温度间关系式: k=A e Ea -RT lnk=lnA Ea RT − − lgk=lgA Ea 2.303RT ( 1 lg 2.303 = e ) 其中,A:总碰撞频率因子(为常数) Ea:活化能 K:反应速度常数 R:气体常数 若 T1 时,速度常数 K1 ,T2 时为 K2 ,则: 2 1 lg lg 2.303 lg lg 2.303 a a E K A RT E K A RT = − = − 相减得:

工程化学教案 第二章 袋=-20石7引20a石】 E。11)E。T,-T K 二、 Arrhenius方程式的应用 例:1)已知某反应的Ea,可利用阿仑尼乌斯公式求不同温度下的k。 例:k=0.75L·mol-1·S-,计算700K时的k。 解:T2=700K,T1=600K, k=? k1=0.75 1.14×103(700-600) e05=2308314012 k=20(L·mol1·S-l) 例:2)知不同温度下的k,可计算反应的活化能Ea。 另外,从阿氏公式可得:)温度一定时,Ea下降,V增大;)不同的反应 活化能不同,升高同样的温度,活化能大的反应速度增加的幅度大。这两个结论并不矛盾, 都可以从阿尼乌斯公式上得以解释。 第五节反应速率理论 一、 碰撞理论 氢气和氧气在空气中反应得很慢,当一经点燃(600℃以上)或用铂绒催化,即以爆炸 形式完成反应,说明了反应速奉除与反应本质外,尚与一些外界因素有关。由此提出了种种 理论,较为流行的有“碰撞理论”和活化络合物理论”。 1889年,瑞典阿累尼乌斯(S.Arrhenius)提出碰撞理论:A、反应是通过反应物分子间 的碰撞实现的,故反应速度正比于碰撞频率,即反应是通过反应物分子彼此碰撞而进行的 B、绝大多数的碰撞是无效的弹性碰撞,并不是每一次碰撞都能发生反应。只有那些能量超 过某一能值的分子(叫活化分子)之间的碰撞一一有效碰撞才能导致反应,其它分子间 的碰撞都是无效的,只有少数能反应的碰撞成为有效碰撞:C、发生有效碰撞的反应物分子 一活化分子。活化分子百分数增加,有效碰撞增加,化学反应速率增加。D、活化能为活化 分子平均能量与反应物分子的平均能量之差,它表示一摩尔具有平均能量的反应物分子成为
工程化学教案 第二章 • • 7 2 2 1 1 2 1 1 2 1 1 lg 2.303 2.303 K T T E E a a K R T T R TT − = − = − 二、 Arrhenius 方程式的应用 例:1)已知某反应的 Ea ,可利用阿仑尼乌斯公式求不同温度下的 k 。 例:k = 0.75 L·mol -1·S –1 ,计算 700K 时的 k 。 解:T2 = 700K ,T1 = 600K, k2 = ? k1 =0.75 ( ) ( ) 5 2 1.14 10 700 600 lg 1.42 0.75 2.303 8.314 700 600 k − = = − k2 = 20 (L·mol -1·S –1) 例:2)知不同温度下的 k ,可计算反应的活化能 Ea 。 另外,从阿氏公式可得:i)温度一定时,Ea 下降 ,V 增大 ;ii)不同的反应 活化能不同,升高同样的温度,活化能大的反应速度增加的幅度大。这两个结论并不矛盾, 都可以从阿尼乌斯公式上得以解释。 第五节 反应速率理论 一、 碰撞理论 氢气和氧气在空气中反应得很慢,当一经点燃(600℃以上)或用铂绒催化,即以爆炸 形式完成反应,说明了反应速率除与反应本质外,尚与一些外界因素有关。由此提出了种种 理论,较为流行的有“碰撞理论”和“活化络合物理论”。 1889 年,瑞典阿累尼乌斯(S.Arrhenius)提出碰撞理论:A、反应是通过反应物分子间 的碰撞实现的,故反应速度正比于碰撞频率,即反应是通过反应物分子彼此碰撞而进行的; B、绝大多数的碰撞是无效的弹性碰撞,并不是每一次碰撞都能发生反应。只有那些能量超 过某一能值 E ※ 的分子(叫活化分子)之间的碰撞——有效碰撞才能导致反应,其它分子间 的碰撞都是无效的,只有少数能反应的碰撞成为有效碰撞;C、发生有效碰撞的反应物分子 --活化分子。活化分子百分数增加,有效碰撞增加,化学反应速率增加。D、活化能为活化 分子平均能量与反应物分子的平均能量之差,它表示一摩尔具有平均能量的反应物分子成为

活化分子所吸收的最低能量。即E,=E·EE,>0:B,增大,心减小,k=Z是在阿 氏公式中,一般反应E在60到250mo之间,当E420mo,速率很小。碰撞理论较好地解释了有效碰撞,但它不能说明反应历程 及其能量的变化。 二、过度状态(活化络(配)合物)理论 活化络合物理论认为:反应物分子在碰撞后先形成一种活化配合物,然后再分解为产物。如 →NO+CO 反应物 产物 0-N0C-0 活化配合物 △H=-E+EE,若EE>Ea是,则反应为吸热始态 终态 在可逆反应中,吸热反应的活化能大于放热反应的活化能(k量=乙府)。活化能就是 反应物变成产物的能量障碍。 活化络合物理论也叫过渡状态理论要点,活化络合也叫过渡状态。下图表示了在反应过 程中的能量关系 始态 反应过程 当具有足够能量的分子彼此接近到一定程度的时候,相互发生影响而活化。体系的势能 将发生变化,价键也随之发生重排。在此过程中须经过一个过渡状态,处于过渡状态的体系 称为活化络合物,活化络合物分子与反应物分子各自平均能量差称为活化能,活化络合物的 分解速率就是反应速率。 三、活化能与反应速率
• • 8 活化分子所吸收的最低能量。即 Ea = E * - E (Ea > 0);Ea增大,减小,k = Z − E RT a e 在阿 氏公式中,一般反应 Ea在 60 到 250 kJ·mol-1 之间,当 Ea 420 kJ·mol-1,速率很小。碰撞理论较好地解释了有效碰撞,但它不能说明反应历程 及其能量的变化。 二、 过度状态(活化络(配)合物)理论 活化络合物理论认为:反应物分子在碰撞后先形成一种活化配合物,然后再分解为产物。如 NO + CO → NO + CO E [ONOCO] 反应物 产物 O-N…O…C-O Ea,正 Ea,逆 活化配合物 H = -Ea,逆+Ea,正,若 Ea,正 > Ea,逆,则反应为吸热 始态 终态 在可逆反应中,吸热反应的活化能大于放热反应的活化能(k 逆 = Z − E RT a e )。活化能就是 反应物变成产物的能量障碍。 活化络合物理论也叫过渡状态理论要点,活化络合也叫过渡状态。下图表示了在反应过 程中的能量关系 反应过程 E E E ≠ I II II I Ea(正) Ea(逆) 始态 终态 过渡态 E 当具有足够能量的分子彼此接近到一定程度的时候,相互发生影响而活化。体系的势能 将发生变化,价键也随之发生重排。在此过程中须经过一个过渡状态,处于过渡状态的体系 称为活化络合物,活化络合物分子与反应物分子各自平均能量差称为活化能,活化络合物的 分解速率就是反应速率。 三、 活化能与反应速率

工程化学教案 第二意 将前面叙述的进行总结:在碰撞理论中,活化能为活化分子平均能量与反应物分子的平均能 量之差。在活化络合物理论中,活化能是活化络物的能反应物或生成物的能量的差。所以有: (1)增加反应物的浓度,化学反应速率增加 (2)增加温度化学反应速率增加。 (3)降低活化能化反应速率增加。 第六节催化作用的通性 一、催化剂与催化作用的基本征 催化剂是一种积极参与反应,改变反应速度,但在反应前后其组成、性质及数量基本不 变的物质。催化剂对反应速度所起的作用称为催化作用,包括正催化(加快速度)和负催化 (减慢速度),一般指正催化。催化剂及其作用机理催化剂及其作用机理如下: 催化剂之所以能显著加快反应速率是因为催化剂能与反应物生成不稳定的中间化合物, 改变了原来的反应历程,为反应提供了一条能垒较低的反应途径,从而降低了反应的活化能, 加快反应速度。加入催化剂能改变反应途径,降低反应的活化能,从而使大大提高。如图 所示,有无催化剂的反应前后状态一致,显然E<E,这样在催化剂的存在下,增加了活 化分子的百分数,并能显著地增加反应速率。改变反应历程是催化剂的主要作用。 未加催化剂Ea 加催化剂Ea(Ea<Ea) 反应物 生成物 催化剂的主要特性 (1)能改变反应途径,降低活化能,使反应速率显著增大。 (2)催化剂只能加速热力学上认为可以发生(即△G<0)的反应,对于不能发生 (△G0)的反应,使用任何催化剂都是徒芳的。 (3)催化剂能加快反应速度,但不能使平衡移动。因为它同时加速正、逆反应速度。 9
工程化学教案 第二章 • • 9 将前面叙述的进行总结:在碰撞理论中,活化能为活化分子平均能量与反应物分子的平均能 量之差。在活化络合物理论中,活化能是活化络物的能反应物或生成物的能量的差。所以有: (1)增加反应物的浓度,化学反应速率增加。 (2)增加温度化学反应速率增加。 (3)降低活化能化反应速率增加。 第六节 催化作用的通性 一、 催化剂与催化作用的基本征 催化剂是一种积极参与反应,改变反应速度,但在反应前后其组成、性质及数量基本不 变的物质。催化剂对反应速度所起的作用称为催化作用,包括正催化(加快速度)和负催化 (减慢速度),一般指正催化。催化剂及其作用机理催化剂及其作用机理如下: 催化剂之所以能显著加快反应速率是因为催化剂能与反应物生成不稳定的中间化合物, 改变了原来的反应历程,为反应提供了一条能垒较低的反应途径,从而降低了反应的活化能, 加快反应速度。加入催化剂能改变反应途径,降低反应的活化能,从而使大大提高。如图 所示,有无催化剂的反应前后状态一致,显然 Ea ’0)的反应,使用任何催化剂都是徒劳的。 (3) 催化剂能加快反应速度,但不能使平衡移动。因为它同时加速正、逆反应速度

(4)有特殊的选择性,一种催化剂只能加速一种或少数几种特定类型的反应。 (5)催化剂对少量的杂质特敏感,这种杂质可能为助催化剂,也可能是催化剂毒物。 二、酶催化 酶是动植物和微生物产生的具有高效催化性能的蛋白质,其相对分子质量在104106 之间(大小属于胶体范围)。酶催化的特点: (1)a高度选择性 (2)高度催化活性 (4)特殊的温度效应 (5)反应条件温和 思考题:P70,1、2、3、4、5、6、7、8、9、10 习题:P19, 一、选择题:1、2、3、4、5、6、7、8、9、10、11、12、13、14 填空题:1、2、3、4、5、6、7、8、9、10、11、12 三、 判断题:1、2、3、4、5、6、7、8、9、10 四、计算题:1、2、3、4、5、6、7、8、9、10、11、12 10
• • 10 (4)有特殊的选择性,一种催化剂只能加速一种或少数几种特定类型的反应。 (5)催化剂对少量的杂质特敏感,这种杂质可能为助催化剂,也可能是催化剂毒物。 二、 酶催化 酶是动植物和微生物产生的具有高效催化性能的蛋白质,其相对分子质量在 104---106 之间(大小属于胶体范围)。 酶催化的特点: (1)a 高度选择性 (2)高度催化活性 (4)特殊的温度效应 (5)反应条件温和 思考题:P70,1、2、3、4、5、6、7、8、9、10 习题:P19, 一、 选择题: 1、2、3、4、5、6、7、8、9、10、11、12、13、14 二、 填空题: 1、2、3、4、5、6、7、8、9、10、11、12 三、 判断题: 1、2、3、4、5、6、7、8、9、10 四、 计算题: 1、2、3、4、5、6、7、8、9、10、11、12