正在加载图片...
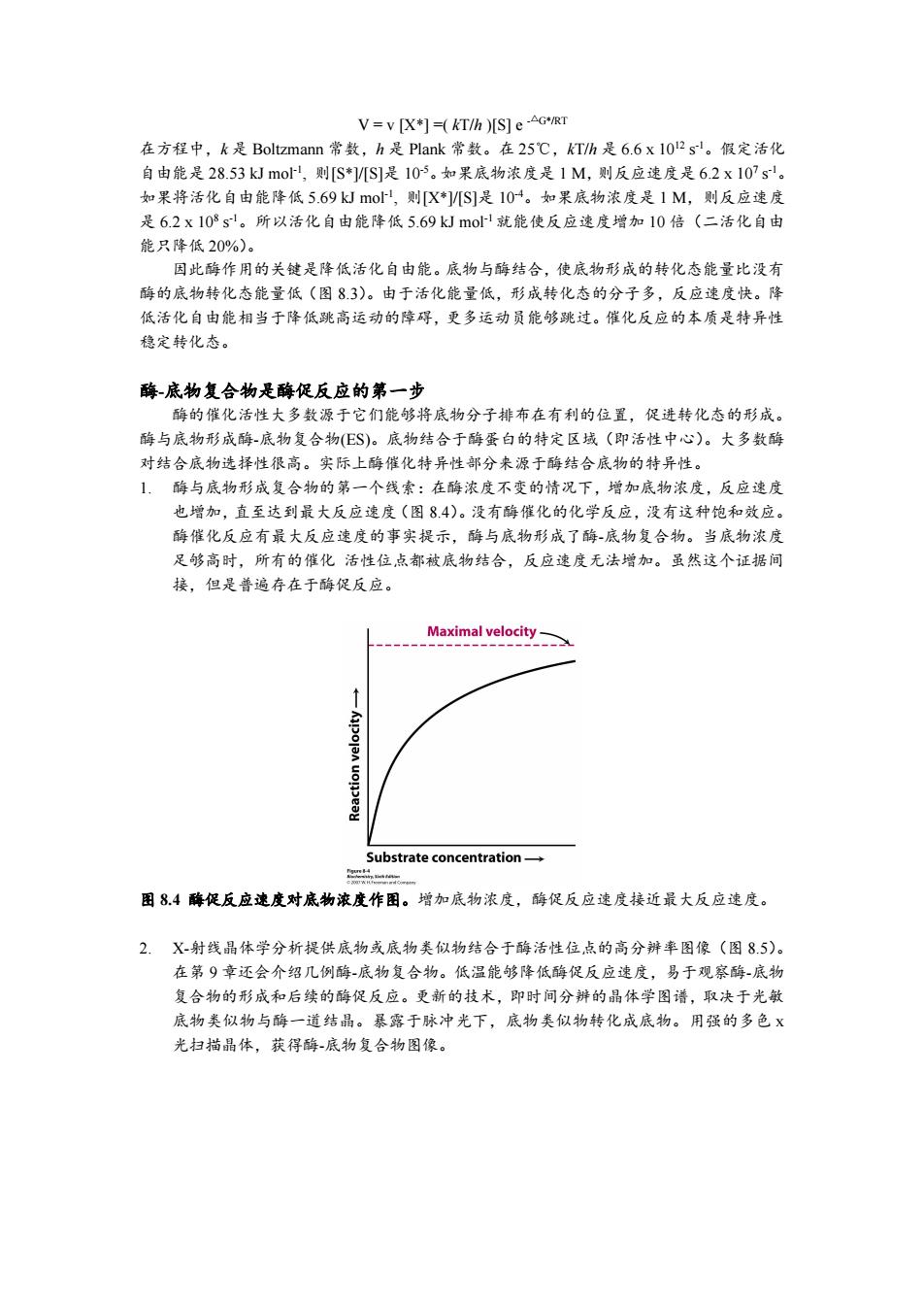
V=v [X+]=(KT/h )[s]e-AG*/RT 在方程中,k是Boltzmann常数,h是Plank常数。在25℃,kT/h是6.6x1012sl。假定活化 自由能是28.53kJmo,则[S*]/[S]是105。如果底物浓度是1M,则反应速度是6.2x107s'。 如果将活化自由能降低5.69kmo,则[X*/[S]是104。如果底物浓度是1M,则反应速度 是6.2x108s。所以活化自由能降低5.69 kJ mol-1就能使反应速度增加10倍(二活化自由 能只降低20%)。 因此酶作用的关键是降低活化自由能。底物与酶结合,使底物形成的转化态能量比没有 酶的底物转化态能量低(图83)。由于活化能量低,形成转化态的分子多,反应速度快。降 低活化自由能相当于降低跳高运动的障碍,更多运动员能够跳过。催化反应的本质是特异性 稳定转化态。 酶底物复合物是酶促反应的第一步 酶的催化活性大多数源于它们能够将底物分子排布在有利的位置,促进转化态的形成。 酶与底物形成酶-底物复合物(E$)。底物结合于酶蛋白的特定区域(即活性中心)。大多数酶 对结合底物选择性很高。实际上酶催化特异性部分来源于酶结合底物的特异性。 1,酶与底物形成复合物的第一个线索:在酶浓度不变的情况下,增加底物浓度,反应速度 也增加,直至达到最大反应速度(图8.4)。没有酶催化的化学反应,没有这种饱和效应。 酶催化反应有最大反应速度的事实提示,酶与底物形成了酶-底物复合物。当底物浓度 足够高时,所有的催化活性位点都被底物结合,反应速度无法增加。虽然这个证据间 接,但是普遍存在于酶促反应。 Maximal velocity- Substrate concentration- g点= 困8.4酶促反应速度对底物浓度作图。增加底物浓度,酶促反应速度接近最大反应速度。 2.X-射线晶体学分析提供底物或底物类似物结合于酶活性位,点的高分辨率图像(图8.5)。 在第9章还会介绍几例酶-底物复合物。低温能够降低酶促反应速度,易于观察酶-底物 复合物的形成和后续的酶促反应。更新的技术,即时间分辨的晶体学图谱,取决于光敏 底物类似物与酶一道结晶。暴露于脉冲光下,底物类似物转化成底物。用强的多色X 光扫描晶体,获得酶-底物复合物图像。V = v [X*] =( kT/h )[S] e -△G*/RT 在方程中,k 是 Boltzmann 常数,h 是 Plank 常数。在 25℃,kT/h 是 6.6 x 10 12 s -1。假定活化 自由能是 28.53 kJ mol -1 , 则[S*]/[S]是 10 -5。如果底物浓度是 1 M,则反应速度是 6.2 x 10 7 s -1。 如果将活化自由能降低 5.69 kJ mol -1 , 则[X*]/[S]是 10 -4。如果底物浓度是 1 M,则反应速度 是 6.2 x 10 8 s -1。所以活化自由能降低 5.69 kJ mol -1 就能使反应速度增加 10 倍(二活化自由 能只降低 20%)。 因此酶作用的关键是降低活化自由能。底物与酶结合,使底物形成的转化态能量比没有 酶的底物转化态能量低(图 8.3)。由于活化能量低,形成转化态的分子多,反应速度快。降 低活化自由能相当于降低跳高运动的障碍,更多运动员能够跳过。催化反应的本质是特异性 稳定转化态。 酶-底物复合物是酶促反应的第一步 酶的催化活性大多数源于它们能够将底物分子排布在有利的位置,促进转化态的形成。 酶与底物形成酶-底物复合物(ES)。底物结合于酶蛋白的特定区域(即活性中心)。大多数酶 对结合底物选择性很高。实际上酶催化特异性部分来源于酶结合底物的特异性。 1. 酶与底物形成复合物的第一个线索:在酶浓度不变的情况下,增加底物浓度,反应速度 也增加,直至达到最大反应速度(图 8.4)。没有酶催化的化学反应,没有这种饱和效应。 酶催化反应有最大反应速度的事实提示,酶与底物形成了酶-底物复合物。当底物浓度 足够高时,所有的催化 活性位点都被底物结合,反应速度无法增加。虽然这个证据间 接,但是普遍存在于酶促反应。 图 8.4 酶促反应速度对底物浓度作图。增加底物浓度,酶促反应速度接近最大反应速度。 2. X-射线晶体学分析提供底物或底物类似物结合于酶活性位点的高分辨率图像(图 8.5)。 在第 9 章还会介绍几例酶-底物复合物。低温能够降低酶促反应速度,易于观察酶-底物 复合物的形成和后续的酶促反应。更新的技术,即时间分辨的晶体学图谱,取决于光敏 底物类似物与酶一道结晶。暴露于脉冲光下,底物类似物转化成底物。用强的多色 x 光扫描晶体,获得酶-底物复合物图像