正在加载图片...
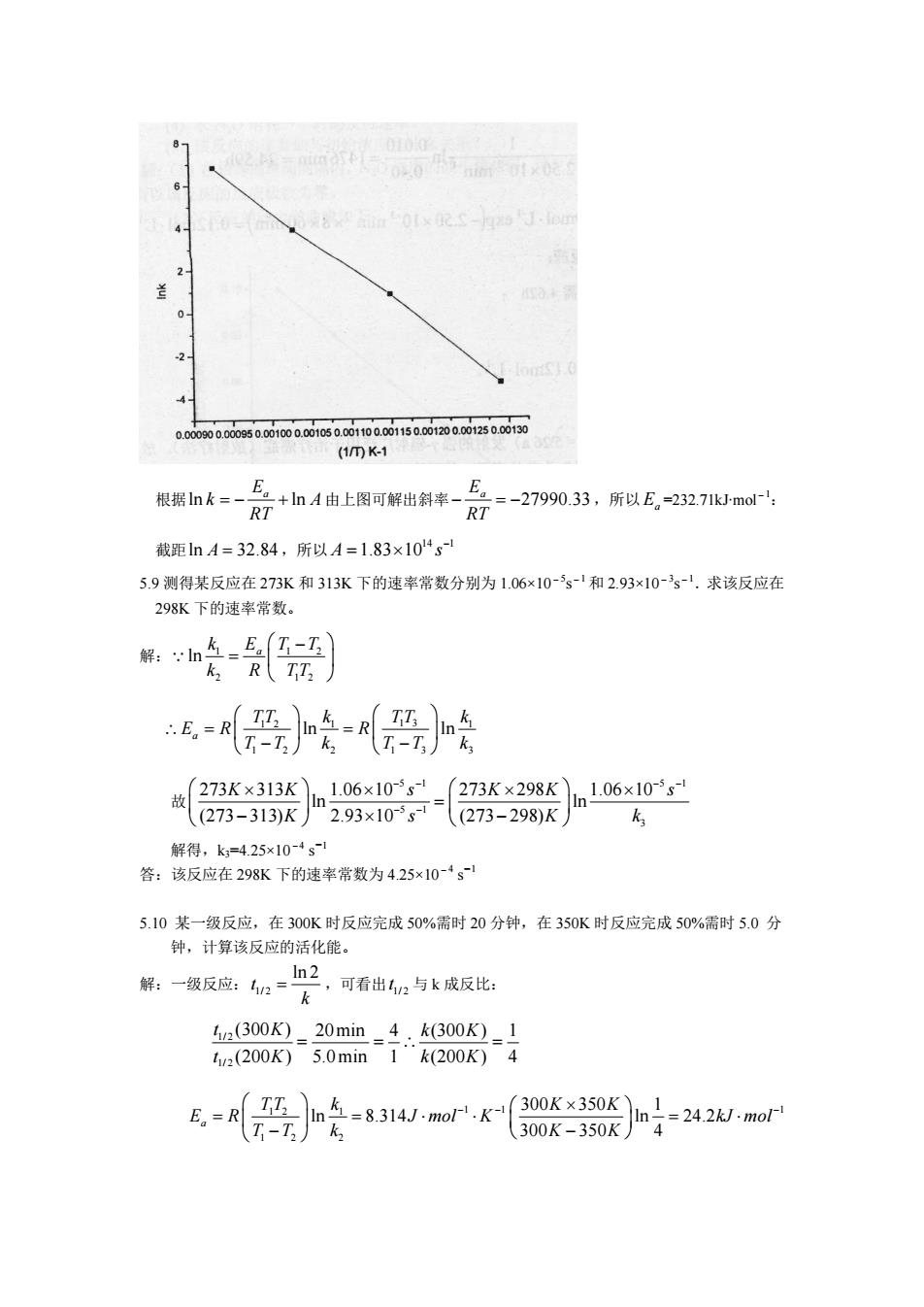
(1mK- 根据nk三-R7+山A由上图可解出斜来-片2三-27990,33,所以E,232,71mo RT 截距nA=32.84,所以A=1.83×104s 5.9测得某反应在273K和313K下的速率常数分别为1.06x10-s-和2.93×10-s-.求该反应在 298K下的速率常数。 解:n车-马(7-工)】 R TT: 恶}经恶 故273K×313Kn106x10s=273K×298Kln106x10-is ((273-313)K 2.93x10s(273-298)K k 解得,k=425x10-1 答:该反应在298K下的速率常数为425×10-·g 5.10某一级反应,在300K时反应完成50%需时20分钟,在350K时反应完成50%需时5.0分 钟,计算该反应的活化能。 解:一级反应:n=h2 ,可看出2与k成反比: (300K)-20min-4.k(300K)_1 12(200K)5.0min1“k200K)4 根据ln ln E a k A RT = - + 由上图可解出斜率 27990.33 E a RT - = - ,所以 Ea =232.71kJ∙mol-1: 截距ln A = 32.84,所以 14 1 A 1.83 10 s - = ¥ 5.9 测得某反应在 273K 和 313K 下的速率常数分别为 1.06×10-5s-1 和 2.93×10-3s-1.求该反应在 298K 下的速率常数。 解: 1 1 2 2 1 2 ln E a k T T k R TT Ê - ˆ = Á ˜ Ë ¯ Q 1 2 1 1 3 1 1 2 2 1 3 3 a ln ln TT k TT k E R R T T k T T k Ê ˆ Ê ˆ \ = = Á ˜ Á ˜ - - Ë ¯ Ë ¯ 故 5 1 5 1 5 1 3 273 313 1.06 10 273 298 1.06 10 ln ln (273 313) 2.93 10 (273 298) K K s K K s K s K k - - - - - - Ê ¥ ˆ ¥ Ê ¥ ˆ ¥ Á ˜ = Á ˜ Ë - ¯ ¥ Ë - ¯ 解得,k3=4.25×10-4 s-1 答:该反应在 298K 下的速率常数为 4.25×10-4 s-1 5.10 某一级反应,在 300K 时反应完成 50%需时 20 分钟,在 350K 时反应完成 50%需时 5.0 分 钟,计算该反应的活化能。 解:一级反应: 1/ 2 ln 2 t k = ,可看出 1/ 2 t 与 k 成反比: 1/ 2 1/ 2 (300 ) 20min 4 (300 ) 1 (200 ) 5.0min 1 (200 ) 4 t K k K t K k K = = \ = 1 2 1 1 1 1 1 2 2 300 350 1 ln 8.314 ln 24.2 300 350 4 a TT k K K E R J mol K kJ mol T T k K K - - - Ê ˆ Ê ¥ ˆ = = × × = × Á ˜ Á ˜ Ë - ¯ Ë - ¯