正在加载图片...
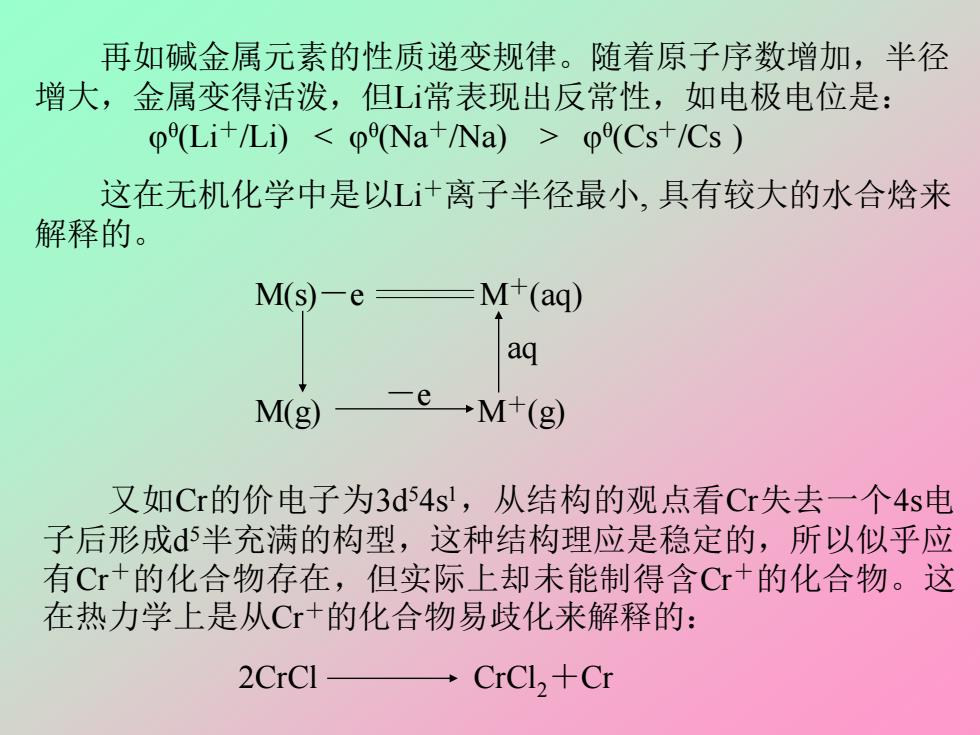
再如碱金属元素的性质递变规律。随着原子序数增加,半径 增大,金属变得活泼,但L常表现出反常性,如电极电位是: 0(Li+/Li)<(Na+/Na)>(Cs+/Cs 这在无机化学中是以L+离子半径最小,具有较大的水合焓来 解释的。 M(s)-e M+(aq) aq M(g) →M+(g) 又如Cr的价电子为3d54s',从结构的观点看Cr失去一个4s电 子后形成d5半充满的构型,这种结构理应是稳定的,所以似乎应 有Cr+的化合物存在,但实际上却未能制得含Cr+的化合物。这 在热力学上是从C+的化合物易歧化来解释的: 2CrCl CrCl,+Cr 再如碱金属元素的性质递变规律。随着原子序数增加,半径 增大,金属变得活泼,但Li常表现出反常性,如电极电位是: θ (Li+/Li) < θ (Na+/Na) > θ (Cs+/Cs ) 这在无机化学中是以Li+离子半径最小, 具有较大的水合焓来 解释的。 M(s)-e M+(aq) M(g) M+(g) -e aq 又如Cr的价电子为3d 54s 1 ,从结构的观点看Cr失去一个4s电 子后形成d 5半充满的构型,这种结构理应是稳定的,所以似乎应 有Cr+的化合物存在,但实际上却未能制得含Cr+的化合物。这 在热力学上是从Cr+的化合物易歧化来解释的: 2CrCl CrCl2+Cr