正在加载图片...
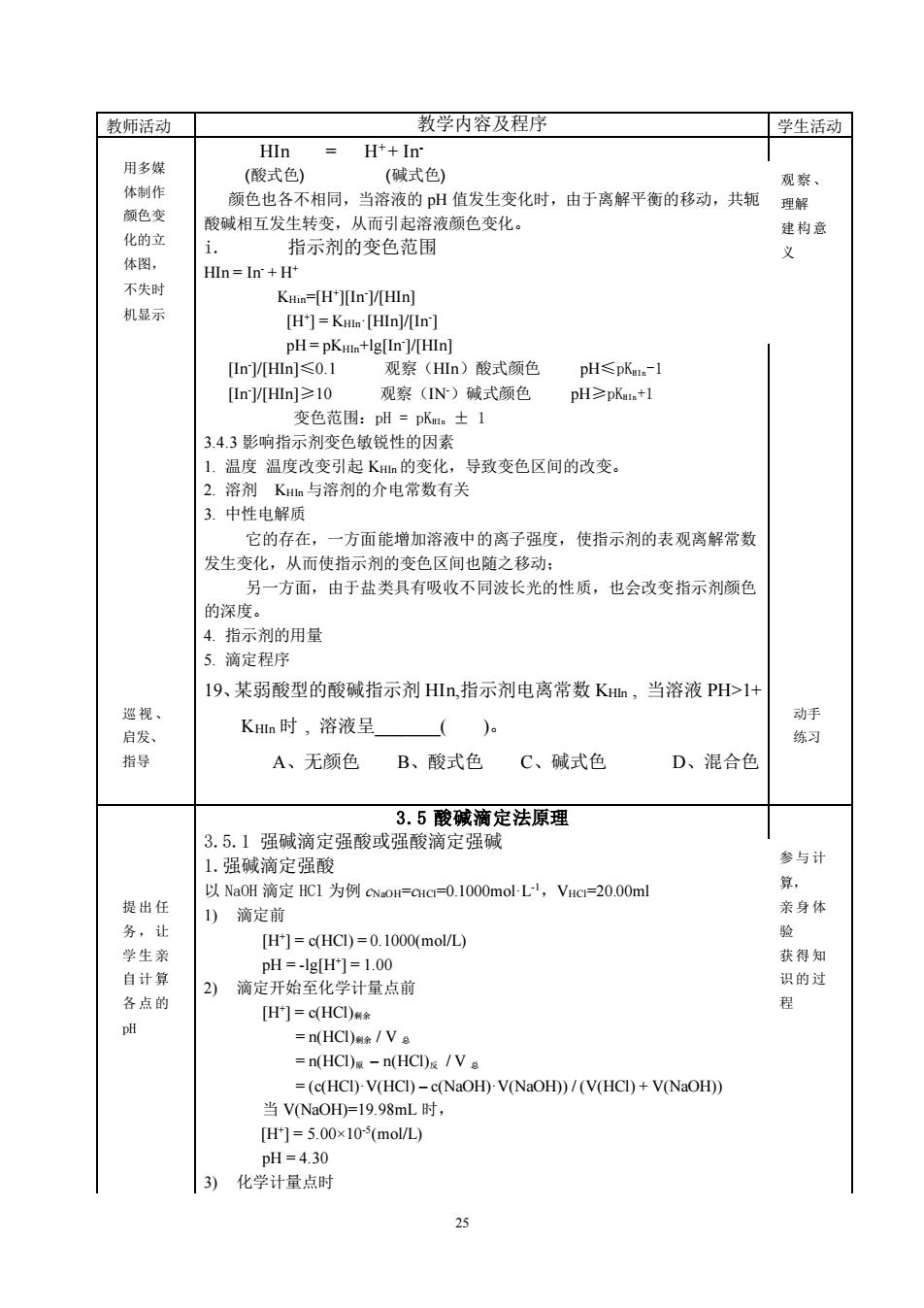
「教师活动 教学内容及程序 学生活动 HIn H*+In 用多媒 (酸式色 (碱式色) 体制作 观察、 颜色变 颜色也各不相同,当溶液的pH值发生变化时,由于离解平衡的移动,共轭 理解 酸碱相互发生转变,从而引起溶液颜色变化。 i 指示剂的变色范围 不失时 机显示 Kww-(H][In]/(HIn] [H]=KHI [HIn]/In] pH=pKmn+lg[In]/[HIn] I1n-/Hnl≤01 观察(HIn)酸式颜色 pH≤pKe.-1 [n]/Hn]≥10 观察(N)碱式颜色 pH≥pKen+1 ±1 1,温度温度改变引起K的变化,导致变色区间的改变。 2.溶剂Kn与溶剂的介电常数有关 3.中性电解质 它的存在,一方面能增加溶液中的离子强度, 使指示剂的表观离解常数 发生变化,从而使指示剂的变色区间也随之移动: 另一方面,由于盐类具有吸收不同波长光的性质,也会改变指示剂颜色 的深度。 4.指示剂的用量 5.滴定程序 19、某弱酸型的酸碱指示剂Hn,指示剂电离常数Kn,当溶液PH>1+ 巡视 动手 启发」 Ka时,溶液呈( 练 指导 A、无颜色 B、酸式色 C、碱式色 D、混合色 3.5酸碱滴定法原理 3.5.1强碱滴定强酸或强酸滴定强碱 1.强碱滴定强酸 参与计 以Na0H滴定HC1为例cNoH=GHc-0.1000mol-L,VHc=20.00ml 提出任 1)滴定前 亲身休 务,让 Hr]=cHC)=0.1000(mol/) 学生亲 获得知 自计算 pH=-gH=1.00 识的过 各点的 2)滴定开始至化学计量点前 [H1=c(HCI) pH =(HCD/V =nHC)-nHC)E/V。 =(c(HCI)-V(HCI)-c(NaOH)-V(NaOH))/(V(HCI)+V(NaOH)) 当V(NaOH)=19.98mL时, H门=5.00×105(mol/) DH=4.30 3) 化学计量点时 25 教师活动 教学内容及程序 学生活动 HIn = H+ + In- (酸式色) (碱式色) 颜色也各不相同,当溶液的 pH 值发生变化时,由于离解平衡的移动,共轭 酸碱相互发生转变,从而引起溶液颜色变化。 i. 指示剂的变色范围 HIn = In- + H+ KHin=[H+ ][In- ]/[HIn] [H+ ] = KHIn·[HIn]/[In- ] pH = pKHIn+lg[In- ]/[HIn] [In- ]/[HIn]≤0.1 观察(HIn)酸式颜色 pH≤pKHIn-1 [In- ]/[HIn]≥10 观察(IN-)碱式颜色 pH≥pKHIn+1 变色范围:pH = pKHIn ± 1 3.4.3 影响指示剂变色敏锐性的因素 1. 温度 温度改变引起 KHIn 的变化,导致变色区间的改变。 2. 溶剂 KHIn 与溶剂的介电常数有关 3. 中性电解质 它的存在,一方面能增加溶液中的离子强度,使指示剂的表观离解常数 发生变化,从而使指示剂的变色区间也随之移动; 另一方面,由于盐类具有吸收不同波长光的性质,也会改变指示剂颜色 的深度。 4. 指示剂的用量 5. 滴定程序 19、某弱酸型的酸碱指示剂 HIn,指示剂电离常数 KHIn , 当溶液 PH>1+ KHIn 时 , 溶液呈_( )。 A、无颜色 B、酸式色 C、碱式色 D、混合色 3.5 酸碱滴定法原理 3.5.1 强碱滴定强酸或强酸滴定强碱 1.强碱滴定强酸 以 NaOH 滴定 HCl 为例 cNaOH=cHCl=0.1000mol·L-1,VHCl=20.00ml 1) 滴定前 [H+ ] = c(HCl) = 0.1000(mol/L) pH = -lg[H+ ] = 1.00 2) 滴定开始至化学计量点前 [H+ ] = c(HCl)剩余 = n(HCl)剩余 / V 总 = n(HCl)原 – n(HCl)反 / V 总 = (c(HCl)·V(HCl) – c(NaOH)·V(NaOH)) / (V(HCl) + V(NaOH)) 当 V(NaOH)=19.98mL 时, [H+ ] = 5.00×10-5 (mol/L) pH = 4.30 3) 化学计量点时 提出任 务,让 学生亲 自计算 各点的 pH 参与计 算, 亲身体 验 获得知 识的过 程 用多媒 体制作 颜色变 化的立 体图, 不失时 机显示 观察、 理解 建构意 义 巡视、 启发、 指导 动手 练习