正在加载图片...
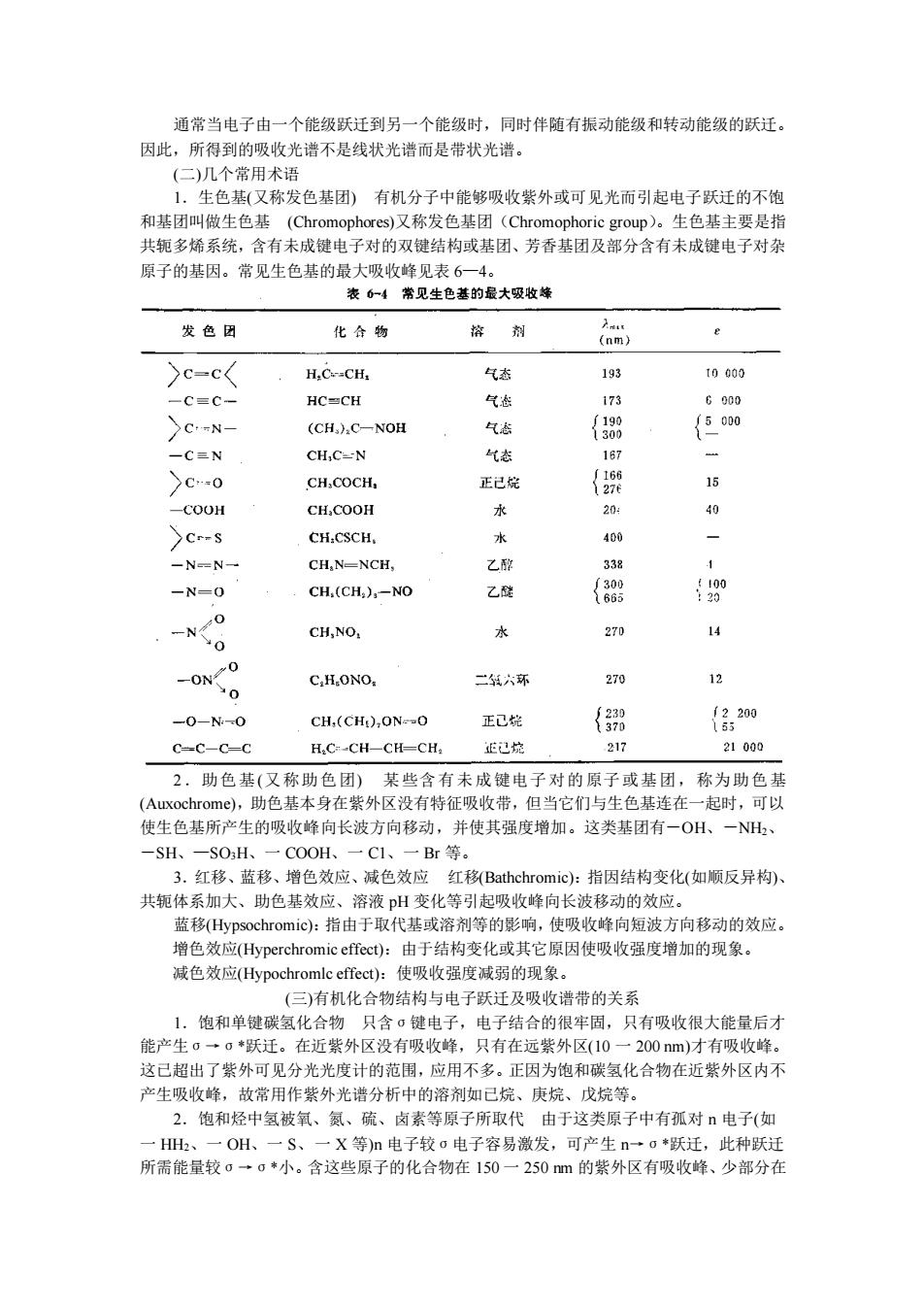
通常当电子由一个能级跃迁到另一个能级时,同时伴随有振动能级和转动能级的跃迁。 因此,所得到的吸收光谱不是线状光谱而是带状光谱。 生色基(又称发色基团)有机分子中能够吸收紫外或可见光而引起电子跃迁的不饱 和基团叫做生色基(Chromophores)又称发色基团(Chromophoric group)。生色基主要是指 共轭多烯系统,含有未成键电子对的双键结构或基团、芳香基团及部分含有未成键电子对杂 原子的基因。常见生色基的最大吸收峰贝表6一4 表6一4常见生色基的最大吸收蜂 发色团 化合物 格剂 e )c-c< H.C.-CH 气数 t0000 -C三C- HC≌CH 气翻 173 G000 CN- (CH.)C-NOH 气志 {388 {5000 一C三N CHC-N 气态 16月 >C0 CH.COCH, 正己烷 {9 15 -COOH CH,COOH 水 204 % Cr-s CH.CSCH. 水 400 -N-N- CH,N-NCH, 乙配 -N=0 CH(CH,)-NO 乙醚 { 00 CH,NO. 水 270 0 -ON C.HONO 二六环 270 名 -0-N-O CH,(CH),ONO 正己皖 {3测 {620 C-C-C-C H.C-CH-CH-CH, 正已控 217 21000 2,助色基(又称助色团)某些含有未成键电子对的原子或基团,称为助色基 ),助色基本身在紫外区没有特征吸收带,但当它们与生色基连在一起时,可以 使生色基所产生的吸收峰向长波方向移动, 并使其强度增加。 这类基团有 OH, -SH、 -SOH、 COOH. 一Br等。 3.红移、蓝移、增色效应、减色效应红移Bathchromic):指因结构变化(如顺反异构) 共轭体系加大、助色基效应、溶液pH变化等引起吸收峰向长波移动的效应。 蓝移Hypsochromic):指由于取代基或溶剂等的影响,使吸收峰向短波方向移动的效应。 增色效应(ype chromic c):由于结构变化或其它原因使吸收强度增加的现象。 减色效应(Hypochromle effect):使吸收强度减弱的现象 (三)有机化合物结构与电子跃迁及吸收谱带的关系 1.饱和单键碳氢化合物只含σ健电子,电子结合的很牢固,只有吸收很大能量后才 能产生σ一c◆跃迁。在近紫外区没有吸收峰,只有在远紫外区(10一200m)才有吸收峰。 这已超出了紫外可见分光光度计的范围,应用不多。正因为饱和碳氢化合物在近紫外区内不 产生吸收峰,故常用作紫外光谱分 析中的溶剂如已烷、庚烷、 戊烷等 2.饱和烃中氢被氧、氮、硫、卤素等原子所取代由于这类原子中有孤对电子(如 一HH、一OH、一S、一X等)n电子较o电子容易激发,可产生n一o*跃迁,此种跃迁 所需能量较0一。·小。含这些原子的化合物在150一250m的紫外区有吸收峰、少部分在 通常当电子由一个能级跃迁到另一个能级时,同时伴随有振动能级和转动能级的跃迁。 因此,所得到的吸收光谱不是线状光谱而是带状光谱。 (二)几个常用术语 1.生色基(又称发色基团) 有机分子中能够吸收紫外或可见光而引起电子跃迁的不饱 和基团叫做生色基 (Chromophores)又称发色基团(Chromophoric group)。生色基主要是指 共轭多烯系统,含有未成键电子对的双键结构或基团、芳香基团及部分含有未成键电子对杂 原子的基因。常见生色基的最大吸收峰见表 6—4。 2.助色基(又称助色团) 某些含有未成键电子对的原子或基团,称为助色基 (Auxochrome),助色基本身在紫外区没有特征吸收带,但当它们与生色基连在一起时,可以 使生色基所产生的吸收峰向长波方向移动,并使其强度增加。这类基团有-OH、-NH2、 -SH、—SO3H、一 COOH、一 C1、一 Br 等。 3.红移、蓝移、增色效应、减色效应 红移(Bathchromic):指因结构变化(如顺反异构)、 共轭体系加大、助色基效应、溶液 pH 变化等引起吸收峰向长波移动的效应。 蓝移(Hypsochromic):指由于取代基或溶剂等的影响,使吸收峰向短波方向移动的效应。 增色效应(Hyperchromic effect):由于结构变化或其它原因使吸收强度增加的现象。 减色效应(Hypochromlc effect):使吸收强度减弱的现象。 (三)有机化合物结构与电子跃迁及吸收谱带的关系 1.饱和单键碳氢化合物 只含σ键电子,电子结合的很牢固,只有吸收很大能量后才 能产生σ→σ*跃迁。在近紫外区没有吸收峰,只有在远紫外区(10 一 200 nm)才有吸收峰。 这已超出了紫外可见分光光度计的范围,应用不多。正因为饱和碳氢化合物在近紫外区内不 产生吸收峰,故常用作紫外光谱分析中的溶剂如已烷、庚烷、戊烷等。 2.饱和烃中氢被氧、氮、硫、卤素等原子所取代 由于这类原子中有孤对 n 电子(如 一 HH2、一 OH、一 S、一 X 等)n 电子较σ电子容易激发,可产生 n→σ*跃迁,此种跃迁 所需能量较σ→σ*小。含这些原子的化合物在 150 一 250 nm 的紫外区有吸收峰、少部分在