
第六章可见紫外分光光度法 ·、分光光度法的基本概念 分光光度法是根据物质对光具有选择性的吸收特征而建立起来的一种分析方法,通常又称吸 收光谱法。吸收光谱是可见光谱、紫外光谱和红外光谱的统称。 吸收光谱是由物质吸收光能而产生。光具有波粒二重性,它既是电磁波又是辐射能。 (一)光的波动性 光作为电磁波,具有波动性的特征,可用波长(入)、率(v)及波数(。)来表示 三者的关系可用以下表示。 (6-1) 1 (6-2) 式中: 波长 c一一光速 一频率 g一一波数,为每厘米长度中波的数目,即波长的倒数,单位为1cm。 (一)光的微粒性一一些朗克公式 光作为辐射能又具有微粒性的特征。所谓微粒性,即指光是由光量子(或光子)的一 种粒子组成。光辐射的能量是一份一份的。单个光量子的能量与波长的关系可用普朗克 (plank)公式表示 E=加=h贷=c (6-3) 式中:E 一能量 普朗克常量 从公式(6一3)可见,光量子的波长与其能量成反比,波长愈长,能量愈小。 (三)可见紫外、红外光区的划分 根据电磁波具有波粒二重性的特点,可把自然界存在的各种电磁波按波长顺序排列成 谱,称为电磁波谱,如表6一1所示 表6-1电磁波谱 光谱区 被长花围 动形式 X射线 0.110nm 原子内显电子获 真空紫外 分子 2.1 分中原子外层电子获迁 近红外光风 0.75-2.5m 1.2 分下中涉及氢原子的报动 红外光区 2.5-501m 0.12 分子中原子的振动及分子转动 远红外光以 60一1000μm 10- 分子的转动 餐被区 1000-3×10μm 10 分子的找动 可将电磁波波长划分为若干波段区域,如X射线区、远紫外区、可见光区和红外光区 等,从表6一1可以看出各区的波长一次上升,而其能量则依次下降,各波段能量不同,引 起物质运动的形式亦不同。物质吸收紫外光和可见光则引起分子中价电子的跃迁:物质吸收 红外光则引起分子振动,因此可见紫外光谱又称为电子光谱,红外光谱又称为分子振动光谱
第六章 可见紫外分光光度法 一、分光光度法的基本概念 分光光度法是根据物质对光具有选择性的吸收特征而建立起来的一种分析方法,通常又称吸 收光谱法。吸收光谱是可见光谱、紫外光谱和红外光谱的统称。 吸收光谱是由物质吸收光能而产生。光具有波粒二重性,它既是电磁波又是辐射能。 (一)光的波动性 光作为电磁波,具有波动性的特征,可用波长(λ)、频率(v)及波数(σ)来表示。 三者的关系可用以下表示。 c v = , c v = (6-1) 1 = (6-2) 式中:λ——波长 c——光速 v——频率 σ——波数,为每厘米长度中波的数目,即波长的倒数,单位为 1/cm。 (二)光的微粒性——普朗克公式 光作为辐射能又具有微粒性的特征。所谓微粒性,即指光是由光量子(或光子)的一 种粒子组成。光辐射的能量是一份一份的。单个光量子的能量与波长的关系可用普朗克 (plank)公式表示 c 1 E hv h hc = = = (6-3) 式中:E——能量; h——普朗克常量 从公式(6-3)可见,光量子的波长与其能量成反比,波长愈长,能量愈小。 (三)可见紫外、红外光区的划分 根据电磁波具有波粒二重性的特点,可把自然界存在的各种电磁波按波长顺序排列成 谱,称为电磁波谱,如表 6-1 所示。 可将电磁波波长划分为若干波段区域,如 X 射线区、远紫外区、可见光区和红外光区 等,从表 6-1 可以看出各区的波长一次上升,而其能量则依次下降,各波段能量不同,引 起物质运动的形式亦不同。物质吸收紫外光和可见光则引起分子中价电子的跃迁;物质吸收 红外光则引起分子振动,因此可见紫外光谱又称为电子光谱,红外光谱又称为分子振动光谱
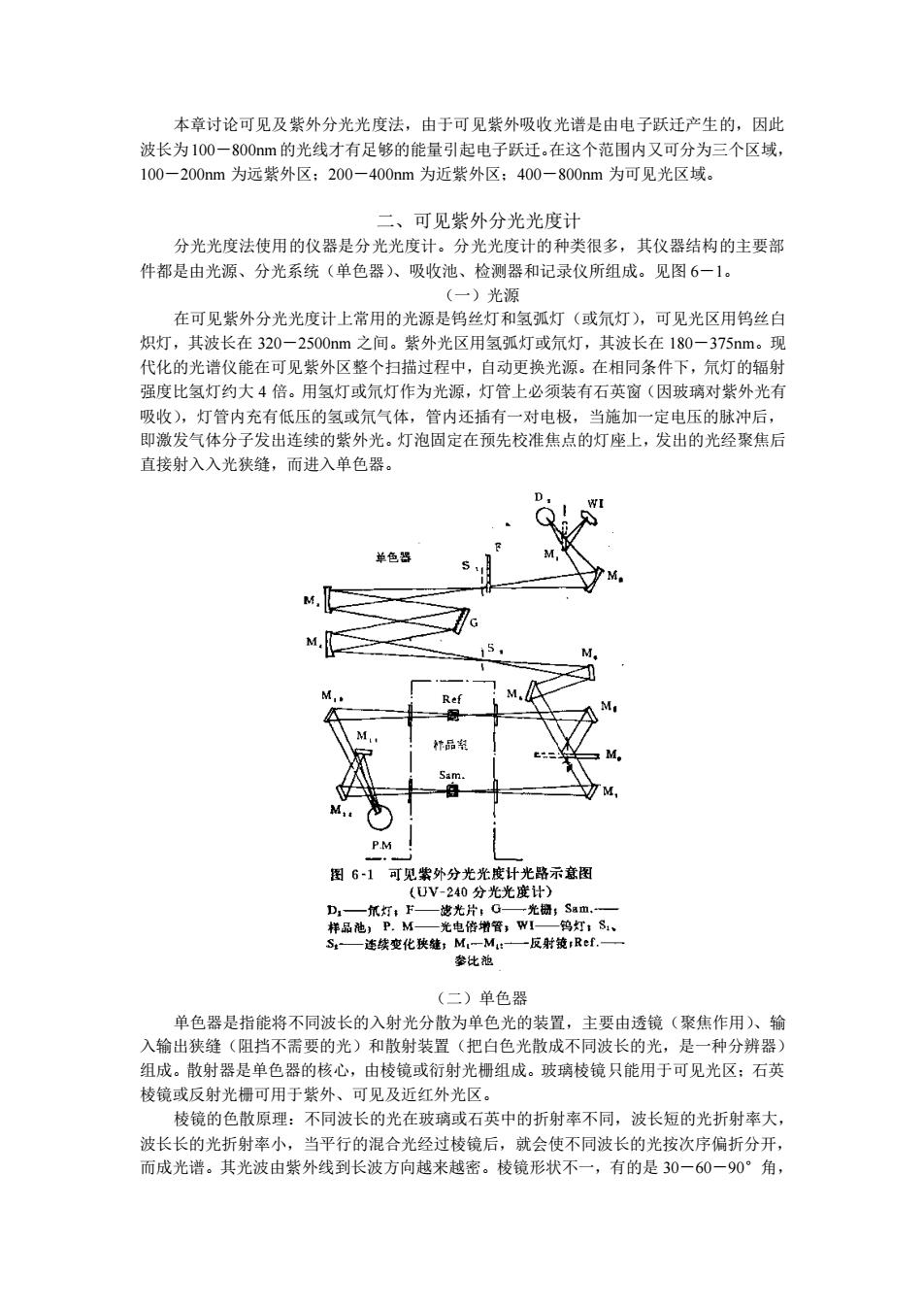
本章讨论可见及紫外分光光度法,由于可见紫外吸收光谱是由电子跃迁产生的,因此 被长为10一80如m的炎线大有足够的能量引志典子跃在这个流遇内又可分为三个区城 -200mm为远紫外区:200-400nm为近紫外区:400-800nm为可见光区域 二、可见紫外分光光度十 分光光度法使用的仪器是分光光度计。分光光度计的种类很多,其仪器结构的主要部 件都是由光源、分光系统(单色器)、吸收池、检测器和记录仪所组成。见图6一1。 )光湿 在可见紫外分光光度计上常用的光源是钨丝灯和氢弧灯(或氘灯),可见光区用钨丝白 炽灯,其波长在320-2500nm之间。紫外光区用氢弧灯或氘灯,其波长在180一375nm。现 代化的光谱仪能在可见紫外区整个扫描过程中,自动更换光源。在相同条件下,氘灯的辐射 强度比氢灯约大4倍。用氢灯或氘灯打作为光源,灯管上必须装有石英窗(因玻璃对紫外光右 吸收),灯管内充有低压的氢或氘气体,管内还插有一对电极,当施加 定电压的脉冲后 即激发气体分子发出连续的紫外光。灯泡固定在预先校准焦点的灯座上,发出的光经聚焦后 直接射入入光狭缝,而进入单色器。 色 M M. G M. 图61可见外分光先亮资 路示意图 片 连续变化奖链:M M:- (二)单色器 单色器是指能将不同波长的入射光分散为单色光的装置,主要由透镜(聚焦作用)、输 入输出狭缝(阻挡不需要的光)和散射装置(把白色光散成不同波长的光,是一种分辨器) 组成。散射器是单色器的核心,由棱镜或衍射光组成。玻璃棱镜只能用于可见光区:石英 棱镜或反射光栅可用于紫外、可见及近红外光区。 棱镜的色散原理:不同波长的光在玻璃或石英中的折射率不同,波长短的光折射率大, 波长长的光折射率小,当平行的混合光经过棱镜后,就会使不同波长的光按次序偏折分开, 而成光谱。其光波由紫外线到长波方向越来越密。棱镜形状不一,有的是30一60一90°角
本章讨论可见及紫外分光光度法,由于可见紫外吸收光谱是由电子跃迁产生的,因此 波长为100-800nm的光线才有足够的能量引起电子跃迁。在这个范围内又可分为三个区域, 100-200nm 为远紫外区;200-400nm 为近紫外区;400-800nm 为可见光区域。 二、可见紫外分光光度计 分光光度法使用的仪器是分光光度计。分光光度计的种类很多,其仪器结构的主要部 件都是由光源、分光系统(单色器)、吸收池、检测器和记录仪所组成。见图 6-1。 (一)光源 在可见紫外分光光度计上常用的光源是钨丝灯和氢弧灯(或氘灯),可见光区用钨丝白 炽灯,其波长在 320-2500nm 之间。紫外光区用氢弧灯或氘灯,其波长在 180-375nm。现 代化的光谱仪能在可见紫外区整个扫描过程中,自动更换光源。在相同条件下,氘灯的辐射 强度比氢灯约大 4 倍。用氢灯或氘灯作为光源,灯管上必须装有石英窗(因玻璃对紫外光有 吸收),灯管内充有低压的氢或氘气体,管内还插有一对电极,当施加一定电压的脉冲后, 即激发气体分子发出连续的紫外光。灯泡固定在预先校准焦点的灯座上,发出的光经聚焦后 直接射入入光狭缝,而进入单色器。 (二)单色器 单色器是指能将不同波长的入射光分散为单色光的装置,主要由透镜(聚焦作用)、输 入输出狭缝(阻挡不需要的光)和散射装置(把白色光散成不同波长的光,是一种分辨器) 组成。散射器是单色器的核心,由棱镜或衍射光栅组成。玻璃棱镜只能用于可见光区;石英 棱镜或反射光栅可用于紫外、可见及近红外光区。 棱镜的色散原理:不同波长的光在玻璃或石英中的折射率不同,波长短的光折射率大, 波长长的光折射率小,当平行的混合光经过棱镜后,就会使不同波长的光按次序偏折分开, 而成光谱。其光波由紫外线到长波方向越来越密。棱镜形状不一,有的是 30-60-90°角

有的是正三角形。棱镜又分透射井和反射镜两种。反射镜是在背面镀一层铝,使光射到铝面 上又反射回去。光栅的色散原理:光栅是在石英或玻璃表面上刻划许多等距离的平行线,大 约每245 m刻1500 30000条线 刻线处不这 光 光只能在两条刻线 间的平面 处透过 去。这些平面形成极微小的缝,光透过小缝时即产生绕射现象。较长的光波偏折的角度大 较短的光波偏折角度小:并对各小缝射出的光在传播过程中其干涉使用。刻的线愈密,色散 程度大,光栅也有透射和反射两种。 从棱镜或光橱射出的光经旋转反射镜就可依次射出狭缝,经聚焦后达到吸收池。旋转 速度与记录器扫描速度是同步的,因此,可将各种波长的光被吸收的情况连续记录下来,而 成为吸收 现代高级分光光度计往往采用双单色器,即包含两个光栅或两个棱镜,或一个棱镜一 个光梧,这样可以减少杂散光,提高仪器的分辨能力。 (三)吸收池 贵吸及修是用以路样秀高波行定的容乳·可见水区用支吸收设泡清度 紫外区需用石 池厚 般使用lcm的 定影响很大,透明光学面不得用手指拿,不得用毛刷等硬物擦洗,通常用擦镜纸擦洗。测定 时如遇挥发性液体或气体,需盖上池盖,以免溶液挥发影响测定浓度或产生气体损害仪器部 件。 检测器的功能是检测光信号并将其转变为电信号 检测器主要部件为光电池或光电倍 增管等。光电倍增管是当前应用最多的一种检测器,它的作用是利用二次电子发射以放大为 电流,放大倍数可达103倍。对检测器的要求是灵敏度高、对辐射相应时间短、对辐射能量 相应的线性关系良好、噪音小、性能稳定等。 (五)测量信号指示系统 用光电倍增管作检测器,需要将检测器信号放大以后用记录器记录下来,不同型号分 光光度计记录装置不同,目前许多由微处理机控制的紫外可见分光光度计,可自动调零,自 动筛选波长,自动设置参数、扫描与计算均自动完成,大大减少了人为误差。 三、分光光度法的基本定律 (一)光吸收定律 用分光光度法进行定量分析是以朗伯一比尔定律(Lambert-一Beer's Law)为依据的 它是描述各种类型的电磁辐射被介质吸收规律的基本定律,简称比尔定律,定律具体内容是 当一束平行的单色光()射入具有平行平面的吸光介质(溶液)时,一部分()透过介质 (溶液),一部分光被介质(溶液)所吸收。光的强度随介质的厚度及吸光物质的浓度的递 增而依指数规律递减。基本公式如下: 式中:A 吸光度(absorbence -透光度(transmittance)或称透射率 lo- 入射光强度: 一一诱过逼度: 光程长度即样品溶液的厚度(通常为吸收池的厚度) 样品溶液的浓度: A吸光系数(absorptivity)· 根据公式可见,当光程固定时,溶液的吸光度(A)与溶液的浓度(C)成正比关系。 当溶液浓度(C)周定时,吸光度(A)与光程长度(L)成正比关系。此公式一般适合于稀
有的是正三角形。棱镜又分透射井和反射镜两种。反射镜是在背面镀一层铝,使光射到铝面 上又反射回去。光栅的色散原理:光栅是在石英或玻璃表面上刻划许多等距离的平行线,大 约每 2.45cm 刻 15000-30000 条线。刻线处不透光,光只能在两条刻线中间的平面处透过 去。这些平面形成极微小的缝,光透过小缝时即产生绕射现象。较长的光波偏折的角度大, 较短的光波偏折角度小;并对各小缝射出的光在传播过程中其干涉使用。刻的线愈密,色散 程度大,光栅也有透射和反射两种。 从棱镜或光栅射出的光经旋转反射镜就可依次射出狭缝,经聚焦后达到吸收池。旋转 速度与记录器扫描速度是同步的,因此,可将各种波长的光被吸收的情况连续记录下来,而 成为吸收光谱图。 现代高级分光光度计往往采用双单色器,即包含两个光栅或两个棱镜,或一个棱镜一 个光栅,这样可以减少杂散光,提高仪器的分辨能力。 (三)吸收池 吸收池是用以盛装样品溶液进行测定的容器。可见光区用玻璃吸收池;紫外区需用石 英吸收池。池厚(内径)有 0.5,1,2cm 等几种,一般使用 1cm 的,吸收池的光洁度对测 定影响很大,透明光学面不得用手指拿,不得用毛刷等硬物擦洗,通常用擦镜纸擦洗。测定 时如遇挥发性液体或气体,需盖上池盖,以免溶液挥发影响测定浓度或产生气体损害仪器部 件。 (四)检测器 检测器的功能是检测光信号并将其转变为电信号。检测器主要部件为光电池或光电倍 增管等。光电倍增管是当前应用最多的一种检测器,它的作用是利用二次电子发射以放大光 电流,放大倍数可达 108 倍。对检测器的要求是灵敏度高、对辐射相应时间短、对辐射能量 相应的线性关系良好、噪音小、性能稳定等。 (五)测量信号指示系统 用光电倍增管作检测器,需要将检测器信号放大以后用记录器记录下来,不同型号分 光光度计记录装置不同,目前许多由微处理机控制的紫外可见分光光度计,可自动调零,自 动筛选波长,自动设置参数、扫描与计算均自动完成,大大减少了人为误差。 三、分光光度法的基本定律 (一)光吸收定律 用分光光度法进行定量分析是以朗伯-比尔定律(Lambert-Beer’s Law)为依据的, 它是描述各种类型的电磁辐射被介质吸收规律的基本定律,简称比尔定律。定律具体内容是: 当一束平行的单色光(I0)射入具有平行平面的吸光介质(溶液)时,一部分(I)透过介质 (溶液),一部分光被介质(溶液)所吸收。光的强度随介质的厚度及吸光物质的浓度的递 增而依指数规律递减。基本公式如下: 式中:A——吸光度(absorbence) T——透光度(transmittance)或称透射率; I0——入射光强度; I——透过强度; L——光程长度即样品溶液的厚度(通常为吸收池的厚度); C——样品溶液的浓度; K—— (absorptivity) A LC 吸光系数 。 根据公式可见,当光程固定时,溶液的吸光度(A)与溶液的浓度(C)成正比关系。 当溶液浓度(C)固定时,吸光度(A)与光程长度(L)成正比关系。此公式一般适合于稀

溶液,也可用于气体或固体。 在具体应用时,被测溶液浓度可用moL或百分浓度来表示 用molL来表示时,用L为lcm比色池,相应的吸光系数称为摩尔吸光系数(mola absorptivity)用符号e表示 用百分浓度g100ml来表示时,L为lcm比色池,相应吸光系数称为百分吸光系数,用 符号E“表示。 E与E的关系如下: Ei=10x6 式中 m一一物质的分子量 &=E“×0.1m 。和E“的计算方法示例: 将三环唑纯品(分子量为189.24)用氯仿配成浓度为0.004%(即40mgL)的溶液, 在292nm处,用1cm比色池测得吸光度A=0.51,求在此浓度下e和E%值。 是 0.51 ,1x004/100×100=24x10 31 189.24 E=10x6=10x34x10=13x10 m 189.24 测定e值得意义: (1)根据e值的大小,可以确定化合物吸光度的强弱,e值>10为强吸收,e=103 10为较强吸收,e=102一103为较弱吸收,c<10为弱吸收。 (2)值大小与电子跃迁种类及电子在两个能级间跃迁的几率有关,如不饱和双键化 合物,可以 *跃迁,值则很大,属于强吸收。又如n一o及一*跃迁,所需 能量相差不多,但二者中I一n◆跃迁几率较大,因此©值比n一o◆的大,约为10,属强 吸收. (3)e值可以衡量不同物质在同一波长下吸收能力的强弱,在同一波长下,©值越大吸 收光能力愈强。 (4)对同一化合物而言, 在不同波长下具有不同的e值,但在一定波长下,它又是 个特征常数,因此可作为有机化合物定性鉴定的参数之一 (5)e值是衡量分析灵敏度高低的依据之一,e值越大,灵敏度越高。 (二)吸收曲线 吸收曲线又称为光普曲线或光吸收曲线,是指用固定浓度及吸收池的厚度,在不同被 长下用分光光度计测得相应的吸光度()然后以波长为横坐标,吸光度值为纵坐标作图 所得的吸光度一波长曲线,即为吸收曲线。如图6一2所示
溶液,也可用于气体或固体。 在具体应用时,被测溶液浓度可用 mol/L 或百分浓度来表示。 用 mol/L 来表示时,用 L 为 1cm 比色池,相应的吸光系数称为摩尔吸光系数(molar absorptivity)用符号ε表示 用百分浓度 g/100ml 来表示时,L 为 1cm 比色池,相应吸光系数称为百分吸光系数,用 符号 1 E1cm % 表示。 E 与ε的关系如下: 1 1cm 10 E m % = 式中: m——物质的分子量 1 E 0.1 1cm m = % ε和 1 E1cm % 的计算方法示例: 将三环唑纯品(分子量为 189.24)用氯仿配成浓度为 0.004%(即 40mg/L)的溶液, 在 292nm 处,用 1cm 比色池测得吸光度 A=0.51,求在此浓度下ε和 1 E1cm % 值。 0.51 3 2.4 10 0.004 100 1000 1 189.24 A A LC WL m = = = = 3 1 2 1cm 10 10 2.4 10 E 1.3 10 m 189.24 %= = = 测定ε值得意义: (1)根据 e 值的大小,可以确定化合物吸光度的强弱,e 值>104 为强吸收,e=103- 104 为较强吸收,e=102-103 为较弱吸收,e<102 为弱吸收。 (2)e 值大小与电子跃迁种类及电子在两个能级间跃迁的几率有关,如不饱和双键化 合物,可以产生π→π*跃迁,e 值则很大,属于强吸收。又如 n→σ*及π→π*跃迁,所需 能量相差不多,但二者中π→π*跃迁几率较大,因此 e 值比 n→σ*的大,约为 104,属强 吸收。 (3)e 值可以衡量不同物质在同一波长下吸收能力的强弱,在同一波长下,e 值越大吸 收光能力愈强。 (4)对同一化合物而言,在不同波长下具有不同的 e 值,但在一定波长下,它又是一 个特征常数,因此可作为有机化合物定性鉴定的参数之一。 (5)e 值是衡量分析灵敏度高低的依据之一,e 值越大,灵敏度越高。 (二)吸收曲线 吸收曲线又称为光谱曲线或光吸收曲线,是指用固定浓度及吸收池的厚度,在不同波 长下用分光光度计测得相应的吸光度(A)然后以波长为横坐标,吸光度值为纵坐标作图, 所得的吸光度-波长曲线,即为吸收曲线。如图 6-2 所示
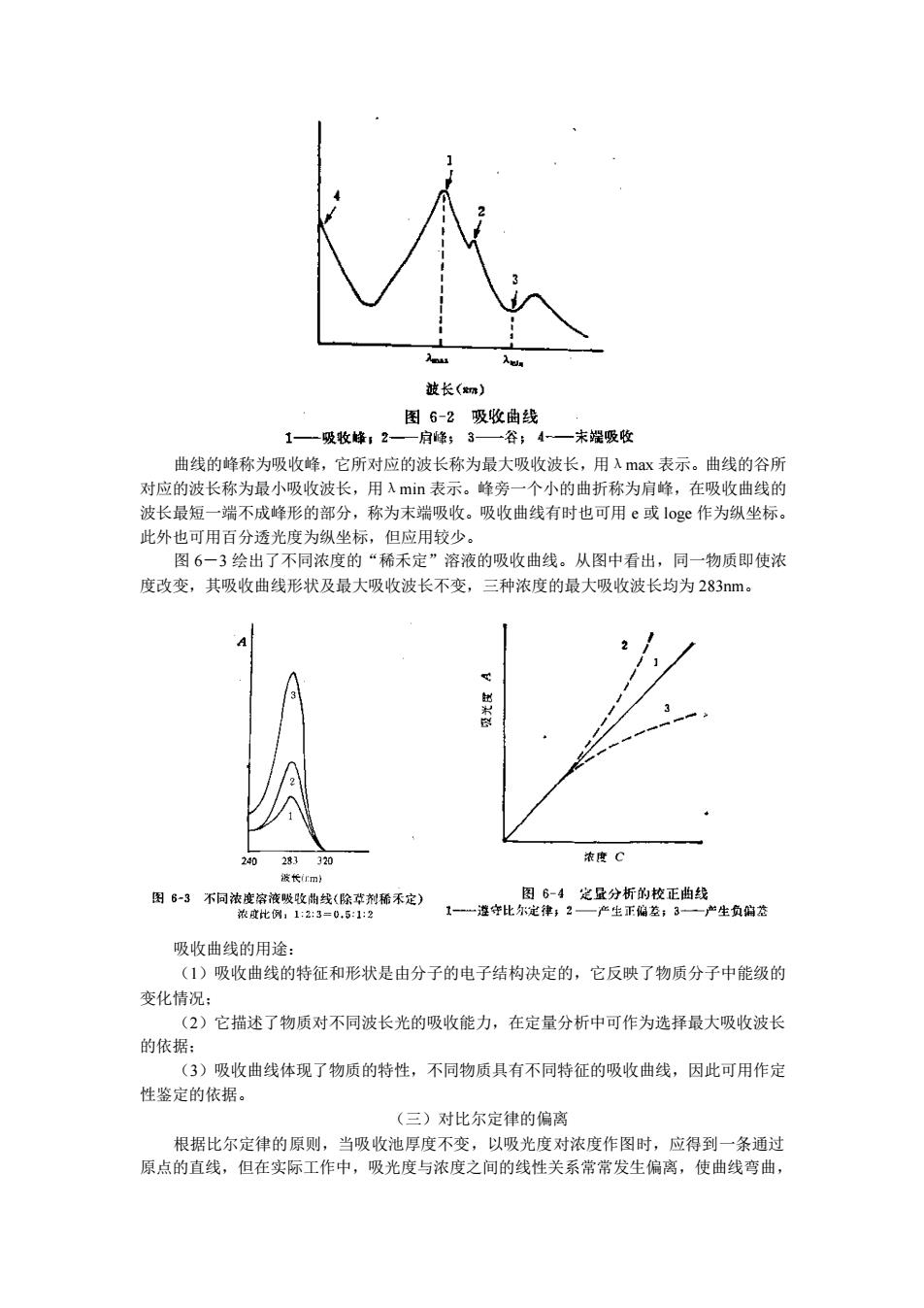
被长() 1一一吸牧峰,2 4一末提吸收 曲线的峰称为吸收峰,它所对应的波长称为最大吸收波长,用入max表示。曲线的谷所 对应的波长称为最小吸收波长,用λm表示。峰旁一个小的曲折称为肩峰,在吸收曲线的 波长最短一端不成峰形的部分,称为末端吸收。吸收曲线有时也可用ε或1og作为纵坐标。 此外也可用百分透光度为纵坐标,但应用较少 图6一3绘出了不同浓度的“稀禾定”溶液的吸收曲线。从图中君出,同一物质即使浓 度改变,其吸收曲线形状及最大吸收波长不变,三种浓度的最大吸收波长均为283m。 浓度C 国6时不阳流点筑表位除降不)王一准世思:光华分折的收正自股生肉 吸收曲线的用涂 (1)吸收曲线的特征和形状是由分子的电子结构决定的,它反映了物质分子中能级的 变化情况: (2)它描述了物质对不同波长光的吸收能力,在定量分析中可作为选择最大吸收波长 的依据: (3)吸收曲线体现了物质的特性,不同物质具有不同特征的吸收曲线,因此可用作定 性鉴定的依据 (三)对比尔定律的偏离 根据比尔定律的原则,当吸收池厚度不变,以吸光度对浓度作图时,应得到一条通过 原点的直线,但在实际工作中,吸光度与浓度之间的线性关系常常发生偏离,使曲线弯曲
曲线的峰称为吸收峰,它所对应的波长称为最大吸收波长,用λmax 表示。曲线的谷所 对应的波长称为最小吸收波长,用λmin 表示。峰旁一个小的曲折称为肩峰,在吸收曲线的 波长最短一端不成峰形的部分,称为末端吸收。吸收曲线有时也可用 e 或 loge 作为纵坐标。 此外也可用百分透光度为纵坐标,但应用较少。 图 6-3 绘出了不同浓度的“稀禾定”溶液的吸收曲线。从图中看出,同一物质即使浓 度改变,其吸收曲线形状及最大吸收波长不变,三种浓度的最大吸收波长均为 283nm。 吸收曲线的用途: (1)吸收曲线的特征和形状是由分子的电子结构决定的,它反映了物质分子中能级的 变化情况; (2)它描述了物质对不同波长光的吸收能力,在定量分析中可作为选择最大吸收波长 的依据; (3)吸收曲线体现了物质的特性,不同物质具有不同特征的吸收曲线,因此可用作定 性鉴定的依据。 (三)对比尔定律的偏离 根据比尔定律的原则,当吸收池厚度不变,以吸光度对浓度作图时,应得到一条通过 原点的直线,但在实际工作中,吸光度与浓度之间的线性关系常常发生偏离,使曲线弯曲

发生正偏差或负偏差。如图6一4所示。 偏离比尔定律的因素主要有: 被测溶液浓度过大 比尔定律只适用于测定稀溶液,在浓度高时由于产生吸收的组 分中粒子密度变大,以致每个粒子都可以影响邻近粒子的电荷分布,这种粒子间的相互作用, 使吸收辐射的能力发生了改变,以致发生偏离。 2.化学偏离由于吸收组分的缔合、解离、光化学作用或与溶剂的相互作用,使吸收 峰的形状、位置、强度以及精细结构都发生变化,导致偏离 杂光的影可 比尔定律要求被测溶液吸收的光是单色光,但事实上由于分光光度计 的单色器的输出狭缝分离出的光常混有与选定谱带无关的杂光,这种多色光,则导致对比尔 定律的偏离。一般良好的可见紫外分光光度计在全谱域杂光可保持低于0.1%,多数情况下 可以不考虑杂光的影响。但是当被测试样浓度增加或波长接近紫外的短波界限时,则会导致 检测器灵敏度下降,而且使工作曲线弯向横坐标。由表6一2可见,含杂光的比率越高,对 测定灵敏度的影响就愈大 型6-?杂光对哪光度值的影响 实湖吸光度,A 其实收度A P-0.01 P-01 P-1 P-2 0.1000 0.1000 0.0999 0.0989 0.0878 1.000 0.996 0.9961 0.9926 0.9281 2.000 1.996 1.959 1.701 1.526 4.谱带宽度的影响在实际测定样品时,为了保证足够的光强,分光光度计的狭缝必 须保持一定宽度,因此,由出射狭缝投射到被测物质上的光,并不是真正的单色光,而是 个有限宽度的谱带,称为光谱带通。随着光谱带通宽度的增大, 光源谱带增宽,谱带的精细 结构逐渐消失,峰值吸光度降低,工作曲线的斜率也随之降低,从而偏离比尔定律。 5.其它因素的影响除上述主要因素外,试样中含有悬浮率或胶粒,以及会产生荧光 的物质都会使透射光强度减少而偏离比尔定律。 (四)结察度与检出限 1.精密废可见及紫外分光光度计产生误差的主要来源,在于吸光度的测量误差 根据比尔定律公式 log=sbe 可以改写为 -logT=sbc (6-4) 公式(6一4)等式左边换成自然对数,然后两边取微分,可得: 0.434 dT=sbdc (6-5) T 上述公式(6-4),(6-5)两式相除,经过整理可得下式 dc=0.434 (6-6) 如以有限值表示又可以写成
发生正偏差或负偏差。如图 6-4 所示。 偏离比尔定律的因素主要有: 1.被测溶液浓度过大 比尔定律只适用于测定稀溶液,在浓度高时由于产生吸收的组 分中粒子密度变大,以致每个粒子都可以影响邻近粒子的电荷分布,这种粒子间的相互作用, 使吸收辐射的能力发生了改变,以致发生偏离。 2.化学偏离 由于吸收组分的缔合、解离、光化学作用或与溶剂的相互作用,使吸收 峰的形状、位置、强度以及精细结构都发生变化,导致偏离。 3.杂光的影响 比尔定律要求被测溶液吸收的光是单色光,但事实上由于分光光度计 的单色器的输出狭缝分离出的光常混有与选定谱带无关的杂光,这种多色光,则导致对比尔 定律的偏离。一般良好的可见紫外分光光度计在全谱域杂光可保持低于 0.1%,多数情况下 可以不考虑杂光的影响。但是当被测试样浓度增加或波长接近紫外的短波界限时,则会导致 检测器灵敏度下降,而且使工作曲线弯向横坐标。由表 6-2 可见,含杂光的比率越高,对 测定灵敏度的影响就愈大。 4.谱带宽度的影响 在实际测定样品时,为了保证足够的光强,分光光度计的狭缝必 须保持一定宽度,因此,由出射狭缝投射到被测物质上的光,并不是真正的单色光,而是一 个有限宽度的谱带,称为光谱带通。随着光谱带通宽度的增大,光源谱带增宽,谱带的精细 结构逐渐消失,峰值吸光度降低,工作曲线的斜率也随之降低,从而偏离比尔定律。 5.其它因素的影响 除上述主要因素外,试样中含有悬浮率或胶粒,以及会产生荧光 的物质都会使透射光强度减少而偏离比尔定律。 (四)精密度与检出限 1.精密废 可见及紫外分光光度计产生误差的主要来源,在于吸光度的测量误差。 根据比尔定律公式 1 log T =bc 可以改写为 -log T=bc (6-4) 公式(6-4)等式左边换成自然对数,然后两边取微分,可得: dT d T b c 0.434 - = (6-5) 上述公式(6-4),(6-5)两式相除,经过整理可得下式: d 0.434 dT T log T c c = (6-6) 如以有限值表示又可以写成
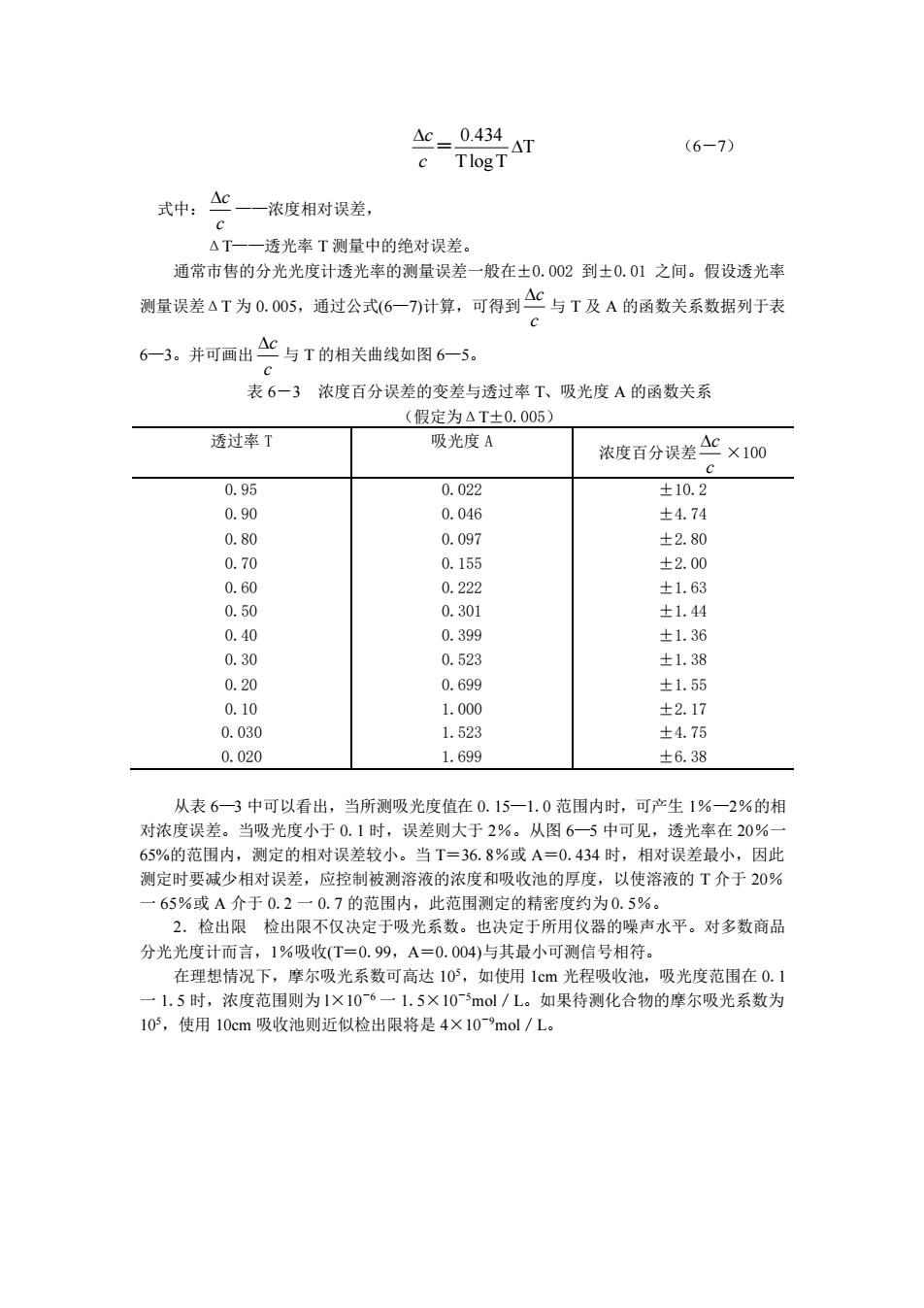
名n (6-7) 式中:C一浓度相对误差, △T一一透光率T测量中的绝对误差。 通常市售的分光光度计透光率的测量误差一般在士0.002到±0.01之间。假设透光率 测量误差△T为0.05,通过公式6一7)计算,可得到C与T及A的函数关系数据列于表 6一3。并可画出△C与T的相关曲线如图6一5。 表6一3浓度百分误差的变差与透过率T、吸光度A的函数关系 (假定为4T±0.005) 透过率了 吸光度A 浓度百分误差4c×10 c 0.95 0.022 ±10.2 0.90 0.046 ±4.74 0.80 0.097 ±2.80 0.70 0.15 ±2.00 0.60 0.222 ±1.63 0.50 0.301 +1.44 0.40 0.399 ±1.36 0.30 0.52% +1.38 0.20 0.699 ±1.5 0.10 1.000 ±2.17 0.030 1.523 ±4.75 0.020 1.699 ±6.38 从表6一3中可以看出, 当所测吸光度值在0.15一1.0范围内时,可产生1%一2%的相 对浓度误差。当吸光度小于0.1时,误差则大于2%。从图6一5中可见,透光率在20% 65%的范围内,测定的相对误差较小。当T=36.8%或A=0.434时,相对误差最小,因此 测定时要减少相对误差,应控制被测溶液的浓度和吸收池的厚度,以使溶液的T介于20% 一65%成A介于0.2一0.7的范围内,出此范围测定的拮密度约为0.5%。 2.检出限检出限不仅决定于吸光系数。也决定于所用仪器的噪声水平。对多数商品 分光光度计而言,1%吸收(T=0.99,A=0.004)与其最小可测信号相符。 在理想情况下,摩尔吸光系数可高达105,如使用1cm光程吸收池,吸光度范围在0.1 一1.5时,浓度范围则为1×106一1.5×10mol/L。如果待测化合物的摩尔吸光系数为 10,使用10cm吸收池则近似检出限将是4X109mol/L
0.434 T T log T c c = (6-7) 式中: c c ——浓度相对误差, ΔT——透光率 T 测量中的绝对误差。 通常市售的分光光度计透光率的测量误差一般在±0.002 到±0.01 之间。假设透光率 测量误差ΔT 为 0.005,通过公式(6—7)计算,可得到 c c 与 T 及 A 的函数关系数据列于表 6—3。并可画出 c c 与 T 的相关曲线如图 6—5。 表 6-3 浓度百分误差的变差与透过率 T、吸光度 A 的函数关系 (假定为ΔT±0.005) 透过率 T 吸光度 A 浓度百分误差 c c ×100 0.95 0.90 0.80 0.70 0.60 0.50 0.40 0.30 0.20 0.10 0.030 0.020 0.022 0.046 0.097 0.155 0.222 0.301 0.399 0.523 0.699 1.000 1.523 1.699 ±10.2 ±4.74 ±2.80 ±2.00 ±1.63 ±1.44 ±1.36 ±1.38 ±1.55 ±2.17 ±4.75 ±6.38 从表 6—3 中可以看出,当所测吸光度值在 0.15—1.0 范围内时,可产生 1%—2%的相 对浓度误差。当吸光度小于 0.1 时,误差则大于 2%。从图 6—5 中可见,透光率在 20%一 65%的范围内,测定的相对误差较小。当 T=36.8%或 A=0.434 时,相对误差最小,因此 测定时要减少相对误差,应控制被测溶液的浓度和吸收池的厚度,以使溶液的 T 介于 20% 一 65%或 A 介于 0.2 一 0.7 的范围内,此范围测定的精密度约为 0.5%。 2.检出限 检出限不仅决定于吸光系数。也决定于所用仪器的噪声水平。对多数商品 分光光度计而言,1%吸收(T=0.99,A=0.004)与其最小可测信号相符。 在理想情况下,摩尔吸光系数可高达 10 5,如使用 1cm 光程吸收池,吸光度范围在 0.1 一 1.5 时,浓度范围则为 l×10-6 一 1.5×10-5mol/L。如果待测化合物的摩尔吸光系数为 105,使用 10cm 吸收池则近似检出限将是 4×10-9mol/L
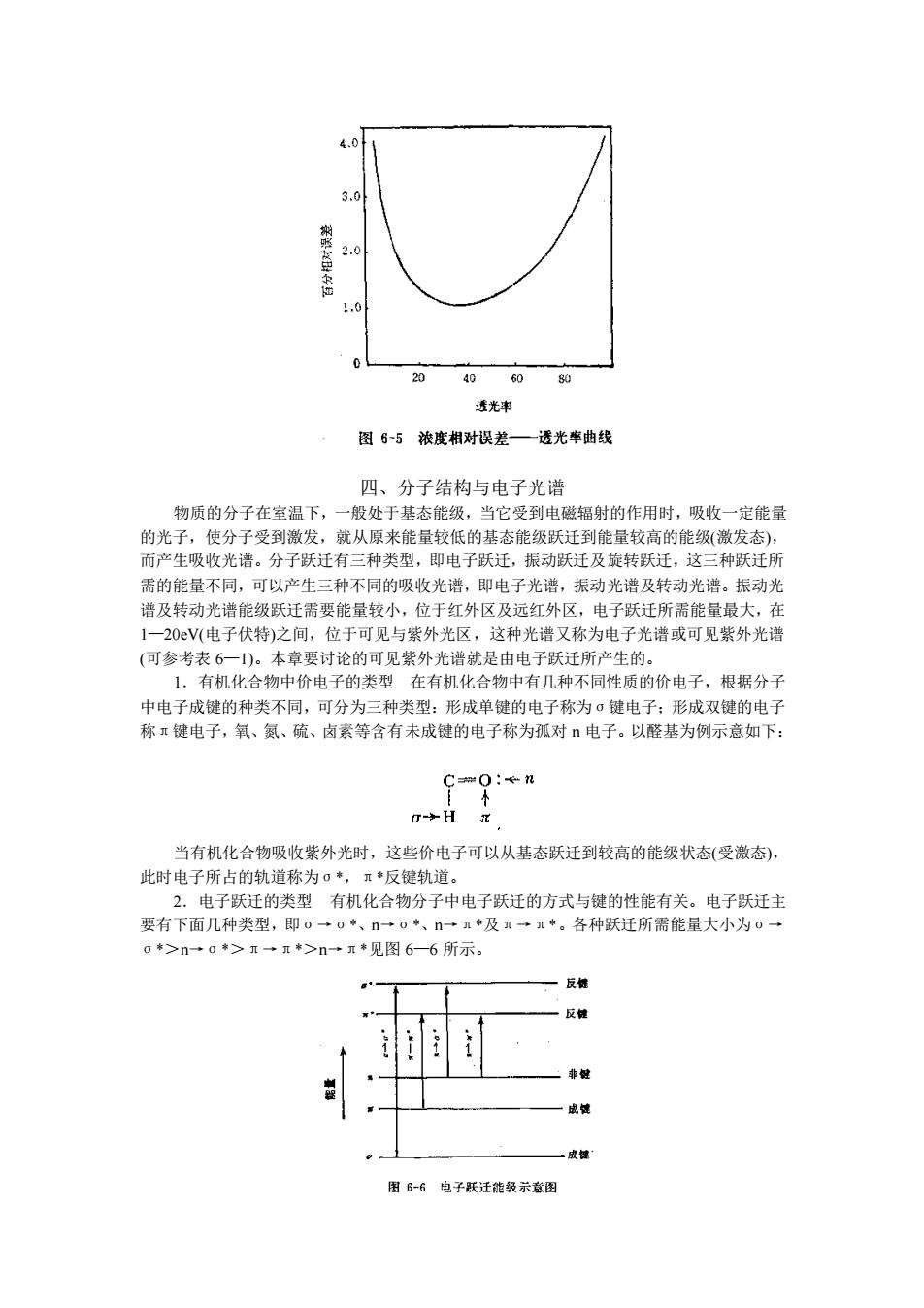
4.0 3 1.0 20 40 60 80 透光事 图6-5浓度相对误差一透光率曲线 四、分子结构与电子光谱 物质的分子在室温下,一般处于基态能级,当它受到电磁辐射的作用时,吸收一定能量 的光子,使分子受到激发,就从原来能量较低的基态能级跃迁到能量较高的能级(激发态) 而产生吸收光谱。分子跃迁有三种类型, 即电子跃迁, 及旋转跃迁,这三种跃迁月 需的能量不同,可以产生三种不同的吸收光谱,即电子光谱,振动光谱及转动光谱。振动光 谱及转动光谱能级跃迁需要能量较小,位于红外区及远红外区,电子跃迁所需能量最大,在 1一20V(电子伏特)之间,位于可见与紫外光区,这种光谱又称为电子光谱或可见紫外光谱 (可参考表6一)。本章要讨论的可见紫外光谱就是由电子跃迁所产生的。 1有机化合物中价电子的类型在有机化合物中有几种不同性质的价电子,根据分了 中电子成键的种类不同,可分为三种类型:形成单键的电子称为σ键电子:形成双键的电手 称π键电子,氧、氨、硫、卤素等含有未成键的电子称为孤对电子。以醛基为例示意如下: 90:en 当有机化合物吸收紫外光时,这些价电子可以从基态跃迁到较高的能级状态(受激态), 此时电子所占的轨道称为。*,π*反键轨道。 2.电子跃迁的类型有机化合物分子中电子跃任的方式与键的性能有关。电子跃任主 要有下面几种类型,即。一0*、n一*、n一◆及算一*。各种跃迁所需能量大小为0一 0>n→>一元*>n一+见图6-6所示。 反 成健 图6-6电子跃迁能级示意图
四、分子结构与电子光谱 物质的分子在室温下,一般处于基态能级,当它受到电磁辐射的作用时,吸收一定能量 的光子,使分子受到激发,就从原来能量较低的基态能级跃迁到能量较高的能级(激发态), 而产生吸收光谱。分子跃迁有三种类型,即电子跃迁,振动跃迁及旋转跃迁,这三种跃迁所 需的能量不同,可以产生三种不同的吸收光谱,即电子光谱,振动光谱及转动光谱。振动光 谱及转动光谱能级跃迁需要能量较小,位于红外区及远红外区,电子跃迁所需能量最大,在 1—20eV(电子伏特)之间,位于可见与紫外光区,这种光谱又称为电子光谱或可见紫外光谱 (可参考表 6—1)。本章要讨论的可见紫外光谱就是由电子跃迁所产生的。 1.有机化合物中价电子的类型 在有机化合物中有几种不同性质的价电子,根据分子 中电子成键的种类不同,可分为三种类型:形成单键的电子称为σ键电子;形成双键的电子 称π键电子,氧、氮、硫、卤素等含有未成键的电子称为孤对 n 电子。以醛基为例示意如下: 当有机化合物吸收紫外光时,这些价电子可以从基态跃迁到较高的能级状态(受激态), 此时电子所占的轨道称为σ*,π*反键轨道。 2.电子跃迁的类型 有机化合物分子中电子跃迁的方式与键的性能有关。电子跃迁主 要有下面几种类型,即σ→σ*、n→σ*、n→π*及π→π*。各种跃迁所需能量大小为σ→ σ*>n→σ*>π→π*>n→π*见图 6—6 所示
通常当电子由一个能级跃迁到另一个能级时,同时伴随有振动能级和转动能级的跃迁。 因此,所得到的吸收光谱不是线状光谱而是带状光谱。 生色基(又称发色基团)有机分子中能够吸收紫外或可见光而引起电子跃迁的不饱 和基团叫做生色基(Chromophores)又称发色基团(Chromophoric group)。生色基主要是指 共轭多烯系统,含有未成键电子对的双键结构或基团、芳香基团及部分含有未成键电子对杂 原子的基因。常见生色基的最大吸收峰贝表6一4 表6一4常见生色基的最大吸收蜂 发色团 化合物 格剂 e )c-cC0 CH.COCH, 正己烷 {9 15 -COOH CH,COOH 水 204 % Cr-s CH.CSCH. 水 400 -N-N- CH,N-NCH, 乙配 -N=0 CH(CH,)-NO 乙醚 { 00 CH,NO. 水 270 0 -ON C.HONO 二六环 270 名 -0-N-O CH,(CH),ONO 正己皖 {3测 {620 C-C-C-C H.C-CH-CH-CH, 正已控 217 21000 2,助色基(又称助色团)某些含有未成键电子对的原子或基团,称为助色基 ),助色基本身在紫外区没有特征吸收带,但当它们与生色基连在一起时,可以 使生色基所产生的吸收峰向长波方向移动, 并使其强度增加。 这类基团有 OH, -SH、 -SOH、 COOH. 一Br等。 3.红移、蓝移、增色效应、减色效应红移Bathchromic):指因结构变化(如顺反异构) 共轭体系加大、助色基效应、溶液pH变化等引起吸收峰向长波移动的效应。 蓝移Hypsochromic):指由于取代基或溶剂等的影响,使吸收峰向短波方向移动的效应。 增色效应(ype chromic c):由于结构变化或其它原因使吸收强度增加的现象。 减色效应(Hypochromle effect):使吸收强度减弱的现象 (三)有机化合物结构与电子跃迁及吸收谱带的关系 1.饱和单键碳氢化合物只含σ健电子,电子结合的很牢固,只有吸收很大能量后才 能产生σ一c◆跃迁。在近紫外区没有吸收峰,只有在远紫外区(10一200m)才有吸收峰。 这已超出了紫外可见分光光度计的范围,应用不多。正因为饱和碳氢化合物在近紫外区内不 产生吸收峰,故常用作紫外光谱分 析中的溶剂如已烷、庚烷、 戊烷等 2.饱和烃中氢被氧、氮、硫、卤素等原子所取代由于这类原子中有孤对电子(如 一HH、一OH、一S、一X等)n电子较o电子容易激发,可产生n一o*跃迁,此种跃迁 所需能量较0一。·小。含这些原子的化合物在150一250m的紫外区有吸收峰、少部分在
通常当电子由一个能级跃迁到另一个能级时,同时伴随有振动能级和转动能级的跃迁。 因此,所得到的吸收光谱不是线状光谱而是带状光谱。 (二)几个常用术语 1.生色基(又称发色基团) 有机分子中能够吸收紫外或可见光而引起电子跃迁的不饱 和基团叫做生色基 (Chromophores)又称发色基团(Chromophoric group)。生色基主要是指 共轭多烯系统,含有未成键电子对的双键结构或基团、芳香基团及部分含有未成键电子对杂 原子的基因。常见生色基的最大吸收峰见表 6—4。 2.助色基(又称助色团) 某些含有未成键电子对的原子或基团,称为助色基 (Auxochrome),助色基本身在紫外区没有特征吸收带,但当它们与生色基连在一起时,可以 使生色基所产生的吸收峰向长波方向移动,并使其强度增加。这类基团有-OH、-NH2、 -SH、—SO3H、一 COOH、一 C1、一 Br 等。 3.红移、蓝移、增色效应、减色效应 红移(Bathchromic):指因结构变化(如顺反异构)、 共轭体系加大、助色基效应、溶液 pH 变化等引起吸收峰向长波移动的效应。 蓝移(Hypsochromic):指由于取代基或溶剂等的影响,使吸收峰向短波方向移动的效应。 增色效应(Hyperchromic effect):由于结构变化或其它原因使吸收强度增加的现象。 减色效应(Hypochromlc effect):使吸收强度减弱的现象。 (三)有机化合物结构与电子跃迁及吸收谱带的关系 1.饱和单键碳氢化合物 只含σ键电子,电子结合的很牢固,只有吸收很大能量后才 能产生σ→σ*跃迁。在近紫外区没有吸收峰,只有在远紫外区(10 一 200 nm)才有吸收峰。 这已超出了紫外可见分光光度计的范围,应用不多。正因为饱和碳氢化合物在近紫外区内不 产生吸收峰,故常用作紫外光谱分析中的溶剂如已烷、庚烷、戊烷等。 2.饱和烃中氢被氧、氮、硫、卤素等原子所取代 由于这类原子中有孤对 n 电子(如 一 HH2、一 OH、一 S、一 X 等)n 电子较σ电子容易激发,可产生 n→σ*跃迁,此种跃迁 所需能量较σ→σ*小。含这些原子的化合物在 150 一 250 nm 的紫外区有吸收峰、少部分在
近紫外区(<200nm)有吸收。表6-5列出了能进行n一0*跃迁的一些基团和原子。 表6-5能滋进行→深迁的一些基团和原子 取代恭 化介制 大愿整长 -NH. CH,I(饱和泾中) 253 -SH C,H,SH(水) 220 CH,-S-CH,(乙醇中) 229 -s-S- C,He.-S一S-C,H:(乙醇中) 252 3.不饱和碳氢化合物含有π键电子,它比电子更易于激发可以产生再→π*跃迁, 此种跃迁的能量较g→o◆及n→g*都小。吸收峰大都位于紫外区(200nm)。 具有共双键的化合物, 由于相间的与键相互作用。形成大键 使电子更容易激 发,可使吸收峰波长向长波方向移动。共轭分子的吸收光谱通常有两条谱 种称为】 带(德文“共轭作用”得名),是由→·*跃迁所产生。这种跃迁是整个共轭键的基态向激 发态的跃迁。例如C=C一C=C一C一C=C一C*:另一种称为R带(德文“基团”得名)为 ·π跃迁所产生。为共轭体系一端的单个生色基的跃迁。如一C=O、一NO2、一N=N一 N=O等 K带是强带 值大约为10000一200000。K带的波长随共轭键的长度而异,共轨体 系越大,K带波长越长,甚致可移到可见光区,使化合物带有颜色,吸收强度也增大,这是 紫外光谱中一条重要的规律。 R带是弱带,飞值小于1000,其波长不随共轭键的长度而变化。表6一6列出某些共轭 分子的K带及R带。 表6-6某些共轭分子的吸收光诸 带 R稀 化合物 共钜体系 入.(am) A(nm) 了一场 C-C-CC 217 21000 巴豆油醛 C-C-C-0 217 16000 321 二甲基丁二炔 C=C-C=c 165 227 360 丁嗪 CN一N= 205 13000 丙基乙炔丙副 C=C-C- 214 500( 308 二乙酰 40 4。芳香族化台物主要包括及若香杂环的衍生物 (①)苯:苯为环状共轭体系 。其紫外光谱特征是具有 一*跃迁所引起的三组谱带。在 180一184nm处(e=47000)、有强吸收的E带,因在远紫外区,实用意义不大。在204m 处(E=7900)有中强吸收的E2带,E2带在末端范围,也不常用,在230一270nm处e=200) 有弱吸收的B带。B带是由π→π*跃迁及振动效应的重叠引起的一系列锐峰,又称“精细 结构”吸收峰。在气体或非极性溶剂中精细结构较清楚,在极性溶剂中,精细结构消失。图 6一7、图6一8分别为茶的紫外光谱及苯酚的B吸收带
近紫外区(<200 nm)有吸收。表 6—5 列出了能进行 n→σ*跃迁的一些基团和原子。 3.不饱和碳氢化合物 含有π键电子,它比 n 电子更易于激发可以产生π→π*跃迁, 此种跃迁的能量较σ→σ*及 n→σ*都小。吸收峰大都位于紫外区(200 nm)。 具有共轭双键的化合物,由于相间的π与π键相互作用。形成大π键,使电子更容易激 发,可使吸收峰波长向长波方向移动。共轭分子的吸收光谱通常有两条谱带,一种称为 K 带(德文“共轭作用”得名),是由π→π*跃迁所产生。这种跃迁是整个共轭键的基态向激 发态的跃迁。例如 C=C—C=C→C +一 C=C—C +;另一种称为 R 带(德文“基团”得名)为 n→π*跃迁所产生。为共轭体系一端的单个生色基的跃迁。如-C=O、-NO2、-N=N 一、 一 N=O 等。 K 带是强带,ε值大约为 10000 一 200000。K 带的波长随共轭键的长度而异,共轨体 系越大,K 带波长越长,甚致可移到可见光区,使化合物带有颜色,吸收强度也增大,这是 紫外光谱中一条重要的规律。 R 带是弱带,ε值小于 1000,其波长不随共轭键的长度而变化。表 6—6 列出某些共轭 分子的 K 带及 R 带。 4.芳香族化台物 主要包括苯及芳香杂环的衍生物: (1)苯:苯为环状共轭体系。其紫外光谱特征是具有π→π*跃迁所引起的三组谱带。在 180-184nm 处(ε=47000)、有强吸收的 El 带,因在远紫外区,实用意义不大。在 204nm 处(ε=7900)有中强吸收的 E2 带,E2 带在末端范围,也不常用,在 230-270 nm 处(ε=200) 有弱吸收的 B 带。B 带是由π→π*跃迁及振动效应的重叠引起的一系列锐峰,又称“精细 结构”吸收峰。在气体或非极性溶剂中精细结构较清楚,在极性溶剂中,精细结构消失。图 6—7、图 6—8 分别为苯的紫外光谱及苯酚的 B 吸收带