正在加载图片...
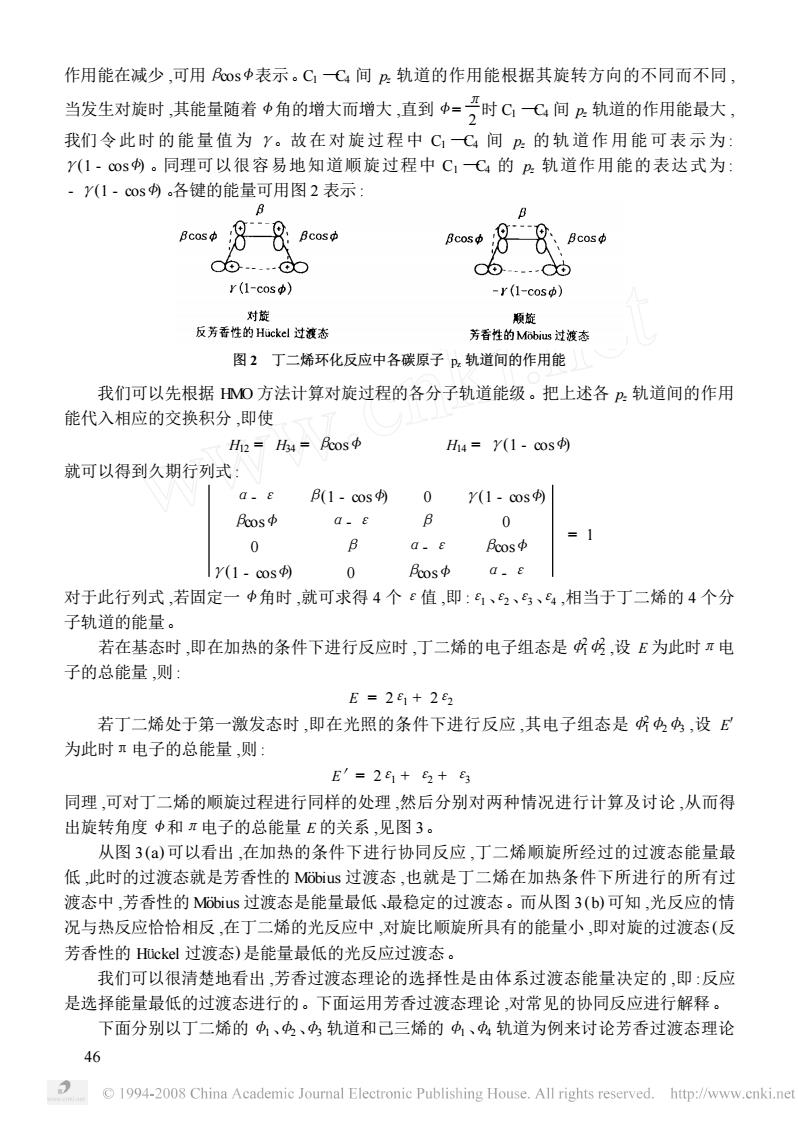
作用能在减少,可用民0s中表示。CC4间2轨道的作用能根据其旋转方向的不同而不同 当发生对旋时,其能量随着中角的增大而增大,直到中=时C(间户轨道的作用能最大, 我们令此时的能量值为y。故在对旋过程中C,C间B的轨道作用能可表示为: Y(1·c®s内。同理可以很容易地知道顺旋过程中C,C的?轨道作用能的表达式为: ·Y(1·cos。各键的能量可用图2表示: 、Bcos中 c6.…d0 06 r(1-cos) -r(l-cos) 反芳香性的Hckl过液态 图2丁二烯环化反应中各碳原子,轨道间的作用能 我们可以先根据MO方法计算对旋过程的各分子轨道能级。把上述各P轨道间的作用 能代入相应的交换积分,即使 =h4=民os中 H4=Y(1-cos) 就可以得到久期行列式: 0.E B(1-cos 0 Y(1-cos Fos中 G-E B 0 =1 0 B a.E 民os中 y(1-cos) 0 os中a.e 对于此行列式,若固定一中角时,就可求得4个ε值,即:6、2、马、,相当于丁二烯的4个分 子轨道的能量 若在基态时,即在加热的条件下进行反应时,丁二烯的电子组态是所号,设E为此时π电 子的总能量,则 E=2e1+282 若丁二烯处于第一激发态时,即在光照的条件下进行反应,其电子组态是4中,设E 为此时电子的总能量,则」 E′=2+5+ 同理,可对丁二烯的顺旋过程进行同样的处理,然后分别对两种情况进行计算及讨论,从而得 出旋转角度中和π电子的总能量E的关系,见图3。 从图3(a)可以看出,在加热的条件下进行协同反应,丁二烯顺旋所经过的过渡态能量最 低,此时的过渡态就是芳香性的Mus过渡态,也就是丁二烯在加热条件下所进行的所有过 渡态中,芳香性的Mus过渡态是能量最低、最稳定的过渡态。而从图3(b)可知,光反应的情 况与热反应恰恰相反,在丁二烯的光反应中,对旋比顺旋所具有的能量小,即对旋的过渡态(反 芳香性的Huckel过渡态)是能量最低的光反应过渡态。 我们可以很清楚地看出,芳香过渡态理论的选择性是由体系过渡态能量决定的,即:反应 是选择能量最低的过渡态进行的。下面运用芳香过渡态理论,对常见的协同反应进行解释。 下面分别以丁二烯的中、中、中轨道和己三烯的中、中轨道为例来讨论芳香过渡态理论 1994-2008 China Academic Joural Electronic Publishing House.All rights reserved.http:/www.enki.ne作用能在减少 ,可用βcos <表示。C1 —C4 间 pz 轨道的作用能根据其旋转方向的不同而不同 , 当发生对旋时 ,其能量随着 <角的增大而增大 ,直到 < = π 2 时 C1 —C4 间 pz 轨道的作用能最大 , 我们令此时的能量值为 γ。故在对旋过程中 C1 —C4 间 pz 的轨道作用能可表示为 : γ(1 - cos <) 。同理可以很容易地知道顺旋过程中 C1 —C4 的 pz 轨道作用能的表达式为 : - γ(1 - cos <) 。各键的能量可用图 2 表示 : 图 2 丁二烯环化反应中各碳原子 pz 轨道间的作用能 我们可以先根据 HMO 方法计算对旋过程的各分子轨道能级。把上述各 pz 轨道间的作用 能代入相应的交换积分 ,即使 H12 = H34 = βcos < H14 = γ(1 - cos <) 就可以得到久期行列式 : α- ε β(1 - cos <) 0 γ(1 - cos <) βcos < α- ε β 0 0 β α- ε βcos < γ(1 - cos <) 0 βcos < α- ε = 1 对于此行列式 ,若固定一 <角时 ,就可求得 4 个ε值 ,即 :ε1、ε2、ε3、ε4 ,相当于丁二烯的 4 个分 子轨道的能量。 若在基态时 ,即在加热的条件下进行反应时 ,丁二烯的电子组态是φ2 1φ2 2 ,设 E 为此时π电 子的总能量 ,则 : E = 2ε1 + 2ε2 若丁二烯处于第一激发态时 ,即在光照的条件下进行反应 ,其电子组态是φ2 1φ2φ3 ,设 E′ 为此时π电子的总能量 ,则 : E′= 2ε1 + ε2 + ε3 同理 ,可对丁二烯的顺旋过程进行同样的处理 ,然后分别对两种情况进行计算及讨论 ,从而得 出旋转角度 <和π电子的总能量 E 的关系 ,见图 3。 从图 3 (a) 可以看出 ,在加热的条件下进行协同反应 ,丁二烯顺旋所经过的过渡态能量最 低 ,此时的过渡态就是芳香性的 MÊbius 过渡态 ,也就是丁二烯在加热条件下所进行的所有过 渡态中 ,芳香性的 MÊbius 过渡态是能量最低、最稳定的过渡态。而从图 3 (b) 可知 ,光反应的情 况与热反应恰恰相反 ,在丁二烯的光反应中 ,对旋比顺旋所具有的能量小 ,即对旋的过渡态(反 芳香性的 Hückel 过渡态) 是能量最低的光反应过渡态。 我们可以很清楚地看出 ,芳香过渡态理论的选择性是由体系过渡态能量决定的 ,即 :反应 是选择能量最低的过渡态进行的。下面运用芳香过渡态理论 ,对常见的协同反应进行解释。 下面分别以丁二烯的φ1、φ2、φ3 轨道和己三烯的φ1、φ4 轨道为例来讨论芳香过渡态理论 64